L-色氨酸重组高产菌株发酵工艺的优化
2018-10-20吕磊宋国田刘永飞刘燕霏杨建德通信作者张大伟通信作者
吕磊,宋国田,刘永飞,刘燕霏,杨建德,通信作者,张大伟,通信作者
L-色氨酸重组高产菌株发酵工艺的优化
吕磊1,宋国田2,刘永飞2,刘燕霏1,杨建德1,通信作者,张大伟2,通信作者
(1. 天津农学院 动物科学与动物医学学院,天津 300384;2. 中国科学院 天津工业生物技术研究所,天津 300380)
L-色氨酸(L-tryptophan,L-Trp)是一种限制性氨基酸,是人体和动物体生长发育等重要生理活动的必需氨基酸之一,也是合成许多活性物质的关键氨基酸之一,广泛应用于医药、饲料和食品等方面,具有十分重要的商业价值。微生物发酵生产的L-色氨酸近些年来一直备受关注,主要是因为其价格低廉、纯度高、易分离等特点,因此利用微生物生产L-色氨酸在大规模工业生产上具有十分可观的应用前景。利用色氨酸高产基因,经基因工程重组到大肠杆菌内,筛选出色氨酸高产菌株。通过控制溶氧、碳源、pH值及残糖含量来有效提高L-色氨酸的产量。利用原始菌株探究发酵过程中发酵罐内的残糖含量,发现残糖含量控制在1% 时,菌体生长最为良好,生长周期最长。将不同比例的糖蜜与葡萄糖混合,作为发酵时的碳源,结果显示当比例为3∶1时L-色氨酸产量最大;在发酵过程中控制pH条件,将产量提高到18.9 g/L;将溶氧条件控制在35%、40% 两个范围,结果显示溶氧40% 时L-色氨酸的产量达到27 g/L;将补料碳源换为60% 的葡萄糖及70% 的小麦糖,结果显示葡萄糖作为唯一碳源时,L-色氨酸产量较高。
L-色氨酸;发酵;优化;高产菌株
L-色氨酸是人体和动物生命活动八种必需氨基酸之一,对人和动物的生长发育、新陈代谢起重要作用,被称为第二必需氨基酸,广泛应用于医药、食品和饲料等方面[1-2]。在食品工业上主要用作食品营养增补剂,国内外多地都将L-色氨酸制成食品添加剂,当机体摄入这些食品后会产生许多积极的影响,例如提高人体对植物蛋白质的利用率,加速蛋白分解利用[3]等。L-色氨酸可参与体内脂肪代谢、降低动物肝脏脂肪含量,从而达到提高禽畜瘦肉比的目的[4]。色氨酸在医学方面的应用也十分广泛,起着不可或缺的作用。色氨酸对治疗失眠症、抑郁症、躁狂症和止痛有显著效果。临床研究发现,L-色氨酸与铁剂、维生素合用可增强治疗运动性贫血的疗效,与组氨酸一起使用还可治疗消化道溃疡[5]。
目前,世界上L-色氨酸的市场年需求量在5万t以上[6],世界范围内生产和消耗严重不平衡,在众多生产方法中发酵法是较为廉价合适的方法,然而在生产菌过程中存在很多复杂调控因子致使难以实现工业化,呈现出供不应求的状况,所以开发出一种新的低成本的色氨酸高产菌,实现工业化生产迫在眉睫。近年来,随着重组DNA技术的不断发展、成熟,利用微生物发酵生产L-色氨酸的研究突飞猛进。这种技术主要克服了超远缘杂交育种的障碍,将所需的目的基因即将微生物具有的氨基酸生物合酶的基因连接于质粒,再导入到大肠杆菌中,将其转化成氨基酸生产菌,达到所需基因扩增、酶量增加的目的,从而提高氨基酸转化率。但技术要求非常高,实施困难很大,还有很多不确定因素,现今国外只有几家公司大规模工业化生产L-色氨酸,其中三家日本公司是利用微生物法生产L-色氨酸,主要应用于生产饲料添加剂方面。
本文利用葡萄糖、糖蜜及小麦糖,在3 L发酵罐中发酵生产L-色氨酸。通过多次直接发酵实验,改变发酵时的碳源、溶氧、pH及残糖含量的指标,来优化发酵工艺,检测分析L-色氨酸的产量,尽可能提高其产量,从而降低工业生产成本,实现大规模工业化生产。
1 材料与方法
1.1 主要菌株、溶液和试剂
1.1.1 发酵所用色氨酸工程菌为中科院天津工业生物技术研究所开发的菌株XLLT-4。
60% 葡萄糖溶液:称取660 g一水合葡萄糖,加蒸馏水定容至1 L,作为发酵时的补料碳源和糖蜜及70%小麦糖一起115 ℃ 灭菌30 min;
四环素(15 mg/mL):称取0.15 g四环素粉末,加无水乙醇定容至10 mL,过滤除菌,因为试验菌株带有四环素抗性,所以四环素主要作用是防止培养基中生长杂菌;
30%(/)磷酸:量取30 mL的磷酸溶液并加入70 mL的去离子水,主要用于发酵过程控制发酵液pH;
MgSO4·7H2O:称取1 g MgSO4·7H2O固体用去离子水定容至2 mL,过滤除菌,作为大肠杆菌生长繁殖所必需的微量元素;
FeSO4·7H2O:称取7.5 mg FeSO4·7H2O用去离子水定溶至500 μL,过滤除菌,作为大肠杆菌生长繁殖所必需的微量元素;
L-丝氨酸(L-ser):称取0.5 g L-ser粉末溶于10 mL去离子水中,121 ℃灭菌30 min,L-丝氨酸是合成L-色氨酸必备的前体物质;
10% 异丙醇:量取10 mL的异丙醇,用去离子水定容至1 L,进行各项测试时都需用10%异丙醇冲洗色谱柱。
1.1.2 试管LB培养基按常规方法制备,用于活化冻存菌株,37 ℃,220 r/min,14~16 h。
1.1.3 种子培养基(/L):60%葡萄糖 20 g,酵母粉 15 g,柠檬酸钠0.5 g,KH2PO41.5 g,FeSO4· 7H2O 15 mg,VB1100 mg,MgSO4·7H2O 1 g。
按发酵罐工作体积(1 L)10% 的接种量制备种子培养基,按比例称取两份,搅拌均匀,分装入两个500 mL摇瓶中,121 ℃灭菌20 min。
取出隔夜活化的LB试管培养基,按1∶100的比例转接入种子培养基,37 ℃,220 r/min,14~16 h。
1.1.4 发酵罐培养基(/L):60%葡萄糖20 g,(NH4)2SO410 g,KH2PO45 g,MgSO45 g,酵母粉2 g,FeSO4·7H2O 15 mg,MnSO4·H2O 15 mg,CuSO4·5H2O 4 mg,CoCl2·6H2O 4 mg,ZnSO4·7H2O 4 mg,生物素 30 μg,L-丝氨酸 0.5 g和甜菜碱 1 g。
所用3 L发酵罐工作时装液量为1 L,配制双份,需要用1.8 L的蒸馏水溶解试剂,121 ℃ 灭菌20 min。
1.1.5 色谱工作液:根据液相色谱仪操作说明,配制A、B、C、D相,如下。
A相是称取12.436 g磷酸二氢钠(色谱纯)定容至2 L去离子水中,并用氢氧化钠准确调节pH为7.8。
B相是将甲醇(色谱纯)、乙腈(色谱纯)、去离子水按照体积比45∶45∶10在通风橱称量混匀。
C相是水相,量取1 L去离子水。
D相是10%的异丙醇,100 mL异丙醇溶于900 mL去离子水中。
流动相药品均需抽滤,再做超声处理,以除去溶液配制时产生的气泡,避免对液相色谱仪及色谱柱造成损坏。
配制标品时,先配制L-色氨酸母液,浓度为10 g/L。称取10 mg L-色氨酸溶于1 mL去离子水中。再利用母液分别配制浓度为0.5、1.0、1.5、2.0、2.5 g/L的样品。配制完成后用1 mL注射器和无水滤膜过滤,各取1 mL装入样品瓶中即可。
1.2 方法
本文利用实验室改造并筛选出的L-色氨酸高产菌,采用微生物直接发酵法生产L-色氨酸。每批次做两个试验,互为对照,利用3 L发酵罐发酵。在发酵开始前,保证除单一变量(溶氧、pH、残糖含量及碳源)外的所有条件基本一致,这样不会影响结果分析。在发酵开始后,每隔2 h测一次600(细菌光密度),在600为60左右时,开始留样,以便检测L-色氨酸产量。试验目的是为实现大规模工业化生产L-色氨酸,所以初次试验采用混合碳源作为发酵补料,但也应保持葡萄糖与糖蜜的比例适中。首次试验参照文献[4]的方法,将发酵时的溶氧控制在30%。考虑到发酵时可能会有副产物乙酸产生,所以将pH初步设定在7.0;第二次试验参照文献[5]的方法,将pH改为6.8,并设置了pH为6.6的对照试验组;由于本试验菌株与文献中的菌株不同,在分析第二次试验结果后,将溶氧浓度改为40%,并设置了对照试验组溶氧浓度45%,产量明显提高。最后利用60%的葡萄糖和70%的小麦糖做检测试验,结果显示葡萄糖作为唯一碳源时,L-色氨酸的产量最高。
实验最后一步是使用HPLC法测定发酵液中色氨酸浓度,在一定浓度范围(0.5~2.5 g/L)内,色氨酸吸收峰峰面积与色氨酸浓度呈线性关系(图1)。利用图1公式可计算出每批次发酵的L-色氨酸的浓度。

图1 HPLC法检测色氨酸浓度的标准曲线
色氨酸的转化率大致分为两个部分。当用60%葡萄糖或70%小麦糖作为碳源时,色氨酸转化率代表色氨酸总产量(g)/消耗糖液中的60%葡萄糖或小麦糖总量(g)×100%;当用糖蜜作为碳源时,色氨酸转化率代表色氨酸总产量(g)/底糖和补料消耗糖蜜与葡萄糖混糖总量(g)×100%。
2 结果与分析
2.1 不同比例混合碳源对L-色氨酸发酵的影响
在进行首次发酵实验时,将葡萄糖和糖蜜分别以1∶6和1∶3的比例混匀,作为补料碳源,结果如图2所示。
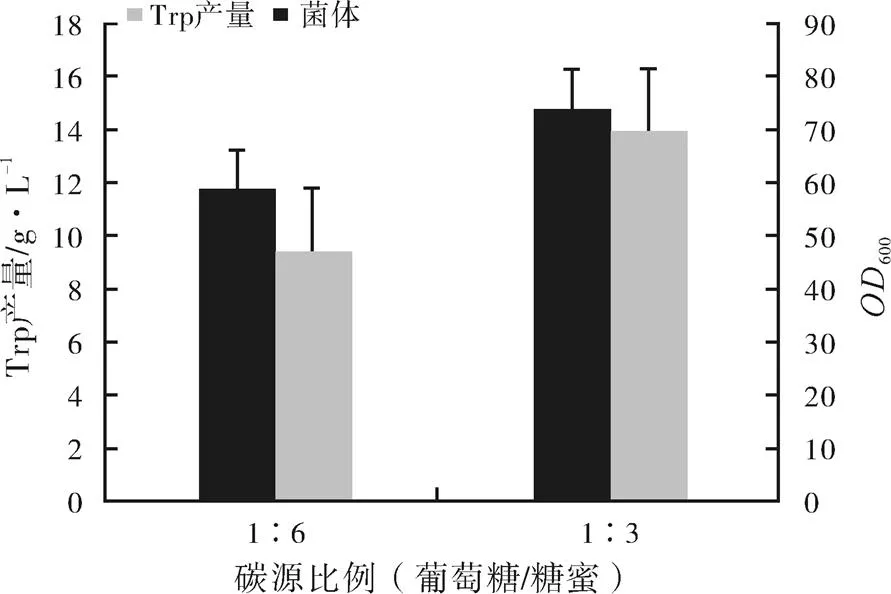
图2 不同比例混合碳源对L-色氨酸发酵的影响
注:差异显著性=0.06
根据图2可知,不同比例混合碳源对发酵罐内菌体量及L-色氨酸产量的影响有所差异,最明显的是菌体量。在葡萄糖:糖蜜为1∶6的发酵罐中,菌体量600值为47.2,而改变二者比例为1∶3时,600提高了56.4%。菌体量提高后,相应L-色氨酸产量也明显提高。
2.2 pH值对L-色氨酸发酵的影响
因为发酵过程中,大肠杆菌会有些副产物,例如乙酸等,会使发酵液变酸,影响菌体生长代谢,所以在第一次试验的基础上,改变第二次试验中发酵罐内的pH值,分别为6.8、6.6,结果如图3所示。
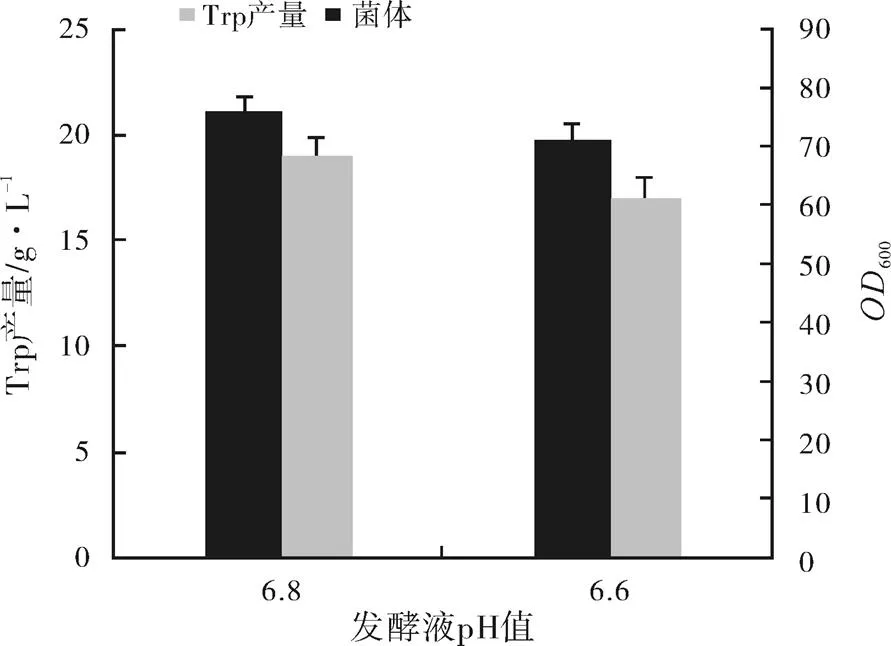
图3 不同pH值对L-色氨酸发酵的影响
注:差异显著性=0.04
与第一次试验中pH为7.0互为对照,研究发现,当pH为6.6时,L-色氨酸的产量比pH为6.8时还略微偏低,但与pH为7.0时相差无几。最直观表现在发酵罐内菌体量的差异,600值分别相差了4.8和2.4。在发酵中,菌体量是影响最后产量最为重要的因素之一,所以在下次发酵时改变pH为6.8。
2.3 溶氧对L-色氨酸发酵的影响
基于前两次试验的最优条件,本次改变发酵罐内的溶氧条件,结果如图4所示。

图4 不同溶氧对L-色氨酸发酵的影响
注:差异显著性=0.01
结合图2中溶氧含量=30% 时的数据,发现当=40% 时L-色氨酸产量最高,达到 27 g/L,而溶氧条件的改变对菌体量的影响几乎不大。在发酵的不同时间,大肠杆菌的菌体量及呼吸强度不同,发酵罐内的溶氧条件也不停变化,因此需调节通气量及转速来保持发酵罐内的溶氧浓度。由此可见,发酵时保持溶氧浓度的稳定有利于L-色氨酸产量的提高。
2.4 综合检测试验
采用之前探索出的条件,再做一次验证试验,利用60%的葡萄糖和70%的小麦糖进行一次发酵。结果如图5所示。
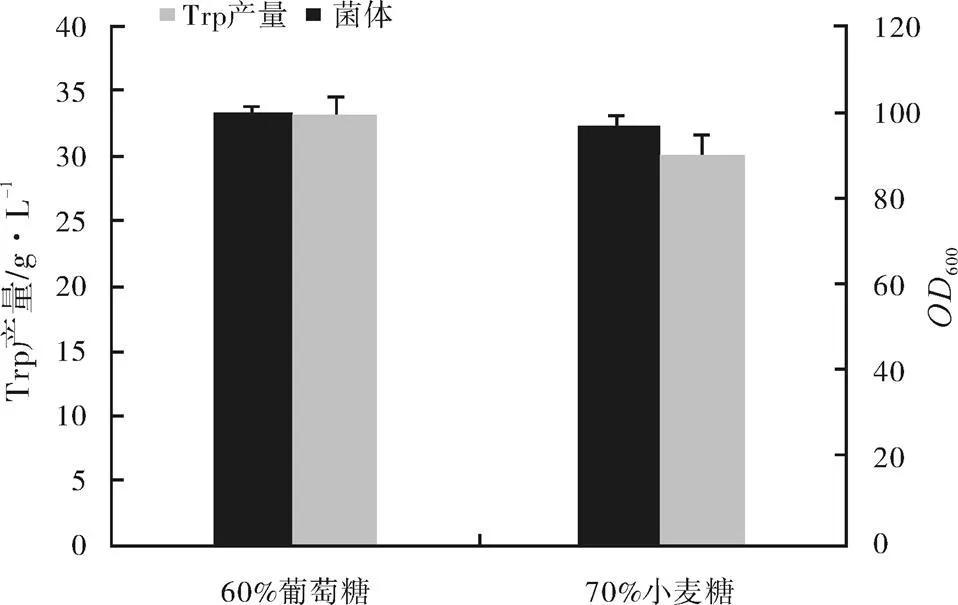
图5 纯碳源对L-色氨酸发酵的影响
注:差异显著性=0.002
结果显示,利用60%的葡萄糖作为唯一碳源时,L-色氨酸的产量和菌体量均为最高,菌体量比混合碳源发酵时提高了35.2%,产量调高了135.7%,对应的转化率也提高了2.9%。利用70%的小麦糖发酵,虽然产量和菌体量也非常高,但还是60%的葡萄糖作用效果更为明显。
3 讨论
L-色氨酸的生产最早主要依靠化学合成法和蛋白质水解法。胡永红等[7]叙述了蛋白质水解法,由于色氨酸本身在蛋白质及各种谷物原料中含量不是很高,提取时蛋白质容易被破坏,所以此种水解蛋白质的方法并不适用。刘红利等[8]用苯肼与丙烯醛和乙酰氨基丙二酸二乙酯的加成产物进行缩合反应,生成苯腙化合物,然后在酸性条件下环化,再在碱性条件下脱羧,最后对其水解就可得到DL-色氨酸,虽然得到较高的总收率(43.9%),但有机物污染较大,对环境和健康带来很大威胁,结构不单一,且后续处理花费较高。许前会等[9]以芦竹碱和海因为原料,经缩水、水解合成DL-氨基酸,收率达41.6%,但后续涉及到的碘甲烷等物质对环境危害较大,同时也具有结构不单一的不足。盖利刚等[10]发明了一种酪氨酸、色氨酸的化学制备方法,先将含氨基聚合物、芳香醛和无机酸加入到醇水溶液中,回流,固液分离,得固体I;再将固体I和无水乙醚、氢化锂铝混合,搅拌,固液分离,得固体II;之后将固体II与无水乙醇和环己烷的混合溶液、有机碱及乙酰胺基丙二酸二乙酯混合,回流,固液分离,取液体,经蒸馏制得固体III;最后将固体III与无机酸溶液混合,回流,冷却,调pH,取沉淀;于甲酸水溶液中重结晶,同样这种方法对环境危害也较大。
Cheng等[11]研究了不同补料策略对色氨酸产量的影响,包括指数期补料、伪指数期补料、按照溶氧补料、按照发酵液中葡萄糖的量补料,实验中控制最大比生长速率控制在0.25 h-1以下,通过这些控制使得乙酸浓度为0.9 g/L,最终色氨酸产量为38.8 g/L,葡萄糖转化率为19.9%,这是相对很高的转化率。为了解决碳源流向、提高转化率问题,Lim等[12]通过UTR工程实现了精确调控葡萄糖转运到细胞内基因的表达水平,为以后探索发酵产物的最大产量和产率提供了一种简单方法的理论支撑。
由多次发酵试验取得的数据对比,可以得出结论,当发酵温度控制在37℃,溶氧条件控制在40%,pH稳定在6.8,补充碳源时,发酵罐内的残糖量控制在1%左右时开始补糖,此时发酵效果最好,产L-色氨酸的量最多,转化率最高,最稳定。需要注意的是,在整个发酵过程中,因为每次发酵用的菌株生长状况不同,可根据发酵罐内菌体生长状况适宜地调节溶氧条件,可有效提高产量。
[1] Zhang E,Dong S,Wang F,et al. Effects of L-tryptophan on the growth,intestinal enzyme activities and non-specific immune response of sea cucumber(Selenka)exposed to crowding stress[J]. Fish & Shellfish Immunology,2018,75:158-163.
[2] Jing K,Tang Y,Yao C,et al. Overproduction of L- tryptophan via simultaneous feed of glucose and anthranilic acid from recombinantW3110: Kinetic modeling and process scal-up[J]. Biotechnology & Bioengineering,2018,115(2):371-381.
[3] Ikeda M. Towards bacterial strains overproducing L-tryptophan and other aromatics by metabolic engineering[J]. Applied Microbiology and Biotechnology,2005,69(6):615-626.
[4] 崔芹,崔山. 色氨酸营养研究进展[J]. 中国饲料,2003(15):20-23.
[5] 宋波. 色氨酸的合成及其应用[J]. 广东化工,1989(4):11-17.
[6] 赵春光,程立坤,徐庆阳,等. 微生物法生产L-色氨酸的研究进展[J]. 发酵科技通讯,2008,37(4):34-36.
[7] 胡永红,王习霞,欧阳平凯. 色氨酸及其生产方法[J]. 化工时刊,1991(11):23-25.
[8] 刘红利,张征林,邹建忠,等. 用苯肼法合成DL-色氨酸[J]. 氨基酸和生物资源,2004,26(1):76-78.
[9] 许前会,韦萍. 芦竹碱法合成DL-色氨酸[J]. 应用化学, 2006,23(6):668-671.
[10] 盖利刚,姜海辉,陆希峰,等. 一种酪氨酸、色氨酸的化学制备方法:CN102531938B[P]. 2013-11-21.
[11] Cheng L K,Wang J,Xu Q Y,et al. Effect of feeding strategy on L-tryptophan production by recombinant[J]. Annals of Microbiology,2012,62(4):1625-1634.
[12] Lim J H, Jung G Y. A simple method to control glycolytic flux for the design of an optimal cell factory[J]. Biotechnology for Biofuels,2017,10(1):160-170.
责任编辑:张爱婷
Optimization of fermentation process for recombinant high yield strain of L-tryptophan
LÜ Lei1, SONG Guo-tian2, LIU Yong-fei2, LIU Yan-fei1, YANG Jian-de1,Corresponding Author, ZHANG Da-wei2,Corresponding Author
(1. College of Animal Science and Veterinary Medicine, Tianjin Agricultural University, Tianjin 300384, China; 2. Tianjin Institute of Industrial Biotechnology, Chinese Academy of Science, Tianjin 300380, China)
L-tryptophanine(L-Trp)is a kind of restricted amino acid, which is one of the essential amino acids for the growth and development of human body and animal. It is one of the key amino acids in the synthesis of many active substances and has been widely used in medicine. The production of L- tryptophan by microbial fermentation has attracted much attention in recent years, mainly because of its low price, high purity and easy separation. Therefore, the production of L-tryptophan by microorganism has a promising application prospect in large-scale industrial production. In this paper, the tryptophan high yield gene was recombined intoby genetic engineering. By controlling dissolved oxygen, pH value of carbon source and residual sugar content, the yield of L-tryptophan was effectively increased by direct fermentation. In this experiment, the original strain was used to explore the content of residual sugar in fermenting tank. It was found that when the residual sugar content was controlled at 1%, the growth of bacteria was the best and the growth cycle was the longest. When molasses were mixed with glucose as carbon source during fermentation, the results showed that the yield of L-tryptophan was the highest when the ratio was 3∶1; then when the pH was controlled during fermentation, the yield was increased to 18.9 g/L;the dissolved oxygen condition was controlled in the range of 35% and 40%. The results showed that the production of L-tryptophan reached 27 g/L at dissolved oxygen 40%; Finally, 60% glucose and 70% wheat sugar were replaced by carbon source. The results showed that the yield of L-tryptophan was higher when glucose was the sole carbon source.
L-tryptophan; fermentation; optimization; high yield strain
1008-5394(2018)03-0060-05
10.19640/j.cnki.jtau.2018.03.013
TQ922
A
2018-03-29
天津自然科学基金项目(16JCYBJC23500)
吕磊(1995-),男,本科在读,研究方向:微生物发酵。E-mail:824951764qq.com。
杨建德(1969-)男,教授,博士,研究方向:预防兽医学。E-mail:jiandeyang@126.com。
张大伟(1978-),男,研究员,博士,研究方向:微生物发酵。E-mail:zhang _dw@tib.cas.cn。
