支架植入颅内动脉瘤治疗效果的数值模拟研究*
2018-10-18金肜伯木合塔尔克力木申传鹏
金肜伯,木合塔尔·克力木,申传鹏
(新疆大学机械工程学院,乌鲁木齐 830046)
1 引 言
颅内动脉瘤指人体脑部血管的病理异常,是由于局部结构受到破坏或变薄向血管壁外侧发生的膨出,而造成的血管壁永久性的局限扩张,是一种常见的血管性疾病,是造成蛛网膜下腔出血的主要原因,具有较高的致残率与致死率[1]。近年来,颅内动脉瘤支架植入术迅速发展,已广泛应用于临床治疗[2]。支架植入病变部位后,在一定程度上改善动脉瘤的血流动力学特性,但也会产生血栓,导致血管出现再狭窄,主要原因是由于血管内植入支架后诱发的炎症及血管的平滑肌过度增生造成的,而支架植入对血管的损伤程度与支架的外观结构密切相关。研究支架与血流场的作用关系,根据血流特性的某些参数,设计出合理的支架结构,也可为动脉瘤的破裂提供预防机制。Radaelli等[3]通过基于特定患者医学影像建模,根据CFD技术来分析患者颅内动脉瘤模型的各个血流特征参数的变化。Sadatomo等[4]研究了62位患者的大脑中动脉分支的三维磁共振血管造影,对比解剖的颅内动脉瘤之间的差异,从而研究颅内动脉瘤的某些特性。Augsburger等[5]研究了分割颅内动脉瘤对动脉瘤的形态参数和血流动力学特性的影响。于红玉[6]等通过对血管造影图像进行DSA,获得相关轮廓线,通过分割图像,建立颅内3D动脉瘤模型,为血流动力学研究提供基础。邱晓宁[7]分别考察了同一结构、不同孔隙率和网丝截面的支架对颅内动脉瘤内各项血流动力学指标所产生的影响,并对数值模拟结果进行了实验验证。
本研究的主要内容是通过CT影像资料对个体化颅内动脉瘤模型进行三维重建,设计了三种通透率近似相等、结构形状不同的血管支架,运用数值模拟的方法,探讨不同类型的支架植入颅内动脉瘤前后对血流动力学特性的影响。
2 三维模型的建立
2.1 动脉瘤模型的构建
利用美国通用公司的GE64排螺旋CT扫描机获得原始的DICOM图像,将其导入医学影像处理软件Mimics 17.0中进行图像分割提取,对动脉瘤模型表面进行光顺处理,输出动脉瘤表面模型的STL格式文件。运用逆向工程软件Geomagic Studio 12.0将表面模型转化成体网格模型,修复质量较差网格,对表面网格作光滑处理,然后将STL格式血管壁模型转换成NURBS曲面模型,得到颅内动脉瘤实体模型,导出为STP格式[8]。见图1。
2.2 支架结构的设计
由于临床上实际使用支架的通透率约为60%~86%[9],较低的通透率可以在支架介入治疗时取得更好的疗效,本研究中所构建的单一裸支架的通透率为71%~72%。针对同一个体化颅内动脉瘤模型,使用UG NX 10.0设计了三种不同结构类型的支架,分别是螺旋型支架(Helical Stent)、网格型支架(Grid Stent)和周期型支架(Cycle Stent)。图2(a)为螺旋型支架,通透率为71%;图2(b)为网格型支架,通透率为71%;图2(c)为周期型支架,通透率为72%。三种类型的支架的网丝截面形状均为矩形截面,尺寸为0.12×0.1 mm。以螺旋型支架为例,它与颅内动脉瘤模型装配模型见图3。

图1 颅内动脉瘤模型



图2 支架形状

图3 支架与颅内动脉瘤的装配
3 有限元模型的建立
本研究采用双向流固耦合的方法进行数值模拟,需要对血液部分和血管部分分别划分网格。为了提高计算精度,对未植入支架的血液模型划分网格时需要划分膨胀层,而植入支架后的血液模型由于更加复杂,无法划分膨胀层,需要对支架附近的血液模型进行网格加密,对血管模型进行四面体网格划分。为表达方便,把未植入支架的模型、螺旋结构支架的模型、网格结构支架的模型和周期结构支架的模型分别简称为UM型、HM型、GM型和CM型。
4 边界条件与求解设置
4.1 血液部分的边界条件
相关文献资料表明,当血管直径大于0.5 mm时,用牛顿流体代替非牛顿流体所产生的误差不会超过2%[10]。本研究的个体化动脉瘤模型的入口直径为2.1 mm,出口处的最小直径为1.3 mm,平均直径为1.7 mm,均大于0.5 mm,因此在本研究中将血液视为牛顿流体以简化模型。设置血液的密度为1060 kg/m3,动力粘度为0.0035 Pa·s,血液入口速度设为均匀分布的值0.587 m/s,出口压力为0 Pa,即自由流出。基于进口处的速度和血管直径的雷诺数为373.3(小于2000),因此血液在载流动脉中的流动属于层流状态。
4.2 血管部分的边界条件
假定载瘤动脉壁和动脉瘤壁均为各向同性的线性材料,设置密度为1160 kg/m3,弹性模量为7.7×107Pa[11],泊松比为0.45。取载瘤动脉壁厚为0.2 mm,动脉瘤的壁厚为0.1 mm[12]。对支架、血管的两端面进行固定,即两端位移为0。
4.3 求解设置
流场计算时微分方程组离散格式采用二阶精度的迎风格式,最大均方根残差设定为10-4。选择血管内壁、支架与血液接触的面为流固耦合面。耦合计算时,先进行流体域的计算,所得的结果通过流固耦合面传递给固体域中进行迭代计算,流体和固体迭代的时间步长均为0.01 s,最大迭代次数设置为100。使用的处理器为Intel(R) Core(TM) i7-6500U 2.5 GHz CPU,内存为16 GB,每个模型经过30 min计算,得到符合残差标准的计算结果。
5 计算结果分析
5.1 流速分析
图4分别列出了四种模型的血流流线图。

图4四种模型的流线图
Fig4Streamlineoffourmodels
未植入支架前,血液从载瘤动脉左边入口处以较高速度流入血管后,在转弯处形成了二次流,接着一部分血液继续沿着载瘤动脉向右边出口流去,另一部分血液则先对动脉瘤下游瘤颈处造成冲击,后沿着动脉瘤内壁逆时针流入动脉瘤瘤腔内,颈口处高速流动的血液直到瘤顶处才有减弱的趋势,此时瘤腔内的血流漩涡最为明显。植入支架后,由于血液流动受到支架的阻力作用,血液只能以较低的速度流入动脉瘤瘤腔内,血流漩涡均有一定程度的削弱,减小了血液对瘤腔的冲击,降低了动脉瘤破裂的风险。其中螺旋结构支架模型(HM型)的瘤腔内的血流旋涡改善效果最佳。三种植入支架的动脉瘤模型在出口处的最大流速对比未植入支架模型均有不同程度的减小。出口处速度的最大值见表1。
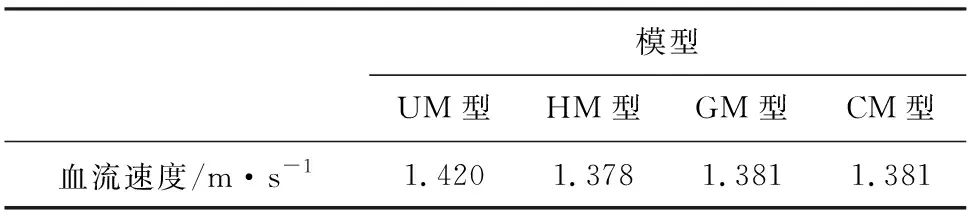
表1 血流速度最大值
5.2 壁面切应力分布
壁面切应力是血液在载瘤动脉和动脉瘤瘤腔内流动时对血管内壁和瘤腔内壁的摩擦力。相关文献资料表明,颅内动脉瘤的破裂与壁面切应力有紧密联系。图5分别列出了四种模型的壁面切应力分布图。未植入支架前,动脉瘤的壁面切应力分布极其不均匀,血管入口、出口和瘤颈处的壁面切应力较高,在瘤顶处也存在一个壁面切应力偏高的区域。支架植入后,支架覆盖区域的壁面切应力明显下降,动脉瘤区域的高壁面切应力均有不同程度的改善。其中螺旋结构支架的植入,最大程度地减小了瘤颈处的高壁面切应力区域。而三种模型在瘤顶处的壁面切应力均降低至2 Pa左右这样一个维持动脉血管组织结构的理想范围内[13-14],降低了由高壁面剪切力所引起的动脉瘤破裂的风险,与Liou[9]的研究结论一致。根据以上分析,可以推测支架植入术治疗颅内动脉瘤,可以达到预期结果,其中螺旋结构支架模型(HM型)的治疗效果最佳。
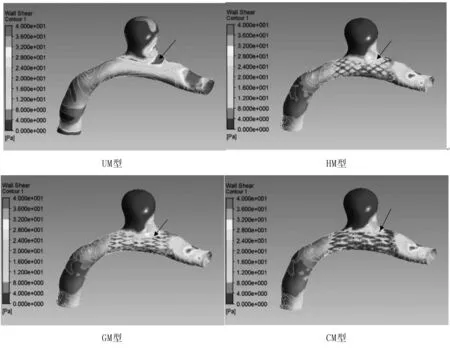
图5四种模型的壁面剪切力云图
Fig5Contoursofwallshearstressoffourmodels
5.3 支架柔顺性比较
支架的柔顺性是指支架被植入人体病变部位时,经过各种分叉、弯曲的血管的过程中,能够平顺通过时的韧性,即支架随血管形状变化的性能。本研究所构建的个体化动脉瘤模型的弯曲程度较大,故对支架的柔顺性进行分析是很有必要的。采用悬臂梁的弯曲理论对支架的弯曲能力进行研究,一端固定,另一端向下施加0.13 N的力[15]。支架材料设定为钛合金,具有较强的变形能力,密度为4050 kg/m3,弹性模量为10.8×1010Pa,泊松比为0.33。本次数值模拟分析在ANSYS Workbench 15.0静力学分析中进行。三种支架的弯曲变形云图见图6。
通过以上三种不同结构的支架的弯曲变化云图可以得出,三种支架的变形量排序为HM型≤GM型≤CM型,具体数值见表2。弯曲刚度的计算公式见式(1):
图6三种支架的变形图
Fig6Totaldeformationofthreemodels
(1)
其中:EI为弯曲刚度;F为在支架上施加力的大小;l为支架的长度;f为支架受力后的变形量。根据上面公式分别进行计算这三种支架的弯曲刚度,具体数值见表2。

表2 支架最大变形量
由于弯曲刚度反映的是支架抵抗外力而发生变形的能力,数值越大,代表抗弯曲能力越大,其柔顺性就越差。从表2的数据可以得出结论,CM型支架的柔顺性最好,GM型次之,HM型最差。
6 结论
本研究针对个体化颅内动脉瘤设计了三种不同结构形状的支架,分析了支架植入颅内动脉瘤后对各项血流动力学指标的影响,无论是从减小血液对动脉瘤瘤瘤壁的冲击还是降低动脉瘤瘤颈和瘤顶处的壁面切应力的角度看,螺旋型支架(HM型)的治疗效果都要优于其余两种结构的支架。但是螺旋型支架的柔顺性较差,不太适合植入几何形状复杂的血管。本研究也为优化支架结构提供了依据,将来可以制作颅内动脉瘤和支架的实体模型,进行体外实验,进一步研究支架植入对颅内动脉瘤血流动力学的影响。
