甘肃小陇山油松与柴胡栽培土壤细菌群落特征
2018-10-18胡艳波张弓乔王宏翔李录林惠刚盈
万 盼,胡艳波,张弓乔,王宏翔,李录林,王 鹏,惠刚盈,*
1 中国林业科学研究院林业研究所,国家林业局林木培育重点实验室, 北京 100091 2 甘肃省小陇山林业实验局林业科学研究所, 天水 741020
土壤微生物是土壤与植物的纽带,在土壤生态系统养分循环和能量流动过程中起重要作用。土壤中细菌群落在微生物中所占比例很高,是土壤物质循环的最主要参与者,其群落结构和多样性能够反映土壤环境质量的变化过程[1]。已有研究表明,土地利用方式的改变以及不同的管理措施,可以导致土壤微生物群落的改变,进而影响土壤性质和微环境[2- 3]。比如,Dong 等[4]表明,与传统耕作方式相比,连作可以改变土壤微生物群落结构;Zhang等[5]发现不同植物下的土壤微生物群落多样性均高于沙地土壤,说明土地利用方式可以改变土壤微生物群落结构;Annamaria等[6]研究表明,经营方式的不同也可以改变土壤细菌群落组成及其丰富度。
小陇山自然保护区是我国暖温带-亚热带过渡地带,由于自然因素和人为因素的影响,导致该地区生态系统的退化。近年来,退耕还林政策的实施,大面积人工林在当地推广,以期改善区域生态环境脆弱的现状。我国特有树种油松(PinustabulaeformisCarr.)是该区域退耕还林的主要树种,近年来在小陇山发展迅速[7- 8]。柴胡(Bupleurumchinense)属药用植物,在小陇山自然保护区,耕地被农民用来长期耕种柴胡,作为一种经济作物;而现在大面积的柴胡地普遍被改为培育油松苗。耕地变林地,土地利用方式的改变,相应的土壤微生物群落结构和多样性也将发生变化[9]。Fierer[10]对北美到南美土壤微生物群落空间变异进行研究,表明土壤细菌群落的多样性和物种丰富度随地上生态系统类型的变化而变化;Huang等[11]研究表明,黄土高原农耕地植被的恢复能够使得微生物群落结构改变,改善了土壤生态。当地有关油松苗的研究仅集中在育苗栽培与造林技术[12]、林分生长模型[13]和更新[14]等方面,因此,我们应及时深入探究耕地上栽植油松苗后土壤微生物群落的变化情况,进而了解土壤质量的变化情况,这对当地实现合理的植被管理和土地可持续利用具有重要意义。
新一代测序技术-高通量测序具有产生数据量大、测序周期短、准确率高以及成本低等优点,在微生物生态学的研究中凸显出明显的优越性[15- 18]。对此,本研究以小陇山典型的油松人工苗和柴胡作为对象,采用高通量测序方法,对常见的2种人工植被类型下土壤细菌群落结构和多样性进行了分析,以期为当地进行人工油松苗的种植、经营及土壤管理提供科学依据。
1 研究区域概况
小陇山林区位于甘肃省东南部,地处秦岭西段,属暖温带向北亚热带过渡地带,兼有我国南北气候特点,大多数地域属暖温湿润-中温半湿润大陆性季风气候[19]。年平均气温,极端最高气温39.2℃,极端最低气温-23.2℃,年降水600—900 mm,主要集中于7、8、9月,年蒸发989—1658 mm,相对湿度68%—78%,年日照时1520—2313 h,无霜期130—220 d,区内秦岭以北的地带性土壤为灰褐土,以南为黄褐土,土壤垂直分布较明显[20]。
2 研究方法
2.1 样地设置与样品采集
土壤采集于2017年5月进行;选择具有代表性的油松人工苗地和柴胡种植地各3块面积为20 m×20 m的样地,且各样地之间环境条件相似、相距较近;样地海拔基本相等(约为1365—1379 m),每个植被类型3个样地分布在不同坡位,分别在上、中和下,坡度大约为12°—4°,坡向为西南。柴胡作为一种药用植物,在当地被作为经济作物长期种植;油松是移栽至种植柴胡的耕地上,生长期为4 a,其地径、苗高和冠幅分别约为4.12、152.50、109.10 cm。柴胡和油松苗的管理方式相似:柴胡于每年6月人工施肥一次,7—8月人工除草一次;油松苗移栽至耕地,于每年开春、土壤解冻后施肥一次,分别在6、8月和10月进行3次人工除草。
在每个样地采用五点法取样,先除去表层凋落物,采集表层(0—30 cm)土壤,多点均匀混合,混合土样时剔除杂质,取一部分土壤样品放入消毒无菌的自封袋,放在4℃冷藏箱保存并尽快带回实验室,放在-80℃冰箱中保存,用于土壤微生物多样性分析;另外,再取一部分土壤样品装入自封袋,带回实验室自然风干后过筛用于土壤理化性质分析。
2.2 土壤理化性质测定
有机质含量采用重铬酸钾氧化-外加热法;全氮含量采用凯氏定氮法测定;全磷含量采用酸熔-钼锑抗比色法测定;全钾采用NaOH熔融、火焰光度法测定;碱解氮含量采用碱解扩散法测定;有效磷含量采用盐酸-氟化铵提取-钼锑抗比色法测定;速效钾含量采用乙酸铵浸提-火焰光度法测定。以上测定方法参见《土壤农业化学分析方法》[21]。
2.3 土壤DNA 抽提和PCR扩增
根据MP-FastDNATMSpin kit for soil试剂盒 (Omega Bio-tek, Norcross, GA, U.S.)说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;用515F (5′-GTGCCAGCMGCCGCGG- 3′)和907R (5′-CCGTCAATTCMTTTRAGTTT- 3′) 引物对V3-V5可变区进行PCR扩增,扩增程序为:95℃ 预变性3 min,27个循环(95℃ 变性30 s,55℃ 退火30 s, 72℃ 延伸45 s),最后72℃延伸 10 min (PCR仪:ABI GeneAmp® 9700型)。扩增体系为20 μL,4 μL 5*FastPfu 缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL 引物(5μmol/L), 0.4 μL FastPfu 聚合酶;10 ng DNA模板。
2.4 Illumina Miseq 测序
使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA) 进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST (Promega, USA) 进行检测定量。根据Illumina MiSeq 平台 (Illumina, San Diego,USA)标准操作规程将纯化后的扩增片段构建PE250的文库。
构建文库步骤: (1)连接“Y”字形接头; (2)使用磁珠筛选去除接头自连片段; (3)利用PCR扩增进行文库模板的富集; (4)氢氧化钠变性, 产生单链DNA片段。利用Illumina公司的Miseq PE250平台进行测序(上海美吉生物医药科技有限公司)。
2.5 数据处理
原始测序序列使用Trimmomatic 软件质控,使用FLASH软件进行拼接:
(1)设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,去除质控后长度低于50 bp的序列;
(2)barcode需精确匹配,引物允许2个碱基的错配,去除模糊碱基;
(3)根据重叠碱基overlap将两端序列进行拼接,overlap需大于10 bp。去除无法拼接的序列。
使用UCHIME软件剔除嵌合体,得到优化序列;根据97%的相似度对序列进行OTU聚类。利用mothur软件对所有序列进行随机抽样,以抽取到的序列数与它们所能代表OTU的数目构建稀疏曲线(Rarefaction curve);基于OTU进行稀释性曲线分析,并计算Chao1丰度指数,覆盖度(Coverage)和Shannon多样性指数,Shannoneven均匀度指数;比对Silva数据库(SSU123)(设置比对阈值为70%),利用RDP-classifier (http://rdp.cme.msu.edu/) 对每条序列进行物种分类注释,并在各个分类水平上统计每个样品的群落组成;利用冗余分析研究土壤化学指标与细菌群落关系。
3 结果与分析
3.1 土壤化学性质
可知,油松苗地的土壤有机质、全磷、有效磷含量和pH值均低于柴胡地;其中,两者之间的有机质和全磷含量差异均达到显著水平(P<0.05);然而, 油松地土壤的全氮、碱解氮、全钾和有效钾含量均大于柴胡地土壤,但之间差异均未达到显著水平(P>0.05)(表1)。

表1 2种植被下土壤化学性质
不同小写字母表示在0.05水平下具有差异
3.2 细菌高通量测序数据特性
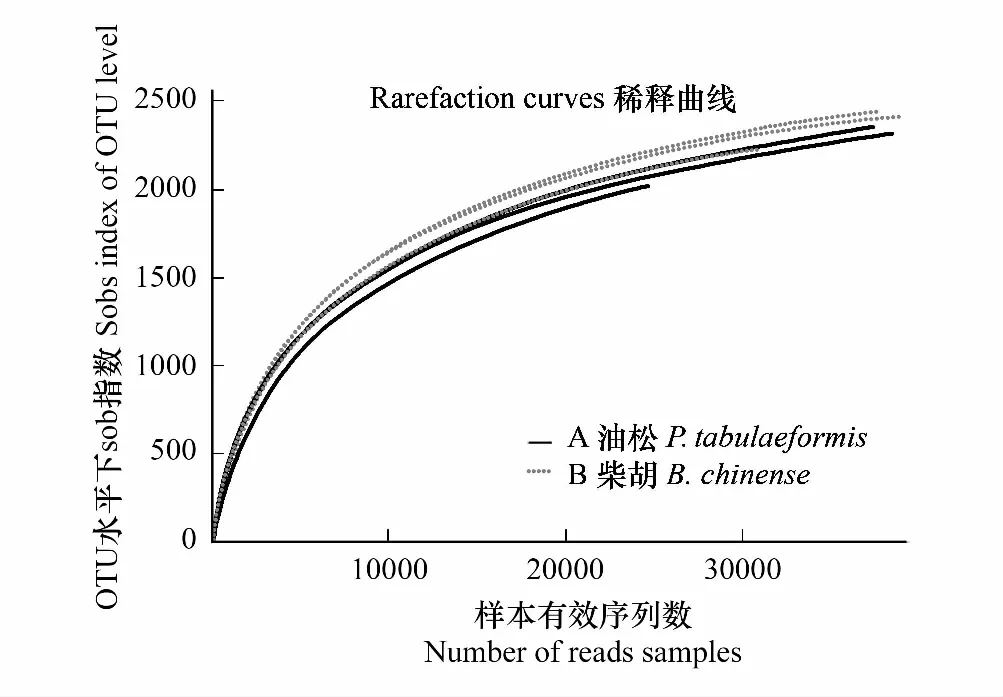
图1 不同土壤样品细菌稀释曲线Fig.1 Rarefaction curves of soil bacteria in different sampled
稀释曲线(Rarefaction curve)是用来描述随着样品量的加大,可能检测到的物种种类随之增加的状况,是调查样品的物种组成和预测样品中物种丰度的有效工具,在生物多样性调查中,被广泛用于判断样品量是否充分以及估计物种丰度。可以看出,土壤的6个样品对应的稀释曲线均基本趋于平缓,说明取样比较合理,实际环境中细菌群落结构的置信度较高,能够比较真实的反映出样品的细菌群落(图1)。
3.3 土壤细菌群落Alpha多样性
各处理组的细菌的Coverage指数都大于90%,说明在OTU水平上的测序结构能够反映所测样本中细菌的真实情况。OTUs表示丰土壤微生物丰富度实际观测值,可以看出,油松土壤细菌的OTUs小于B,但差异均不显著(P>0.05)。油松土壤细菌的Chao1指数小于柴胡,但差异也均不显著(P>0.05);油松土壤细菌的Shannon指数小于柴胡,但差异也不明显(P>0.05)。油松土壤细菌的Shannoneven指数小于柴胡,差异均达到显著水平(P<0.001)(表2)。

表2 2种植被下土壤细菌多样性指数
3.4 群落组成分析
两种植被下土壤共检测出37个细菌门和84个细菌纲;其中,34个门为共有细菌门,占91.9%;79个纲为共有细菌纲,占94.0%(图2)。对每个有效序列进行门(Phylum)水平上的注释分类,两种植被的土壤检测出10个以上细菌门(相对丰度大于1%)主要有:变形菌门(Proteobacteria),酸杆菌门(Acidobacteria),绿弯菌门(Chloroflexi),浮霉菌门(Planctomycetes),放线菌门(Actinobacteria),芽单胞菌门(Gemmatimonadetes),拟杆菌门(Bacteroidetes),硝化螺旋菌门(Nitrospirae)(图3)。这些鉴定出来的细菌门,按照丰富度由高到低排列均为(优势菌在两个植被土壤中丰富度高低顺序一致):变形菌门(Proteobacteria)>酸杆菌门(Acidobacteria)>绿弯菌门(Chloroflexi)>浮霉菌门(Planctomycetes)>放线菌门(Actinobacteria)>芽单胞菌门(Gemmatimonadetes)>拟杆菌门(Bacteroidetes)>硝化螺旋菌门(Nitrospirae)。通过物种差异分析得出,油松地土壤中的变形菌门(Proteobacteria)丰度显著低于柴胡土壤(P<0.05),绿弯菌门(Chloroflexi)的丰度却显著高于柴胡土壤(P<0.05);而其他细菌门在两者之间差异不明显,未达到显著水平(P>0.05)(图3)。

图2 门和纲水平下的细菌物种Venn图Fig.2 The Venn map of bacterial community at phylum level (Ⅰ) and class leve (Ⅱ)图注:(门水平下)Proteobacteria 变形菌门,Acidobacteria 酸杆菌门,Chloroflexi绿弯菌门,Planctomycetes浮霉菌门,Actinobacteria 放线菌门,Gemmatimonadetes 芽单胞菌门,Bacteroidetes拟杆菌门,Nitrospirae 硝化螺旋菌门;(纲水平下)Acidobacteria酸杆菌纲,Betaproteobacteria β-变形菌纲,Actinobacteria放线菌纲,Alphaprotebacteria α-变形菌纲,Gemmatimonadetes芽单胞菌纲,Dellaproteobacteria Δ-变形菌纲,Planctomycetocia浮霉菌纲, Anaerolinease厌氧绳菌纲

图3 门和纲水平下的细菌群落组成Fig.3 Composition of bacterial community at phylum level and class leve
在纲分类水平上,两个植被的土壤优势菌为:酸杆菌纲(Acidobacteria),β-变形菌纲(β-proteobateria),放线菌纲(Actinobacteria),α-变形菌纲(α-proteobacteria), 芽单胞菌纲(Gemmatimonadetes),Δ-变形菌纲(Δ- proteobateria),浮霉菌纲(Planctomycetocia), 厌氧绳菌纲(Anaerolineae)。纲水平上的优势菌丰富度高低顺序在两个植被土壤不太一致,但均是酸杆菌纲(Acidobacteria)丰富度最高,而β-变形菌纲(β-proteobateria)丰富度次之。同样,通过物种差异分析得出,各优势菌的丰度在两个植被土壤之间差异不显著(P>0.05)(图3)。
3.5 环境因子对细菌群落的影响
相关性分析表明,变形菌门(Proteobacteria)相对丰富度与碱解氮呈显著负相关(P<0.05),酸杆菌门(Acidobacteria)相对丰富度与全氮呈显著负相关(P<0.05),放线菌门(Actinobacteria)相对丰富度与全氮和碱解氮均呈显著负相关(P<0.05),芽单胞菌门(Gemmatimonadetes)相对丰富度与碱解氮呈显著负相关(P<0.05),拟杆菌门(Bacteroidetes)相对丰富度与有效磷呈显著正相关(P<0.05)(表3)。
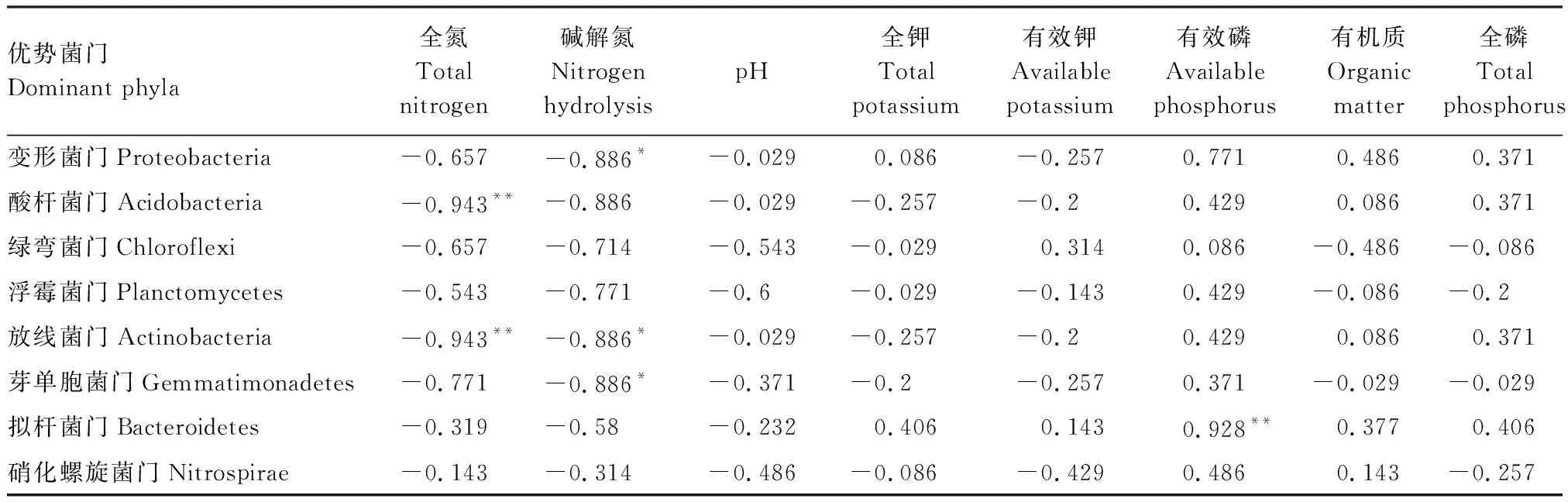
表3 土壤细菌优势菌(门水平下)相对丰富度与土壤化学性质的相关性
**P<0.01 ,*P<0.05
可知,有机质,全氮,全钾,碱解氮和全磷含量均对土壤细菌具有显著影响;其中,碱解氮和全氮因子对细菌的影响最大。RAD分析显示,第一排序轴解释了样本中94.72%的变异,第二排序轴解释了样本中3.00%的变异,两者结合解释率达97.72%(图4)。

图4 土壤细菌与土壤化学因子的冗余分析 Fig.4 Representative difference analysis (RDA) of the relationships between soil physiochemical properties and bacterial communites under two vegetations
4 讨论
通过高通量测序技术分析2种人工植被类型下土壤细菌群落结构及其多样性。由稀释曲线可知,本研究采集的土壤样品合理,其鉴定结果能够准确的反映实际土壤样品中细菌群落;同样,对土壤样品中细菌测序得到的文库覆盖率(Coverage)均达到95%以上,表明样品适合分析细菌多样性。虽然本次调查采集的植被土壤面积有限,但样品采集仍具有一定代表性,能够反映该研究区域2种植被类型的土壤细菌群落结构。
4.1 2种植被类型下土壤微生物群落组成
通过新一代高通量测序技术分析土壤微生物群落结构,具有快速获取大量信息的优势,并且将这些信息按照需要进行相关解析。本研究在2个植被土壤样品中,细菌鉴定出变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)等37个门,其中,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)均是2种植被土壤中丰富度极高的细菌群类,变形菌门为丰富度最高优势菌门,而该区域土壤呈碱性,这也就证实了变形菌门(Proteobacteria)为碱性土壤中的主要优势群落,这与很多[22- 24]研究结果相似;也有一些研究得出的结论与之不同[25],可能是由于土壤间的异质性造成的。同样,两种植被的土壤共检测到84个细菌纲;其中,丰富度较高的优势菌主要为酸杆菌纲(Acidobacteria)和β-变形菌纲(β-proteobateria),这与刘洋等[26]研究结果相似,即这两种优势菌均普遍存在土壤中且丰富度最高。这些研究结果也说明了,尽管植被类型不同,但处于相同生境中的土壤微生物类群具有相似性。
变形菌门(Proteobacteria)是一大类细菌门类,在很多土壤细菌群落研究中具有很高的相对丰度[27- 28],其包含有能与植物共生的固氮细菌,可以增强土壤的固氮能力,属于异养型细菌。有研究表明,土壤变形菌门丰富度的高低可以在一定程度上反映土壤有机质等养分含量的高低。绿弯菌门(Chloroflexi)是一类通过光合作用,以CO2为碳源产生能量的细菌,因此在有机质含量低的土壤中具有竞争力[29]。对比油松地和柴胡地土壤微生物群落发现,油松地土壤中变形菌门(Proteobacteria)的丰度显著低于柴胡地土壤,绿弯菌门(Chloroflexi)的丰度显著高于柴胡地土壤,但酸杆菌门(Acidobacteria)的丰度在两者间却无明显差异。植物生长过程中产生的有机物质(包括植物根系分泌物)进入土壤,直接影响土壤微生物的群落组成;由于不同植被生理特性存在差异,产生的有机物质种类和数量不同,导致不同植被下土壤微生物物种出现差异[30]。与柴胡相比,油松苗虽然会产生较多的枯落物输入土壤,但其属于深根树种,根系发达且穿透能力强,对土壤理化性质影响比较大,能汲取大量的养分物质,导致土壤有机质含量较柴胡地低;变形菌门(Proteobacteria)在有机质含量较高的柴胡地更适合生存,但绿弯菌门(Chloroflexi)更适合在有机质含量较低的油松林地生存。这可能是优势细菌门中的变形菌门和绿弯菌门在两者之间的存在显著差异的原因。
酸杆菌纲(Acidobacteria)属于酸杆菌门类,是一种研究相对较少的细菌门类,但普遍以较高丰富度存在土壤中[24];有研究表明[31],酸杆菌门(Acidobacteria)多出现在陆地且酸性较强的环境中,而柴胡和油松的土壤均发现该细菌的存在,说明土壤环境有可能存在酸化的倾向。变形菌门主要包括α-变形菌纲和β-变形菌纲,其包含很多能够与植物共生的固氮细菌,可为土壤提供更强的固氮能力。β-变形菌纲能够利用土壤中有机物质分解产生的氨气和甲烷[24];一般变形菌门中,α-变形菌纲丰富度高于β-变形菌纲[26];也有一些研究表明,β-变形菌纲(β-proteobacteria)的丰富度却大于α-变形菌纲(α-proteobacteria)[32-33],这与本研究结果一致。然而,在纲分类水平下的优势菌的丰度在两种植被土壤中均无明显差异。
4.2 2种植被类型下土壤微生物多样性
采集的土壤中共检测到的细菌有37个门,84个纲,168个目,296个科和485个属,将序列相似性>97%的序列归为同一OTUS,两种植被的OTUS分别为2218(油松)和2354(柴胡)。微生物群落多样性是描述土壤生态特征的关键指标,可以通过一系列多样性指数来反映,最常用的指标有Chao1指数、Shannon指数和Shannoneven指数。Chao1指数是用来估计土壤样本中物种总数,值越大表示样品中微生物丰富度越高;Shannon指数反映土壤微生物多样性,值越高,群落多样性越高;Shannoneven指数表示土壤微生物物种分配的均匀度程度,值越大则说明物种分配均匀程度越高。微生物群落结构和组成多样性增大有助于增加土壤生态环境的稳定性[34]。细菌广泛存在土壤中,也是土壤中个体数量最多的有机体,存在土壤中或者与植物根系共生,能够参与土壤生态系统的物质转化和循环,利于植物生长发育。本研究发现,2两种植被类型的土壤细菌的Chao1指数和Shannon指数差异均不显著,只是细菌的Shannoneven指数表现为油松地土壤小于柴胡地土壤。这说明,土壤细菌群落的丰富度和多样性在2种植被下无明显差异,但油松地土壤细菌群落的物种分配较柴胡地集中。不同植被对土壤营养物质的代谢及呼吸等生命活动会影响环境因子,进而造成微生物群落多样性发生变化[35]。油松较柴胡根系庞大且较深,对土壤的物理性质(结构、孔隙度等)或者养分影响较大,进而使得细菌群落物种分配不均匀。
土壤微生物多样性可以反映土壤肥力高低。有研究表明,细菌多样性高,土壤表现出较高的肥力,而真菌多样性高,则表现出较低的土壤肥力[36]。从土壤细菌多样性的研究结果来看,两种植被下土壤细菌多样性无明显区别,根据前人研究结果,可以初步认定两种植被土壤肥力无差异;然而,本研究同时表明,油松苗地土壤有机质含量和全磷含量却明显低于柴胡地土壤,这可能跟两种土壤真菌群落多样性差异有关,这需进一步分析两种植被土壤真菌群落多样性来证实。
4.3 土壤养分对细菌群落结构的影响
研究表明,土壤养分含量能够影响土壤微生物种群数量及分布,而不同植被的营养物质代谢等生命活动不同,导致土壤养分具有差异[37]。在细菌群落的优势门中,变形菌门(Proteobacteria)与碱解氮显著负相关,酸杆菌门(Acidobacteria)与全氮显著负相关;通过RAD综合分析得出,有机质、全氮、全钾、碱解氮和全磷均对土壤细菌群落结构具有显著影响,其中,群落受碱解氮和全氮影响较大,且环境因子对细菌的解释率为97.72%。本研究也表明,油松地土壤的有机质含量和有效磷含量均显著低于柴胡地,其他养分含量无显著差异,这就说明了2种植被下土壤由于碱解氮和全氮含量无明显差异,因而未导致细菌群落多样性出现差异。然而,长期种植油松苗将会导致土壤养分处在较低水平,因此在大苗培育期要因土施肥,提高土壤肥力,尤其需要及时补充土壤有机质,这样既可以增加土壤养分又可提高细菌丰度和多样性。
5 结论
综上可知,通过高通量测序技术分析2种不同土地利用方式下山麓耕地土壤细菌群落结构及其多样性,得出以下结论:(1)油松地和柴胡地的土壤细菌丰度和多样性无明显差异,但油松地土壤细菌群落的物种分配较柴胡地集中。(2)两种植被土壤的优势细菌门均为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi);主要的优势菌纲为酸杆菌纲(Acidobacteria),β-变形菌纲(β-proteobacteria),放线菌纲(Actinobacteria);且仅有优势细菌门中的变形菌门和绿弯菌门在两者之间的差异显著,即油松地土壤中的变形菌门(Proteobacteria)的丰富度显著低于柴胡地土壤,绿弯菌门(Chloroflexi)丰富度却显著高于柴胡地。(3)变形菌门(Proteobacteria)与土壤的碱解氮含量呈显著负相关,酸杆菌门(Acidobacteria)与全氮显著负相关;总体来看,碱解氮和全氮对土壤细菌群落影响较大,被环境因子解释率均达到97%以上,是影响细菌群落的最主要的土壤因子。长期种植油松苗将会导致土壤养分处在较低水平,因此,在大苗培育期中要因土施肥,提高土壤肥力,尤其需要及时补充土壤有机质,这样既可以增加土壤养分又可提高细菌丰度和多样性。本研究结果可为认识小陇山不同植被土壤微生物群落组成及多样性提供理论,同时,也为当地进行人工油松苗的种植、经营及土壤管理提供科学参考。
