不同生境黑果枸杞根际与非根际土壤微生物群落多样性
2018-10-18何学敏杨晓东张雪妮吕光辉
李 岩,何学敏, 杨晓东,张雪妮,吕光辉, *
1 新疆大学干旱生态环境研究所,乌鲁木齐 830046 2 新疆大学绿洲生态教育部重点实验室,乌鲁木齐 830046 3 新疆大学资源与环境科学学院,乌鲁木齐 830046
根际土壤是直接受植物根系和分泌物影响的土壤区域,是土壤微生物与植物相互作用的重要场所。根际土壤微生物与根系之间存在适应性协同进化关系[1],并形成植物-微生物之间的互惠关系[2]。植物通过根系活动改变根际土壤的养分含量及其他土壤理化性质,改变根际微生物群落的组成,使得根际与非根际土微生物群落组成和多样性上具有明显的差异[3]。根际微生物对植物生长具有重要的作用,促植物生长细菌(PGPR)通过自身代谢活动将土壤营养物质分解、转化为植物可吸收利用的形态,促进植物生长,部分细菌分泌的激素等物质可提高植物的适应性,如干旱、盐碱等胁迫条件[4-5]。
根际土壤微生物的群落结构受植物影响,如植物种类[6]、生长阶段[7]、健康状况[8],另外,土壤理化性质对微生物群落也具有重要的影响,如土壤营养状况[9]、水分和pH[10-11]、温度[12]。土壤盐渍化作为一种重要的环境胁迫因子,不仅影响植物的生长、植被群落结构,而且对土壤微生物群落多样性和组成具有重要的影响[13-14]。我国西北干旱区,特别是新疆地区,拥有大面积的盐渍化土壤,含盐量高,不利于作物耕种,却孕育了许多盐生植物,如盐角草(Salicorniaeuropaea)、盐穗木 (Halostachyscaspica)、盐节木 (Halocnemumstrobilaceum)、碱蓬 (Suaedaglauca)、盐爪爪 (Kalidiumfoliatum)等。深入开展盐生植物根际土壤微生物群落结构对于揭示植物对盐碱环境的适应机理具有重要意义[15]。然而,目前对盐生植物根际土壤微生物的群落结构的了解还比较少[16]。
黑果枸杞(Lyciumruthenicum)是一种分布于我国西北干旱区的耐盐植物。国内学者主要从生理生态方面对它们的耐盐碱机理开展过研究[17-18],但是根际土壤微生物对黑果枸杞耐盐碱性的作用尚未揭示。研究表明,植物根际微生物群落的组成和丰富度在不同生境间具有差异[19-20],黑果枸杞作为一种耐盐植物,可生长于多种生境中,如盐化沙地、干河床、荒漠河岸林中、河湖沿岸,然而,黑果枸杞根际微生物群落多样性和组成在盐碱化生境与非盐碱化生境之间的差异性还不清楚。本研究在前期对艾比湖地区黑果枸杞根际土壤细菌群落结构分析的基础上,进一步分析不同地区(盐化与非盐化生境)中黑果枸杞根际土壤细菌和真菌的群落组成,揭示根际微生物群落与非根际微生物群落组成之间,以及不同生境间微生物群落结构的差异,为研究根际土壤微生物与黑果枸杞耐盐性之间的关系提供基础。
1 材料与方法
1.1 材料
土壤样品于2016年5月11—13日取自精河县艾比湖湿地国家级自然保护区、乌苏市、五家渠市,生境分别为盐碱地、路旁荒地、人工林带旁。分别在每个黑果枸杞居群中选择生长状况相近的健康个体,每个地点采集3—4个重复,每个重复之间距离大约20—50 m。将植株根系挖出,抖去根部附着比较疏松的土壤,留下与根系结合比较紧密的土壤(厚度约1 mm),装入50 mL无菌离心管中。采集距离根系30—40、0—30 cm深度土层的土壤,装于无菌袋中,作为非根际土壤。土壤采集完后立即在冷藏条件下(冰上)带回实验室。向盛有根系的离心管中加入适量(30 mL左右)无菌PBS溶液(137 mmol/L NaCl, 2.7 mmol/L KCl, 8.5 mmol/L Na2HPO4, 1.5 mmol/L KH2PO4, pH 7.3), 漩涡震荡10 min,弃去根系,土壤溶液即为根际土壤溶液,暂存于4℃,备土壤微生物基因组DNA提取。
1.2 方法
1.2.1 土壤理化性质分析
土壤pH值采用pH计测定; 土壤有机碳(TOC)采用重铬酸钾容重法进行测定;全氮(TON)采用重铬酸钾-硫酸消化法进行测定;电导率(EC)采用电导率仪测定, 由于EC与土壤含盐量具有正相关关系,因此以EC近似表示含盐量。
1.2.2 土壤微生物基因组DNA的提取
基因组DNA提取方法参考Edwards[2]。吸取1 mL根际土壤溶液至2 mL无菌离心管中,于4℃、10000 g离心30 s,弃上清,所得沉淀用于根际土壤微生物基因组DNA提取;对非根际土,用无菌药匙取大约0.2 g土壤(湿重),加入2 mL无菌离心管中,用于提取基因组DNA。利用OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit试剂盒(OMEGA)提取基因组DNA,利用1%琼脂糖凝胶检测DNA的长度和完整性,利用NanoDrop检测DNA的浓度和纯度。
1.2.3 DNA扩增及测序
采用两轮法对细菌16S rDNA V3—V4区进行扩增, 第一轮扩增利用融合了barcode序列的通用引物进行,上游引物341F:ccctacacgacgctcttccgatctg (barcode) cctacgggnggcwgcag,下游引物805R: gactggagttccttggcaccc gagaattccagactachvgggtatctaatcc;真菌18S rDNA扩增,第一轮扩增利用融合了barcode序列的通用引物进行,上下游引物序列:NS1:cctacacgacgctcttccgatctn (barcode) gtagtcatatgcttgtctc,Fung:gactggagttccttggcacccgag aattccaattccccgttacccgtt g。反应体系30 μL,包含15 μL 2×Taq master Mix(Thermo),引物(10 μmol/L)各1 μL,模板DNA 20 ng。扩增条件:94℃ 3 min,94℃ 30 s,45℃ 20 s,65℃ 30 s,扩增5个循环;94℃ 20 s,55℃ 20 s,72℃ 30 s,扩增20循环,72℃延伸5 min。第二轮扩增使用Illumina桥式PCR兼容引物,以第一轮的PCR产物为模板。反应体系同上。扩增条件:95℃ 30 s,95℃ 15 s,55℃ 15 s,72℃ 30 s,扩增5个循环,72℃延伸5 min。PCR产物经磁珠法回收并定量。将每个重复个体的PCR产物等量混合,每份混合样品包含相应的全部重复个体,将6份混合样品送至生工(上海)生物工程有限公司,利用Illumina-MiSeq平台进行高通量测序。
1.2.4 数据分析
测序原始数据去除引物接头序列、去除各低质量碱基(Phred Quality Score=20)后进行拼接,舍弃长度短于200 bp的序列,去除非特异性扩增序列及嵌合体后,得到每个样本的有效序列数据。以97%为划定阈值,对16S和18S序列划分操作分类单元(operational taxonomic unit,OTU)。采用RDP classifier 2.12对97%相似度水平的OTU代表序列进行分类学分析,得到每个OTU对应的物种分类信息,并在界、门、纲、目、科、属水平上统计各个样品的细菌群落组成。基于物种分类分析,绘制物种分类条形图和物种丰度热图。16S和18S序列经重取样(resampling)统一测序深度(16S为60000条,18S为27000条)后,计算alpha多样性指数(Chao1、Shannon、Simpson指数以及覆盖度)。以OTUs丰富度对序列数作图,进行稀释分析并制作稀释曲线图(Rarefaction curve)。根据样本OTUs组成之间的weighted unifrac距离矩阵进行主坐标分析(PCoA)分析微生物群落之间的相似性;用配对t检验比较根际和非根际、细菌和真菌群落多样性的差异性;利用CCA分析检测细菌、真菌群落组成与土壤理化因子的关系。OTU划分、alpha多样性指数计算以及稀释分析用Mothur软件完成;配对t检验及作图用Graphpad 6完成;PCoA和CCA分析采用R的vegan软件包进行。
2 结果与分析
2.1 土壤理化性质
根际土壤有机碳(TOC)、总氮(TON)含量高于非根际土,电导率(EC)和pH低于非根际土;非根际土壤的TOC、TON含量和pH在3个地区间无显著差异(P>0.05), EC显著高于乌苏地区(WS)和五家渠地区(WQ)(P<0.01)(表1), 表明艾比湖地区(EB)土壤为盐渍化土壤,其含盐量显著高于非盐渍化的WQ和WS地区。

表1 根际土壤与非根际土壤的理化性质
不同小写字母表示不同地区间差异显著性(P<0.01);*:每个重复个体的根际土样质量很低,无法满足测试需求,因此我们将每个地区的所有重复个体的根际土混合后测定,故每个参数只有1个数值,没有误差,也无法检验根际土壤之间理化性质的差异显著性
2.2 微生物多样性及群落结构
2.2.1 测序数据预处理结果
土壤样品序列的稀释曲线逐渐趋于平缓(图1),同时测序覆盖度0.91—0.99之间(表2),说明测序数据量合理,基本能真实反应土壤微生物的群落组成。
2.2.2 微生物群落多样性
配对t检验表明,根际土壤细菌群落的多样性和丰富度高于非根际土壤(P>0.05), 然而WQ非根际细菌的多样性和丰富度高于根际土(表2);根际真菌多样性低于非根际土壤(P<0.05)(图2),而丰富度无显著差异(图2)。细菌群落的丰富度和多样性指数显著高于真菌(P<0.05, 图2)。不同地区间,细菌和真菌群落的多样性和丰富度具有差异,WQ非根际土壤细菌和真菌多样性均高于EB和WS;根际细菌多样性排序为EB>WS>WQ,根际真菌多样性排序为WS>EB>WQ(表2)。

图1 基于OTU丰度的土壤样品微生物群落的稀释曲线Fig.1 Rarefaction curves of soil microbial communities based on OTU richnessEB_R:艾比湖地区黑果枸杞根际土壤,Rhizosphere soils of Lycium ruthenicum in Ebinur Lake wetland;EB_B:艾比湖地区非根际土壤,Bulk soils in Ebinur Lake wetland;WS_R:乌苏地区黑果枸杞根际土壤,Rhizosphere soils of Lycium ruthenicum in Wusu;WS_B:艾比湖地区非根际土壤,Bulk soils in Wusu;WQ_R:五家渠地区黑果枸杞根际土壤,Rhizosphere soils of Lycium ruthenicum in Wujiaqu;WQ_B:五家渠地区非根际土壤,Bulk soils in Wujiaqu
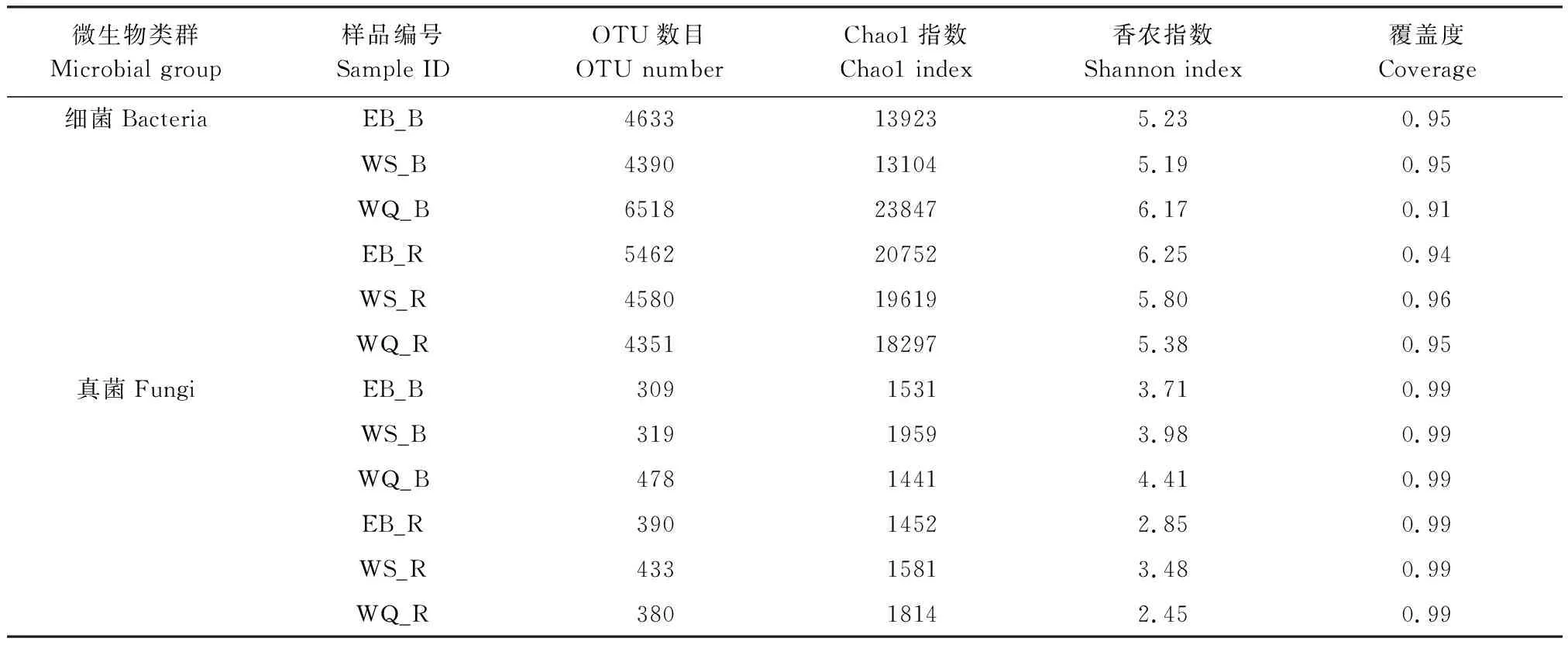
微生物类群Microbial group样品编号Sample IDOTU数目OTU numberChao1指数Chao1 index香农指数Shannon index覆盖度Coverage细菌BacteriaEB_B4633139235.23 0.95WS_B4390131045.190.95WQ_B6518238476.170.91EB_R5462207526.25 0.94WS_R4580196195.80 0.96WQ_R4351182975.38 0.95真菌FungiEB_B30915313.71 0.99WS_B31919593.98 0.99WQ_B47814414.410.99EB_R39014522.85 0.99WS_R43315813.480.99WQ_R38018142.45 0.99

图2 根际和非根际土壤细菌和真菌群落的多样性和丰富度比较Fig.2 Comparison of the diversity and richness of bacterial and fungal communities in rhizosphere and bulk soils差异显著性:ns:P>0.05;*:P<0.05;**:P<0.01;***:P<0.001
2.2.3 土壤微生物群落组成
非根际细菌群落中,优势类群依次是变形菌门(Proteobacteria)(42.34%—45.58%)、厚壁菌门(Firmicutes)(23.12%—33.06%)、放线菌门(Actinobacteria)(9.67%—17.15%)、酸杆菌门(Acidobacteria)(2.41%—5.95%);根际土壤细菌群落中,优势类群依次是变形菌门(55.9%—65.13%)、拟杆菌门(Bacteroidetes)(12.04%—15.37%)、放线菌门(6.38%—8.64%)、酸杆菌门(6.22%—7.89%)(图3)。真菌群落中,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)丰度最高,其中子囊菌门在非根际土中的丰度为50.86%—67.37%, 根际土中的丰度为17.92%—75.12%;担子菌门在非根际土中的丰度为21.27%—24.98%, 根际土中的丰度为3.89%—60.48%(图3)。
属水平上,微小杆菌属(Exiguobacterium)、柠檬酸杆菌属(Citrobacter)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)是非根际细菌群落的优势属(丰度>1%) (图4),微小杆菌属丰度最高(19.8%—28.86%)。曲霉属(Aspergillus)、Penidiella、Craterocolla、Phaeosphaeria、青霉属(Penicillium)、Meyerozyma、裂殖酵母属(Schizosaccharomyces)、犁头霉属(Absidia)、Hygrocybe、毛壳菌属(Chaetomium)是非根际真菌群落的优势属(丰度>1%)(图4)。Haliea、Gp10、Pelagibius、Microbulbifer、假单胞菌属、Thioprofundum、Deferrisoma是3个地区黑果枸杞根际土壤细菌群落的优势属 (图4),其中Haliea的丰度最高(3.86%—11.93%)。多孢子菌属(Pleospora)、支顶孢属(Acremonium)、Corollospora、Cochlonema是3个地区根际土壤的真菌优势属 (图4)。
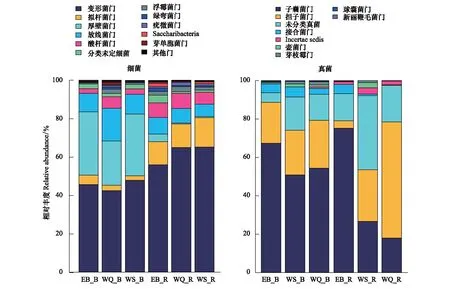
图3 黑果枸杞根际和非根际土壤微生物门水平群落组成Fig.3 Microbial community composition at phylum rank in rhizosphere and bulk soils of Lycium ruthenicum

图4 黑果枸杞根际和非根际土壤微生物属水平群落组成Fig.4 Microbial community composition at genus rank in rhizosphere and bulk soils of Lycium ruthenicum
2.3 土壤微生物群落差异性分析
2.3.1 根际与非根际土壤微生物群落的差异性
相似性分析(ANOSIM)表明根际土壤与非根际土壤微生物群落之间具有很大的差异(细菌R=1,P=0.1;真菌R=0.667,P=0.1)。基于OTU的微生物群落主坐标分析(PCoA)表明,非根际群落之间具有较高的相似性,根际群落之间具有较高的相似性,非根际样本与根际样本在第一轴上能明显的区分开(图5)。

图5 基于weighted unifrac距离的土壤微生物群落的主坐标分析Fig.5 Principal co-ordinates analysis (PCoA) of microbial communities based on weighted unifrac distance Bulk: 非根际土壤, bulk soils;Rhi: 根际土壤,rhizosphere soils
根际细菌的变形菌门、拟杆菌门、酸杆菌门的相对丰度高于非根际土壤,而厚壁菌门、放线菌门的相对丰度则降低,尤其是厚壁菌门的丰度显著降低(P<0.05)(图3)。Gamma变形菌的丰度在根际土和非根际土中无显著差异,而alpha变形菌在根际土中的丰度显著高于非根际土(P<0.05)(表3)。真菌优势门丰度在根际土和非根际土中的差异因地区而异;子囊菌门在WQ和WS根际土中的丰富度低于非根际土,担子菌门在WQ和WS根际土中的丰度升高,然而在EB则相反。属水平上,根际细菌的优势属数量多于非根际土壤,非根际群落优势属,如微小杆菌属、柠檬酸杆菌属、不动杆菌属在根际土壤中的丰度显著降低,而低丰度的属,如Haliea、Pelagibius、Microbulbifer、Thioprofundum、Deferrisoma在根际土壤中富集成为优势属,此外,Gp10、盐单胞菌属(Halomonas)等属在根际土壤的丰度也显著升高(图6)。真菌根际真菌群落的优势属数量低于非根际土,非根际土壤的优势属,如曲霉属、犁头霉属、被孢霉属、青霉属、丝膜菌属、Penidiella、Phaeosphaeria等在根际土壤中的丰度显著降低甚至消失,而一些丰度较低的属,如被孢霉属、多孢子菌属、Cochlonema、Corollospora在根际土壤中富集成为优势属(图6)。

表3 变形菌门中各纲的丰度/%

图6 以不同地区间具有丰度差异属构建的热度图和聚类关系图Fig.6 Heatmap and cluster relationship of genera with abundance differed among different regions
2.3.2 盐化生境与非盐化生境间群落结构差异
PCoA表明无论根际还是非根际土壤,非盐化生境WS和WQ微生物群落间的相似性高于与盐化生境EB之间的相似性(图5)。门水平上,细菌delta变形菌和真菌子囊菌门在EB非根际土中的丰度显著高于WS和WQ(表3)。根际土壤细菌alpha变形菌以及真菌在EB中的丰度低于WQ和WS,细菌delta变形菌、拟杆菌门、厚壁菌门,以及真菌子囊菌门和接合菌门担子菌门在EB的丰度高于WQ和WS, 然而它们的相对丰度在WQ和WS之间无明显差异。
属水平上,根际土壤细菌中的假单胞菌属、Haliea、盐单胞菌属、Geminicoccus、Salinimicrobium、动性球菌属、Albidovulum等属,以及非根际土壤细菌中的Deferrisoma、Gp10、Gillisia、Salinimicrobium、Salisaeta、盐单胞菌属在3个地区之间具有差异。另外,盐化生境(EB)中根际土壤嗜盐细菌的丰度明显高于非盐化生境(WQ、WS),如盐单胞菌属、动性球菌属(Planococcus)、Geminicoccu、Pelagibius、Gracilimonas、Salinimicrobium、Rubrivirga、Methylohalomonas、Thiohalobacter等(图6)。对于真菌,EB非根际土壤中多孢子菌属的丰度很低,而在WQ和WS为优势属,且在WQ和WS的丰度基本相同;而青霉属、曲霉属、Meyerozyma等属则相反。根际土壤中,小囊菌属是EB的最优势属, 而WQ和WS的最优势属为Melanoleuca;此外,地孔菌属(Geopora)、Xenobotrytis、Brachyconidiellopsis、多孢子菌属等属在EB的丰度显著高于WQ和WS,这5个属的总丰度占EB真菌总丰度的61.33%,而在WQ和WS的丰度为3.09%和3.26%,与之相反,Chaetomium、Phaeosphaeria在EB丰度显著低于WS和WQ,而且在后两者中的丰度相近(图6)。
2.4 微生物群落与土壤理化因子的关系
相关性分析表明土壤TOC与TON显著正相关(P<0.01),pH与EC正相关(P>0.05);细菌群落多样性与土壤TOC、TON正相关,与pH、EC负相关;真菌群落多样性与TOC、TON显著负相关(P<0.05),与EC和pH分别呈负相关和正相关(表4)。CCA结果表明TOC、TON是根际微生物群落的主要影响因子,EC、pH是非根际微生物群落的主要影响因子;EC对EB根际群落也具有重要的影响(图7)。

表4 细菌、真菌群落多样性与土壤理化性质的相关性
*:显著性水平significance level:*P<0.05;***P<0.01

图7 微生物群落组成与土壤理化性质的典范对应分析Fig.7 Canonical correspondence analysis (CCA) between microbial community composition and soil chemical properties TOC:总碳,total organic carbon;TON:总氮,total nitrogen;pH:pH值;EC:电导率,electrical conductivity
3 讨论
非根际和根际土壤中细菌丰富度高,而真菌数量相对较少,这与土壤中微生物以细菌为主一致[21]。根际细菌多样性高于非根际细菌,而根际真菌多样性却低于非根际土壤。根际土壤中营养物质高于非根际土壤,有利于细菌的繁殖从而丰富度和多样性升高,相关性分析也表明细菌多样性和组成与TOC、TON正相关,与以往研究相一致[22-23];而土壤真菌多为病原菌[24],不利于植物生长,可能被植物根系主动过滤,导致根际真菌多样性低于非根际。
根际细菌、真菌群落组成与非根际土壤存在明显的差异,PCoA结果也表明非根际土壤与根际微生物群落分离明显,非根际土壤群落之间,以及根际土壤群落之间各具有较高的相似性。门水平上,根际土壤中细菌的变形菌门(alpha变形菌)、拟杆菌门、酸杆菌门的相对丰度高于非根际土壤,而厚壁菌门、放线菌门的相对丰度则降低,尤其是厚壁菌门的丰度显著降低。真菌子囊菌门在WQ和WS根际土中的丰富度低于非根际土,担子菌门在WQ和WS根际土中的丰度升高,然而在EB则呈相反的趋势。属水平上,根际细菌的优势属的组成比非根际土壤的均匀度高,根际细菌的优势属数量多于非根际土壤,且单个优势属的丰度比非根际土的低;非根际土壤的优势属,如微小杆菌属、柠檬酸杆菌属、不动杆菌属在根际土壤中的丰度显著降低,而Haliea、Pelagibius、Microbulbifer、Thioprofundum、Deferrisoma在根际土壤中显著富集成为优势属。
根际与非根际菌群的差异,一方面是因为根际土壤TOC、TON的含量高于非根际土,EC低于非根际土,利于某些特定类群的增殖和丰度的提高。CCA结果表明根际细菌和真菌群落结构与土壤TOC和TON呈正相关关系,而非根际细菌和真菌群落结构与土壤EC和pH呈正相关关系。总体上,根际土壤细菌群落多样性高于非根际,例外的是WQ非根际细菌多样性和丰富度均高于根际,可能与该采样点位于人工林带内,非根际土壤的水分和养分含量高,利于微生物繁殖。另一方面,是植物从自身代谢和健康出发,由根系主动选择形成的[25],gamma变形菌包含许多促植物生长细菌(PGPR),如具有固氮作用的芽孢杆菌属、固氮菌属(Azotobacter),在生产和释放植物激素[26-27]和土壤源植物病原菌(如真菌)的生物防治[28]中有重要作用。alpha变形菌包含许多植物共生固氮菌,如Rhizobium、Rickettsia;delta变形菌的一些物种,如Desulfovibrio、Geobacter、Bdellovibrio等,对土壤硫循环具有重要作用,对植物生长有重要作用,因此在根际土壤中的丰富度明显高于非根际土壤;alpha和delta变形菌的丰度升高是在根际土壤中变形菌门的丰度显著高于非根际土的主要原因。另外,一些嗜盐或嗜盐碱细菌也对植物生长有促进作用,如盐单胞菌属、芽孢杆菌属[5]、Microbulbifer[29]、动性球菌属[30],因此在根际土中的丰度高于非根际土。
子囊菌门和担子菌门黑果枸杞根际土壤丰度最高的两个门,也是土壤中最丰富的真菌类群。李越鲲等[20]对青海、新疆、宁夏地区栽培的宁夏枸杞(L.barbarum)根际真菌群落的研究发现,总体上,子囊菌门和接合菌门是丰度最高的门,然而,青海格尔木地区的根际真菌丰度最高的仍为子囊菌门和担子菌门。球囊菌门能够侵染大多数陆生植物根系形成菌根,增强植物吸收水分、养分、以及抵御环境胁迫的能力,本研究发现球囊菌门在真菌群落中的相对丰度较低,与宁夏枸杞中的结果相似。我们还发现,真菌根际真菌群落的优势属数量低于非根际土,非根际土壤的优势属,如曲霉属、犁头霉属、被孢霉属、青霉属、丝膜菌属、Penidiella、Phaeosphaeria等在根际土壤中的丰度显著降低甚至消失,而被孢霉属、多孢子菌属、Cochlonema、Corollospora等属在根际土壤中显著富集成为优势属。
微生物群落多样性和组成在不同生境之间的差异与土壤理化性质密切相关,生境不同,根际微生物群落不同[19]。我们也发现微生物群落的优势类群(门、属)的组成以及丰富度存在地区间差异,特别是盐碱生境(EB)与非盐碱生境(WQ、WS)。厚壁菌门在EB根际土中的丰度高于WQ和WS;在属水平上,一些嗜盐和嗜碱细菌,如盐单胞菌属[31]、Geminicoccu[32]、Pelagibius[33]、Gracilimonas[34]、Salinimicrobium[35]、动性球菌属[30]、Rubrivirga[36]、Methylohalomonas、Nitriliruptor[37]、Thiohalobacter[38]、Aliifodinibius[39]等,在盐碱生境中根际土壤嗜盐细菌的丰度高于非盐碱生境;另外,这些嗜盐细菌在根际土壤的丰度高于非根际土壤,表明EB地区根际土壤的相对高的含盐量与营养成分促进了它们的繁殖和丰度的提高,CCA分析也表明它们与TOC、TON正相关。
PCoA结果表明含盐量低的WQ和WS的根际土壤微生物群落的相似度高于与EB之间的相似度,CCA结果也表明EB根际细菌群落与EC也具有正相关关系,说明含盐量对土壤微生物群落结构具有重要的影响。但是也有研究表明盐胁迫能显著降低根际土壤细菌群落的丰富度,例如,盐敏感黄瓜品种根际细菌的丰富度在低盐处理下较高,而耐盐黄瓜品种根际细菌的丰富度在高盐胁迫下较高[40],说明盐分是植物根际微生物群落的重要影响因子,然其作用效果也受植物根际效应的制约[13]。另外,气候条件,特别是水分和温度,对植物生理、光合作用,根系活动具有重要的调控作用,进而影响根际微生物群落的组成[12, 41],可是,本研究未对水分、温度因子进行测量,它们对群落结构的影响有待于进一步的研究。
