组织工程肌细胞定向排列方法的研究进展
2018-10-18董贵荣杨来侠呼延一格
董贵荣,杨来侠,连 芩,呼延一格,高 扬
(1.西安科技大学 机械工程学院,陕西 西安 710054;2.西安交通大学 机械制造系统工程国家重点实验室,陕西 西安 710049)
0 引 言
先天性缺陷、损伤、肿瘤、原发性肌病、代谢性疾病等各种原因造成的骨骼肌缺损和功能丧失临床常见[1-6]。目前,针对体积肌肉缺损的治疗方法主要是肌皮瓣移植、肌肉瓣移植,即取自身健康部位的肌皮瓣来修复肩部,肘部,手臂等部位[7-11]。但由于可利用的肌肉来源有限,对供区损伤较大,以及异体移植供体来源和免疫排斥等问题,使其应用受到限制。随着组织工程的发展,尤其是骨骼肌组织工程在肌肉组织再生和功能重建方面的进展,使人们看到了解决骨骼肌组织缺损和功能丧失等问题的希望。
肌肉组织工程的概念是指从病患或供体收集肌肉细胞,通过体外培养或组织工程支架培养构建能植入病患体内的功能性肌肉组织,修复和替代缺损或病变组织,促进功能恢复的一项技术,如图1所示[12]。此外,肌肉组织工程还广泛应用于药物筛选[13-14],构建肌肉驱动装置[15-17],机器人装置[18-20],和食品来源研究等领域[21]。
支架是肌肉组织工程中的重要因素,常用的细胞定向排列方法有2种,一种是通过支架结构的约束,实现细胞在支架表面的定向排列,另外一种是支架本身可以有结构也可以无结构,种植或封装成肌细胞或卫星细胞,通过外界刺激实现细胞在支架上的定向排列,并向着肌组织方向分化,实现支架在组织内的修复[22-25]。现将肌肉组织工程的发展历史及目前广泛应用的几种肌细胞定向排列的方法介绍如下。

图1 肌肉组织工程Fig.1 Muscle tissue engineering
1 肌肉体外组织工程
早在100 a前,Lewis就首次进行了鸡胚胎腿部肌肉细胞的体外静态培养[26]。20世纪60年代,Hill,D K等人解剖获得蟾蜍横纹肌,并对规则排列的纤维束进行了初步研究[27]。70年代末期开始,肌肉组织的研究方法和技术得到了重视。例如Vandenburgh构建了一种力学刺激后形成的骨骼肌体外胶原模型[28]。90年代初期,Strohman 等人将种植在薄膜上的的肌细胞分离后再次堆积,首次构建了三维体外可实现收缩功能的肌肉组织[29],被Dennis 团队称为“myooids”[30]。Lam等人将在具有微结构的PDMS上定向排列和分化后的肌小管,转移到纤维蛋白凝胶中自组装形成三维组织工程支架[31-32]。研究证实,肌肉组织工程的关键是肌细胞的定向排列,常用的细胞定向排列方法有2种,一种是通过支架结构的约束或表面化学修饰,实现细胞在支架表面的定向排列,目前常用的支架微制造方法有软刻蚀制造技术[33],热模压制造技术[34],电纺制造技术[35],影印及溶剂浇注制造技术等[36]。另外一种是在支架中种植成肌细胞或卫星细胞,通过外界给予一定的刺激(如力学刺激[37-38]或电和磁的刺激[39-40]),实现细胞在支架上的定向性,并向着肌组织方向分化,最终完成支架在组织内的修复。
2 支架结构促进细胞排列的方法
早在1964年,Curtis就发现不同表面结构的玻璃对细胞粘附生长机理有很大的影响[41],近年来,大量研究结果显示不同的结构特征,比如尺寸、形状等都能在很大程度上影响肌细胞的生长和排列[42-45],文中主要归纳了不同尺寸的支架结构对细胞生长的影响。
2.1 宏观尺寸的支架
悉尼大学Xiao Hua等人将C2C12和hMSCs细胞种植在丝素基生物材料上,通过马血清的刺激观测到成肌细胞的定向排列和分化,证实该材料的表面粗糙度值越大硬度越高,对细胞的定向排列,增值和分化越有利,如图2(a)所示[46]。德国比勒菲尔德大学V.Kroehne等人使用具有20~50 μm平行排列微孔的海绵,浸过高浓度C2C12细胞悬液后,植入裸鼠的胫前肌,证明该支架能与周围组织融合,在原位形成方向性肌纤维[47],阿肯色大学Shiloh A.Hurd等人使用Sprague Dawley鼠的腓肠肌制备脱细胞支架,通过力学检测和体外培养证明,虽然与肌肉本身的力学强度有一定的差距,但是该多孔支架具有良好的生物相容性,能有效刺激细胞的延长和定向排列,如图2(b)所示[48]。
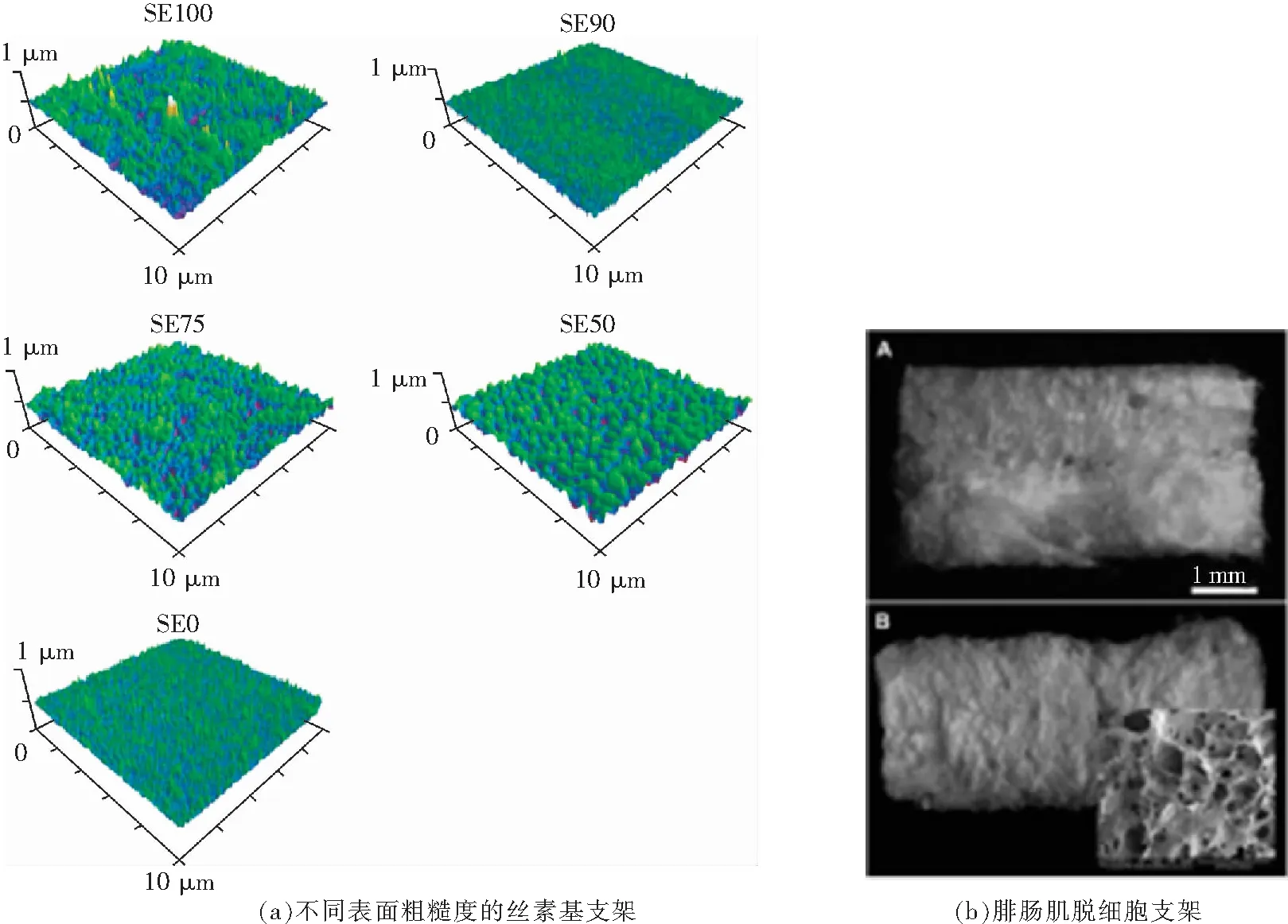
图2 宏观尺寸支架Fig.2 Macro size scaffolds
2.2 中等尺寸的支架
Peckham,P.H 等早在1976年就研究证实过支架上的槽能够有效诱导细胞的定向排列和分化,过去的几十年中,有很多组织致力于研究支架表面上槽宽和形状对细胞排列和分化的影响[49-50]。
日本东北大学Vahid等人利用PDMS翻模制备了表面具有不同尺寸凹槽结构的GelMA水凝胶支架,并将2 ×106cells/mL浓度的C2C12细胞种植到凹槽内,通过持续2 ms的电脉冲(振幅22 mA,频率1 Hz)刺激,使细胞定向排列,最终形成了肌小管,并证实脊宽的增加对细胞与定向排列程度成反比,其中槽宽为100 μm的支架能够更有效的诱导细胞的定向排列和分化[51]。Shangwu Chen等人也做了类似的凹槽研究,使用胶原冻干制备出凹槽支架,模拟肌纤维外的基底膜,证实基底膜能有效的促进肌肉生长和维持肌肉的完整性,如图3(a)所示[48,52],通过检测证明,120~380 μm范围内的槽宽对细胞的定向排列影响显著,但对细胞的分化影响不大。大量研究结果证实,对于微米级尺寸的凹槽结构而言,减小槽宽和增加槽深度都能有效促进细胞的定向排列。

图3 中等尺寸支架Fig.3 Medium size scaffolds
除了表面凹槽结构以外,其他的表面形状也能有效引导肌细胞的定向排列和分化。90年代末期,日本Tohoku大学的Vahid Hosseini等人使用直径分别为180,250,400,和500 μm 的尼龙线和镍金属丝缠绕在玻璃片,细管和针头上,翻模制备出GELMA水凝胶,通过对支架上的细胞进行DAPI肌动蛋白染色证实,证实螺旋结构比平行排列的结构能更有效地提高肌小管的生成率,如图3(b)所示[53]。美国华盛顿大学Hee Seok Yang等人则制备了表面带有凹槽的PLGA支架,并种植于鼠四头肌,结果表明该结构的体内实验仍然能有效刺激细胞分化基因表达[54]。美国伊利诺伊大学的Bajaj使用微刻蚀技术制备出直线,圆环及前2种混合形状的纤连蛋白支架,并以融合指数,细胞成熟度,定向排列情况和电刺激结果4个分化参数为标准,观察C2C12细胞的分化情况,证实了直线并带有30度弧度的形状对细胞的分化最为有利,如图3(c)所示[55]。在这之后,该团队还尝试用石墨烯基质的支架促进C2C12成肌细胞的定向排列和分化[56]。此外,还有学者尝试使用在纳米薄膜上复合纤连蛋白线和纳米碳管促使细胞的定向排列,之后卷裹成圆管进行[57]。
2.3 微观尺寸的支架
支架上微米尺寸和纳米尺寸的槽都可以有效促进细胞的定向排列生[58]。Kim等人使用光固化和纳米翻模技术制备带有纳米凹槽的PEGDA水凝胶支架,模拟细胞外基质的环境,诱导心肌细胞定向排列。结果证明,槽宽从50 到800 nm的尺寸中,槽宽越大,越有利于新生鼠肌细胞的贴附生长,同时槽宽略大于或等于细胞尺寸时,对细胞的定向排列更为有利,如图4(a)所示[59]。
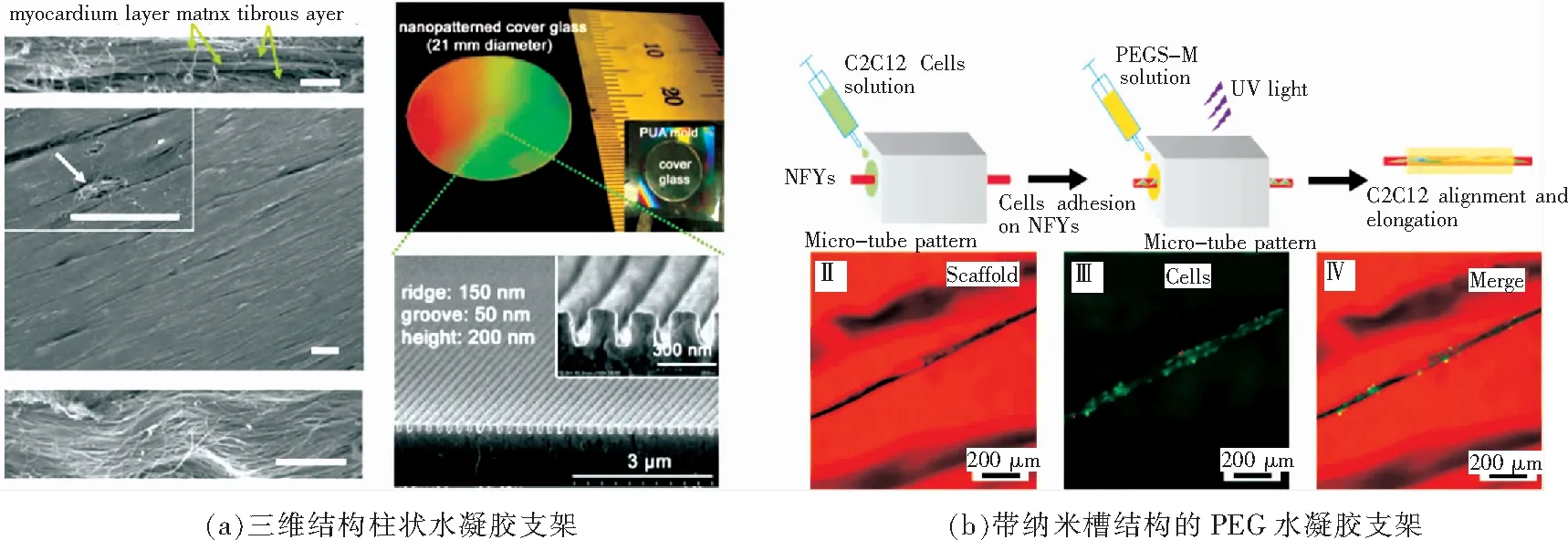
图4 微观尺寸支架Fig.4 Micro size scaffolds
尽管中等尺寸和微米级别的槽宽都能刺激细胞的定向排列和生长,但2种方法还是有很大的区别,中等尺寸的槽宽通常大于或等于单个细胞的尺寸,利于细胞的粘附和迁移,并且通过自身结构约束细胞进行定向排列,而对于微型尺寸的微槽,尺寸往往比单个细胞尺寸还要小很多,因此这种结构主要通过模拟细胞外基质及体内环境,刺激细胞定向排列[60]。
自从Formhals 等在1934年利用电纺技术实现纳米纤维无纺布的构建之后,静电纺丝技术就为大家所熟知。由于电纺丝可以模拟天然骨骼肌组织的各向异性,同时诱导细胞沿纺丝方向定向排列,因此,电纺技术也广泛应用于骨骼肌组织工程[35,61-62]。曼彻斯特大学的James M.Dugan等人通过旋涂工艺,将5~6 nm的纳米纤维须定向排列制备成支架,观察到C2C12细胞的定向排列和融合,如果在支架表面涂覆纤连蛋白,4 d后能够观察到肌小管的生成[63]。由于纳米结构尺寸有限,多数支架限于二维结构,西安交通大学Ling Wang等人将通过利用光固化技术,用光固化水凝胶包裹电纺丝制备出封装C2C12细胞的三维结构支架,实现了细胞在三维支架上的伸长,定向排列和分化,如图4(b)所示[64]。
除了微米级别的表面结构和电纺技术外,表面化学处理也是诱导细胞的增值,粘附和分化的常用技术[65]。Whitesides 等人使用微接触印刷技术(Microcontact printing,μCP)技术,通过对硫醇和胶体自组装形成表面微结构[66]。μCP技术可使用多种生物分子材料,包括poly-L-lysine(锁相环)、肽、纤连蛋白、层粘连蛋白和牛血清白蛋白,通过该表面改性技术形成具有微结构的基底层,用于诱导细胞排列。美国波士顿大学Williams等人通过μCP技术用纤连蛋白修饰热敏聚合材料PIPAAm,实现了人类血管平滑肌细胞的定向排列[67]。基于蛋白质对细胞粘附性的调节作用[68],美国伊利诺伊大学George W.在被吸附纤连蛋白的CH3分子修饰过的支架表面上,成功诱导C2C12细胞定向排列和分化[69]。
尽管支架表面结构能够有效诱导细胞定向排列,但是,表面结构在一定程度上会限制细胞的延伸和增值,而表面化学修饰最大的优势在于可以控制细胞排列的范围。研究表明,2种方法都能够促进C2C12细胞定向排列后Myogenesis基因的阳性表达,但表面化学修饰技术对细胞分化形成肌小管的作用更为明显[69]。
3 外界刺激促进细胞排列的方法
3.1 力学刺激
缺乏刺激和机械负载可导致肌肉退化,常见于肌肉萎缩或在航天员在航天微重力作用下产生的的骨质丢失和肌肉萎缩等。目前力学刺激被广泛应用于基因调节,内源性蛋白质调节和代谢产物的研究中[70-71]。有报道指出,在持续的轴向力作用下,弹性支架上培养的L6细胞可定向排列并分化成肌小管,在循环加载的作用下,肌小管则与施力方向垂直排列[72-73]。还有一些研究表明,对封装肌细胞的胶原凝胶进行单轴向持续加载,可形成与加载方向一致的定向排列的肌小管[37,74-75]。上海交通大学Bo Liu等人使用Flexercell Tension Plus system(FX-4000T,Flexcell International)对支架进行力学加载,证明1.25 Hz的频率对于细胞的定向排列是最有利的参数[76]。亚利桑那大学的Michael R等人在薄膜上种植C2C12和人皮肤成纤维细胞进行共培养,同样利用该系统对薄膜进行加载,结果表明相对于短期循环加载,长期非循环加载能够骨骼肌细胞的定向排列和分化基因表达,这对治疗神经肌肉障碍具有一定的临床意义[77]。
3.2 电磁刺激
研究表明,电场刺激能够有效促进细胞定向排列,并增加肌凝蛋白的产生,促进肌纤维和收缩蛋白的形成。尽管电刺激对临床有重要研究意义,但是目前在细胞行为评估和建立功能性组织等方面,电场参数的控制还处于探索领域。日本东北大学Samad Ahadian等人使用交叉阵列的Pt电极对种植C2C12细胞的GELMA水凝胶刺激1天后,就看到80%的细胞形成了肌小管。同时大量的C2C12肌管覆盖范围,肌管长度,肌肉转录因子和蛋白质生物标记物等也远高于直接用Pt线对细胞的刺激的结果[39]。意大利学者制备了拓扑形状PLA细胞膜,每30 s使用70 mV/cm的电参数对种植肌前细胞的支架进行电场刺激,观察到平行排列的肌小管,并检测到Ⅰ型肌钙蛋白和肌间线蛋白的产生[78]。磁场目前研究内容较少,Dario Coletti等人利用80.6 mT的定制化磁铁,首次通过磁场刺激,观察到L6细胞的定向排列和分化现象[79]。
4 结 论
在组织工程领域研究中,研究肌细胞定向排列的方法众多。文中总结了常见的细胞定向排列的方法,包括支架结构,表面修饰技术和外界刺激等,比较了各种方法的优缺点。在具体的研究中,这几种方法可以结合使用,共同促进细胞的定向排列,并为细胞的分化和肌小管的形成提供有利条件。
随着3D打印技术在组织工程中的应用发展,单细胞打印技术通过控制液滴大小,能够有效控制细胞的排列方式。但是目前的研究仍然存在一些不足,虽然支架结构能够有效促进细胞的定向排列,但是对支架的外形尺寸限制较大,同时这些结构都与体内的实际组织有很大差别,支架的仿生应当从结构仿生到功能仿生,并最终与宿主有机结合。
限制支架尺寸的主要问题是内部微流道的设计和制造,合理的仿生微流道,能模拟血管网为周围细胞和组织提供营养,是实现血管化的关键技术,也为大块仿生肌肉支架的临床应用提供研究基础。目前支架内的微流道制造技术,不仅可以实现多级多尺寸,还可以模拟血管的分维结构。但是目前的打印系统和打印材料还无法完全实现结构到功能的仿生,打印过程在重复性和可靠性上尚不能满足组织工程的要求,很难完成不同功能细胞的分级打印过程,从而无法实现多层大块组织的集成和自组装,如从皮肤到肌肉、开发多细胞高精度3D打印平台及实现精准打印工艺,打印出功能性组织将是肌肉组织工程的发展方向。同时,大块组织体外血管化,并且植入后与宿主损伤部位血管吻合生长及细胞/支架复合体的成活也亟待研究。
此外,磁场对细胞排列分化的研究较少,相对于静电磁场来讲,极低频磁场是否会引起真核细胞基因突变及癌变的可能性仍然值得探讨研究。以上技术难点不仅是大尺寸三维支架制造和再生医学领域的理论基础研究,也是功能性肌肉组织临床应用的基础研究。
