大黄素对低氧环境下SGC7901细胞HIF-1α和E-cadherin的影响*
2018-10-18张秋菊李能莲马亚伟李亚玲
张秋菊 ,李能莲,马亚伟,刘 靓,侯 茜,李亚玲
(1.甘肃中医药大学基础医学院,甘肃 兰州 730000; 2.甘肃中医药大学临床医学院 2013级临床医学专业B班, 甘肃 兰州 730000)
大黄是一味主要的破坚攻邪中药,泻下、破积、行瘀的功效强悍,因此被称为“将军”。恶性肿瘤大多有气滞郁结、痰湿凝滞等病理因素,迁延日久而凝聚成肿块。据“坚者削之,留者攻之,结者散之,客者除之”的治疗原则,大黄常被作为攻邪药来治疗肿瘤,疗效显著。低氧是人体有形之瘤微环境的一个最显著特点,绝大多数肿瘤细胞可耐受缺氧而存活,缺氧诱导因子-1α(hypoxia-inducible factor,HIF-1α) 就是启动这一过程的关键分子。E-钙黏蛋白(E-cadherin)是上皮细胞连接中最主要的黏附分子,被认为是HIF-1α下游的靶基因。HIF-1α和E-cadherin可共同影响肿瘤细胞的增殖与迁移[1]。本研究通过大黄的有效成分大黄素(emodin)干预胃癌SGC7901细胞来探讨大黄素在低氧环境中对肿瘤细胞增殖及HIF-1α和E-cadherin的影响。
1 材料与方法
1.1 细胞培养
胃癌SGC7901细胞株由甘肃中医药大学中西医结合实验室馈赠。将SGC7901细胞株用加入体积分数100 mL/L的胎牛血清、质量分数100 mg /L青、链霉素的RPMI 1640培养液培养,放置于37 ℃、50 mL/L CO2、饱和湿度的培养箱,常规传代培养。取对数生长期SGC7901细胞,经质量分数为2.5 g/L的胰酶消化后,接种于细胞培养瓶中,置于37 ℃、10 mL/L O2、940 mL/L N2低氧培养箱中培养。
1.2 试 剂
大黄素(纯度﹥98%)、MTT试剂盒、二甲基亚砜(DMSO),均购自北京索莱宝科技有限公司,批号依次为S90044,M8180,8370;鼠抗人E-cadherin单克隆抗体,购自北京中杉金桥生物有限公司,批号ZM-0092;鼠抗人HIF-1α多克隆抗体,购自于Immunoway公司,批号B3301。
1.3 分组与处理
实验分空白对照组(含DMSO的培养基)和实验组(大黄素分别为10,20,40,80,160 μmol/L),共6组。大黄素用DMSO溶解稀释后,用体积分数100 mL/L 胎牛血清的RPMI 1640培养液分别稀释为10,20,40,80,160 μmol/L,待用。
1.4 检测指标
1.4.1 胃癌SGC7901细胞增殖情况
以 MTT法检测大黄素对胃癌SGC7901细胞增殖的影响。取对数生长期SGC7901细胞,以培养液稀释为终浓度为1×105/mL 的单细胞悬液,以每孔100 μL 加入96孔培养板中,置于37 ℃、10 mL/L O2、940 mL/L N2的低氧培养箱中培养,24 h后实验组加入不同浓度的大黄素。每组设5个重复孔,继续分别孵育12,24,36,48 h。实验结束前4 h加入质量分数为5 g/L的 MTT溶液20 μL ,振荡后继续培养4 h,终止培养,吸去上清,加入100 μL DMSO振荡溶解10 min,空白对照调零,用酶联免疫检测仪测定490 nm波长下各孔OD值。计算细胞抑制率:抑制率=(1-实验组OD值/对照组OD值)×100%。
1.4.2 E-cadherin和HIF-1α在胃癌SGC7901细胞中的表达
免疫组化检测E-cadherin和HIF-1α在细胞中的表达。盖玻片泡酸、高压灭菌后,平放于12孔培养板底部;取对数生长期胃癌SGC7901细胞,以培养液稀释为终浓度为1×105/mL的单细胞悬液;每孔加入2 mL;置于37 ℃、10 mL/L O2、940 mL/L N2低氧培养箱中培养;24 h细胞贴壁后,换液。根据MTT结果,选取大黄素10,40,80 μmol/L 3个梯度组,每组4个重复孔,设空白组,低氧孵育36 h。终止培养,以100 g/L 多聚甲醛固定,常规免疫组织化学染色法分别标记E-cadherin和HIF-1α。结果判定:E-cadherin表达在细胞浆和细胞膜上,HIF-1α表达在细胞质和细胞核上,呈棕黄色颗粒,在不同部位均一弥漫性分布。按染色强度[2]分为3级:浅黄色为(+),棕黄色为(++),棕褐色为(+++)。
1.4.3 胃癌SGC7901细胞形态变化
倒置显微镜下,不同倍数各取5个视野,观察大黄素对SGC7901细胞形态的影响。
1.5 统计学方法

2 结 果
2.1 不同时间、不同浓度大黄素对胃癌SGC7901细胞增殖的影响
MTT结果显示:大黄素可明显抑制低氧环境中SGC7901细胞的增殖,抑制率与浓度、时间呈成正相关。见表1和图1。
表1 不同时间、不同浓度大黄素对胃癌SGC7901细胞的影响
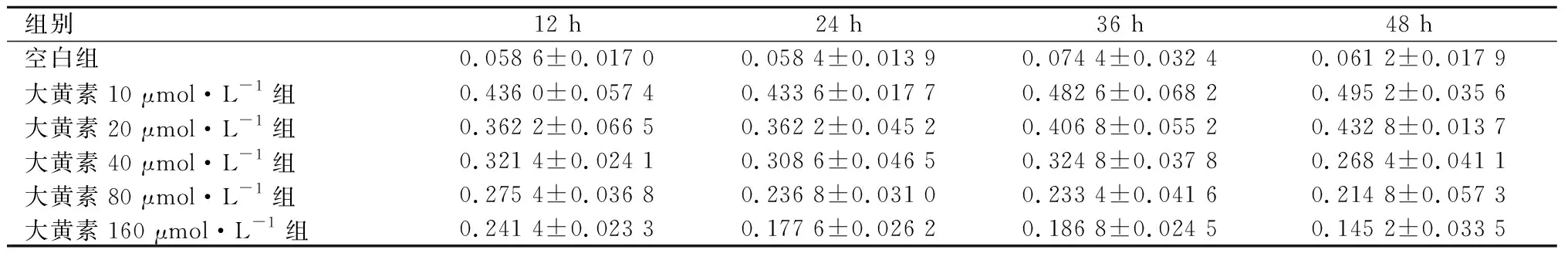
组别12 h24 h36 h48 h空白组0.058 6±0.017 00.058 4±0.013 90.074 4±0.032 40.061 2±0.017 9大黄素10 μmol·L-1组0.436 0±0.057 40.433 6±0.017 70.482 6±0.068 20.495 2±0.035 6大黄素20 μmol·L-1组0.362 2±0.066 50.362 2±0.045 20.406 8±0.055 20.432 8±0.013 7大黄素40 μmol·L-1组0.321 4±0.024 10.308 6±0.046 50.324 8±0.037 80.268 4±0.041 1大黄素80 μmol·L-1组0.275 4±0.036 80.236 8±0.031 00.233 4±0.041 60.214 8±0.057 3大黄素160 μmol·L-1组0.241 4±0.023 30.177 6±0.026 20.186 8±0.024 50.145 2±0.033 5

图1 胃癌SGC7901细胞抑制率与大黄素浓度、时间的关系
2.2 不同浓度大黄素对胃癌SGC7901细胞形态的影响
倒置显微镜观察不同浓度大黄素作用36 h后SGC7901细胞数目和形态的变化。SGC7901细胞随着大黄素浓度的增加,细胞数目明显不断减少;细胞形态由原来的多边形逐渐变成小圆形;细胞与细胞之间的距离增大,连接消失,但细胞表面的突起逐渐变得粗大、延长。当大黄素浓度达到160 μmol/L时,绝大多数细胞变圆变亮,悬浮死亡。见图2。


黑色箭头所示为细胞间连接,白色箭头所示为细胞突触图2 不同浓度大黄素干预36 h后的SGC7901细胞(×40)
2.3 不同浓度大黄素对SGC7901细胞中E-cadherin和HIF-1α表达的影响
E-cadherin和HIF-1α在SGC7901细胞中呈现不同的表达强度,应用Spearman等级相关分析发现:E-cadherin的表达与大黄素的浓度呈正相关(r=0.816,P=0.001<0.05),而HIF-1α的表达与大黄素的浓度呈负相关(r=-0.646,P=0.023<0.05)。见图3和表2。

图3 大黄素浓度为80 μmol/L时,HIF-1α
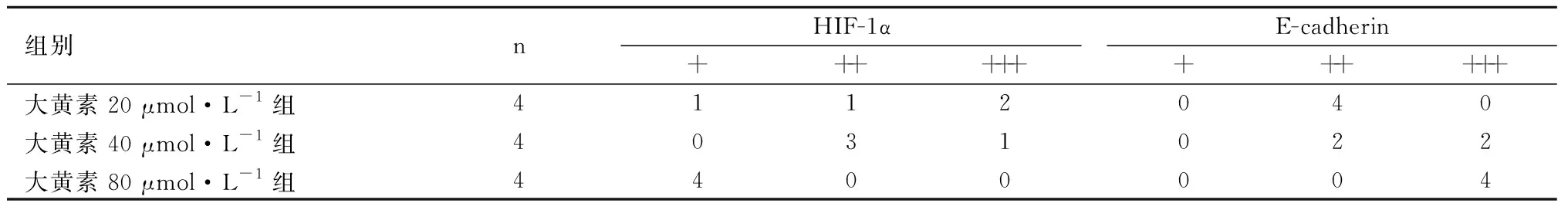
组别nHIF-1α++++++E-cadherin++++++大黄素20 μmol·L-1组4112040大黄素40 μmol·L-1组4031022大黄素80 μmol·L-1组4400004
3 讨 论
大黄素的化学名称为 1,3,8-三羟基-6-甲基蒽醌,是中药大黄的有效成分,也是分布最广泛的一种蒽醌类物质。近年来研究发现,大黄素有明显的抗肿瘤作用,但是作用机制仍有争议[3]。HIF-1α是缺氧诱导因子的最主要亚型,与肿瘤细胞的能量代谢、血管生成、细胞增殖和凋亡等有密切关系。目前,HIF-1α被认为是肿瘤治疗的潜在靶点,相应的药物已经进入临床试验阶段。本实验模拟了实体瘤的低氧微环境,采用不同浓度的大黄素干预胃癌SGC7901细胞,发现大黄素可明显抑制低氧环境下SGC7901细胞的增殖,而且抑制率随浓度和时间的增加而增大,证实了大黄素的抗肿瘤活性。
免疫组织化学结果显示,HIF-1α在SGC7901细胞中的表达随大黄素浓度增加而降低(r=-0.646,P=0.023<0.05),而E-cadherin蛋白的表达则与大黄素质量分数呈负相关(r=0.816,P=0.001<0.05)。大黄素干预后,HIF-1α和E-cadherin蛋白的表达呈现出了相反的趋势,这一结论和多数学者研究结果相同,即E-cadherin是HIF-1α下游的靶基因,HIF-1α可活化上调E-cadherin的转录抑制因子[4-5]。因此,笔者认为大黄素可能通过降低HIF-1α,上调E-cadherin的表达这条通路,来杀伤肿瘤细胞,从而达到治疗肿瘤的目的。
在实验过程中,笔者发现大黄素还可影响SGC7901细胞的形态。正常生长的SGC7901细胞为多边形,核大、位于细胞中央,细胞间桥密集可见。随着大黄素浓度的增加,细胞呈现多态性,其表面的突起逐渐变得粗大、延长,最后体积逐渐缩小,变为小圆形,细胞间桥也随细胞与细胞之间的距离增大而消失。笔者推断细胞出现这种变化的原因可能为:大黄素影响了肿瘤细胞之间的连接作用,而发挥这一作用的蛋白质是E-cadherin,免疫组织化学结果也恰好证实了这一点[6-11]。
根据本实验结果推断:在低氧环境下,大黄素可能通过降低HIF-1α和增强其下游靶基因E-cadherin的表达这一通路来减弱肿瘤细胞对缺氧的耐受,使其增殖、迁移活性下降,甚至死亡,从而实现治疗肿瘤的效果。
