表皮生长因子对脂多糖刺激断奶仔猪肠道钠磷转运载体蛋白Ⅱb表达的影响
2018-10-17汤小朋李成良禹琪芳方热军
汤小朋 徐 荣 李成良 彭 鹏 禹琪芳 方热军
(湖南农业大学动物科学技术学院,湖南畜禽安全生产协同创新中心,长沙410128)
磷(P)是生物系统的重要组成部分,涉及到各种生理过程,包括能量代谢、细胞信号、核苷酸和磷脂生物合成以及牙齿、骨骼形成[1-2]。研究已证实钠磷转运载体蛋白Ⅱb(type Ⅱb sodium-phosphate cotransporter, NaPi-Ⅱb)是介导肠道磷主动转运的主要途径[3-4]。NaPi-Ⅱb受许多因素的调节,表皮生长因子(epidermal growth factor,EGF)是调节其表达的重要因素之一[5-8]。EGF是一种重要的生长因子,广泛存在于乳液、唾液、尿液、肠液、血液、羊水等体液中,对细胞生存、增殖与分化、迁移、凋亡等具有重要作用[9-11]。前人在人Caco2细胞及猪小肠上皮细胞(IPEC-J2)中的研究表明,EGF可抑制细胞NaPi-Ⅱb的表达,说明在正常培养条件下,EGF可能通过其他途径调节细胞对磷的吸收。理论上讲,在EGF对肠道屏障功能的修复过程中,必然伴随大量DNA、RNA和蛋白质的合成,其前提需要经肠道吸收更多的磷,此过程中所需更多的磷是通过何种途径满足机体需要还未见报道。因此,本研究通过细胞试验与动物试验相结合的方法,研究EGF对脂多糖(LPS)刺激的应激状态下断奶仔猪小肠磷吸收的影响,为进一步诠释EGF对磷的吸收提供新的认识。
1 材料与方法
1.1 细胞试验
1.1.1 主要试剂
EGF购自Peprotech公司;LPS、Tris、十二烷基磺酸钠(SDS)、过硫酸铵(APS)、四甲基乙二胺(TEMED)、吐温-20(Tween-20)、丙烯酰胺、甲叉双丙烯酰胺、丽春红购自Sigma公司;胎牛血清(FBS)、胰蛋白酶、青链双抗购自Gibco公司;DMEM/F12(HyClon)培养基购自GE公司;CCK-8试剂盒、BCA蛋白试剂盒、磷酸缓冲液(PBS)、RIPA蛋白裂解液购自索莱宝公司;Trizol试剂购自Invitrogen公司;逆转录试剂盒、UltraSYBR Mixture及DM 2000 Plus DNA Marker均购自北京康维世纪公司;Super ECL Plus超敏发光液购自Thermo公司;一抗NaPi-Ⅱb(货号:21773-1-AP)、一抗β-肌动蛋白(β-actin)(货号:60008-1-Ig)、二抗(Goat Anti-Rabbit IgG/HRP)购自Proteintech公司。
1.1.2 细胞培养及分组
IPEC-J2细胞由中国科学院亚热带农业生态研究所提供。细胞经活化后,培养在含10% FBS、1%青链双抗的培养基中,置于37 ℃,含有5% CO2的培养箱中培养。细胞生长至80%~90%融合后,用0.25%胰蛋白酶消化细胞,显微镜下计数,收集的细胞用于细胞传代或进行后续试验。试验设4个组:对照组(0 ng/mL EGF,0 μg/mL LPS)、EGF组(100 ng/ mL EGF,0 μg/mL LPS)、LPS组(0 ng/mL EGF,1.0 μg/mL LPS)、EGF+LPS组(100 ng/mL EGF,1.0 μg/mL LPS),每组3个重复。EGF、LPS剂量的选择及培养时间的确定参照文献[11]。将细胞以1×105个/孔接种于6孔板中,每孔加入2 mL含10% FBS、1%青链双抗的培养基,培养24 h后,弃去培养基,用37 ℃ PBS润洗2遍,然后分别加入相应剂量的EGF与LPS,加入培养基至2 mL,培养24 h。
1.1.3 EGF对LPS刺激的IPEC-J2细胞NaPi-ⅡbmRNA表达的测定
采用实时荧光定量PCR(qRT-PCR)检测细胞NaPi-ⅡbmRNA的表达。细胞培养结束后,用PBS洗涤细胞2次,每孔加入Trizol 1 mL,按照Trizol试剂说明书提取总RNA,并测定总RNA浓度及1%琼脂凝胶检测RNA完整性。以细胞总RNA为模板,用逆转录试剂盒反转录为cDNA,具体步骤参照试剂盒说明书。定量PCR反应按照荧光定量PCR检测试剂盒操作。所用引物由上海生工生物工程技术服务有限公司合成。NaPi-Ⅱb引物序列为F:GCCCGAGCTTAAGAACACA,R:CATGACACCAGCACCATCGTT;β-actin引物序列为F:CATCCTGCGTCTGGACCTGG,R:TAATGTCACGCACGATTTCC。实时荧光定量PCR程序参照Tang[11]介绍的方法进行。以β-actin基因为内参,采用2-△△Ct法进行目的基因相对表达量计算。
1.1.4 EGF对LPS刺激的IPEC-J2细胞NaPi-Ⅱb蛋白表达的测定
采用Western blot检测细胞NaPi-Ⅱb蛋白的表达。细胞培养结束后,弃去培养基,PBS洗涤细胞1次,加入250 μL RIPA细胞裂解液(含1 mmol/L蛋白酶抑制剂),冰上裂解15 min,4 ℃,12 000 r/min离心3~5 min,取上清分装后置于-80 ℃冰箱保存,待测。蛋白浓度测定采用南京建成的BCA蛋白浓度检测试剂盒测定,具体参照说明书步骤进行。Western blot程序参照Tang等[11]介绍的方法进行。
1.2 动物试验
1.2.1 试验材料
EGF由长沙某公司提供,EGF含量为4 000 mg/kg;LPS(大肠杆菌血清型O55∶B5)、石蜡、中性树胶、伊红购自Sigma公司;RT-PCR所需试剂同1.1.3。
1.2.2 试验动物及分组
选取24头体重接近、健康状况良好的21日龄“长白×大白”二元杂交断奶阉公猪[平均体重(5.76±0.38) kg],随机分为4个组:对照组(基础饲粮)、EGF组(基础饲粮+2 mg/kg EGF)、LPS组(基础饲粮+腹腔注射100 μg/kg BW LPS)、EGF+LPS组(基础饲粮+2 mg/kg EGF+腹腔注射100 μg/kg BW LPS),每组6个重复,每个重复1头猪,试验期14 d。基础饲粮配制参照NRC(2012)猪的营养需要,其组成及营养水平见表1。在试验的第8天、第15天清晨,给LPS组和EGF+LPS组仔猪注射100 μg/kg BW的LPS[12],对照组和EGF组注射等量的生理盐水。

表1 基础饲粮组成及营养水平(饲喂基础)
1)预混料为每千克饲粮提供 The premix provided the following per kg of the diet:VA 10 000 IU,VD31 500 IU,VE 60 mg,VK33 mg,VB11.8 mg,VB120.024 mg,核黄素riboflavin 6 mg,叶酸 folic acid 0.3 mg,生物素 biotin 4.5 mg,烟酸 nicotinic acid 24 mg,D-泛酸D-pantothenic acid 15 mg,胆碱 choline 1 000 mg,Zn 125 mg,Fe 120 mg,Cu 150 mg,I 0.3 mg,Se 0.3 mg。
2)粗蛋白质、总磷、钙为实测值,其余为计算值。CP, total P, Ca were measured values, while others were calculated values.
1.2.3 饲养管理
本试验于2017年11月12日至2017年11月29日在益阳兆丰农牧科技有限公司猪舍进行。试猪单栏饲养,试验期间自由采食与饮水。每天08:00、12:00、16:00、20:00投喂饲粮,第2天投喂前收集剩余饲粮。每天中午通风15 min左右,猪舍温度控制在25~28 ℃,相对湿度50%~70%。
1.2.4 样品采集
血样:试猪在试验的第15天,注射LPS 6 h后,采集前腔静脉血10 mL。血液样品在4 ℃,3 500 r/min离心10 min,收集血清,-20 ℃保存。
黏膜样:试猪在试验的第15天,注射LPS 6 h后,全部仔猪注射50 mg/kg BW的戊巴比妥钠,待完全麻醉后屠宰,屠宰后迅速从胸骨到耻骨切线打开腹腔,取出胃肠道,于空肠、回肠处分别采集约5 cm肠段,用4 ℃预冷1×PBS轻轻漂洗,于冰面上刮取黏膜,分装2管,液氮速冻后于-80 ℃保存。
1.2.5 EGF对LPS刺激的断奶仔猪血清钙、磷含量的测定
血清钙含量的测定采用南京建成生物工程研究所生产的钙测试盒(微板法,货号C004-2)测定。血清磷含量的测定采用南京建成生物工程研究所生产的磷测试盒(磷钼酸法,货号C006)。测定步骤参照相应的试剂盒说明书进行。
1.2.6 EGF对LPS刺激的断奶仔猪血清碱性磷酸酶(ALP)活性的测定
血清ALP活性采用迈瑞全自动生化分析仪(BS-200,深圳迈瑞医疗电子股份有限公司)检测。试剂盒购自深圳迈瑞公司,测定步骤参照说明书进行。
1.2.7 肠黏膜NaPi-ⅡbmRNA表达的测定
采用qRT-PCR法测定空肠、回肠肠黏膜NaPi-ⅡbmRNA的表达情况。具体操作同1.1.3。
1.3 统计分析
试验结果以“平均值±标准差”(means±SD)表示,采用SPSS 21.0统计软件的一般线性模型(GLM)进行两因素方差分析,模型主效应包括EGF处理、LPS处理以及两者的互作,one-way ANOVA程序进行单因素方差分析,组间差异采用Duncan氏法进行多重比较,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 EGF对LPS刺激的IPEC-J2细胞NaPi-Ⅱb mRNA表达的影响
由图1可知,与对照组相比,EGF组细胞NaPi-ⅡbmRNA表达显著下降(P<0.05),EGF+LPS组细胞NaPi-ⅡbmRNA表达显著提高(P<0.05)。与EGF组相比,EGF+LPS组细胞NaPi-ⅡbmRNA表达显著提高(P<0.05)。与LPS组相比,EGF+LPS组细胞NaPi-ⅡbmRNA表达显著提高(P<0.05)。EGF与LPS免疫应激的互作效应对NaPi-ⅡbmRNA表达影响显著(P<0.05)。结果表明,EGF抑制细胞NaPi-ⅡbmRNA的表达,但在应激状态下EGF促进细胞NaPi-ⅡbmRNA的表达。

不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05),图2、图3同。
Values with different small letters mean significant difference (P<0.05), while with the same letter mean no significant difference (P>0.05). The same as Fig.2 and Fig.3.
图1EGF对LPS刺激的IPEC-J2细胞NaPi-ⅡbmRNA表达的影响
Fig.1 Effects of EGF onNaPi-ⅡbmRNA expression in IPEC-J2 cells challenged by LPS
2.2 EGF对LPS刺激的IPEC-J2细胞NaPi-Ⅱb蛋白表达的影响
由图2可知,与对照组相比,EGF组细胞NaPi-Ⅱb蛋白表达显著下降(P<0.05),EGF+LPS组细胞NaPi-Ⅱb蛋白表达显著提高(P<0.05)。与EGF组相比,EGF+LPS组细胞NaPi-Ⅱb蛋白表达显著提高(P<0.05)。与LPS组相比,EGF+LPS组细胞NaPi-Ⅱb蛋白表达显著提高(P<0.05)。EGF与LPS免疫应激的互作效应对NaPi-Ⅱb蛋白表达影响显著(P<0.05)。Western blot结果同样表明,EGF抑制细胞NaPi-Ⅱb蛋白表达,但在应激状态下EGF促进细胞NaPi-Ⅱb蛋白的表达。
2.3 EGF对LPS刺激的断奶仔猪血清钙、磷含量和ALP活性的影响
由表2可知,各组间血清钙含量无显著差异(P>0.05);EGF与LPS免疫应激互作效应对血清钙含量无显著影响(P>0.05)。LPS组血清磷含量显著高于对照组、EGF组、EGF+LPS组(P<0.05),且EGF与LPS免疫应激互作效应对血清磷含量影响显著(P<0.05);EGF组血清ALP活性显著高于LPS组(P<0.05),与对照组、EGF+LPS组差异不显著(P>0.05),EGF与LPS免疫应激互作效应对血清ALP活性无显著影响(P>0.05)。
2.4 EGF对LPS刺激的断奶仔猪小肠黏膜NaPi-Ⅱb mRNA表达的影响
由图3可知,与对照组相比,EGF组空肠(图3-A)、回肠(图3-B)黏膜NaPi-ⅡbmRNA的表达均显著降低(P<0.05),EGF+LPS组空肠(图3-A)、回肠(图3-B)黏膜NaPi-ⅡbmRNA的表达均显著增加(P<0.05)。与LPS组相比,EGF组空肠(图3-A)、回肠(图3-B)黏膜NaPi-ⅡbmRNA的表达均显著降低(P<0.05),EGF+LPS组空肠(图3-A)、回肠(图3-B)黏膜NaPi-ⅡbmRNA的表达均显著增加(P<0.05)。与EGF组相比,EGF+LPS组空肠(图3-A)、回肠(图3-B)黏膜NaPi-ⅡbmRNA的表达均显著增加(P<0.05)。EGF与LPS免疫应激互作效应对空肠与回肠NaPi-ⅡbmRNA的表达影响显著(P<0.05)。动物试验结果表明,EGF抑制小肠黏膜NaPi-ⅡbmRNA表达,但在应激状态下促进小肠黏膜NaPi-ⅡbmRNA表达。
3 讨 论
磷是动物必需的矿物质元素之一,在动物生长发育、骨骼形成、能量代谢、核酸合成、细胞信号转导以及维持血液酸碱平衡中起着重要作用[1,3,13]。血清碱性磷酸酶是反映动物机体钙磷代谢状况的血清生化指标,当机体缺乏钙磷时,碱性磷酸酶释放增加。本研究结果表明,EGF对LPS刺激的仔猪血清钙含量无显著影响,但对血清磷含量影响显著。EGF组血清ALP活性显著高于LPS组,但饲粮EGF与LPS免疫应激互作效应对血清碱性磷酸酶活性无显著影响。LPS是革兰氏阴性菌细胞壁破裂后释放的毒性物质,是导致急性肾损伤的主要因素之一[14]。本研究中LPS组血清磷含量显著高于其他组,可能是LPS刺激导致了仔猪肾脏功能损伤,影响肾脏对磷的重吸收,从而导致血清磷含量异常升高。
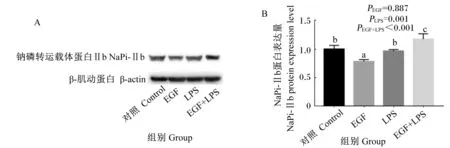
A: Western blot电泳图;B:NaPi-Ⅱb蛋白表达量。
A: Western blot electrophoretogram; B: NaPi-Ⅱb protein expression level.
图2 EGF对LPS诱导的IPEC-J2细胞NaPi-Ⅱb蛋白表达影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同字母或无字母表示差异不显著(P>0.05)。
Values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05).
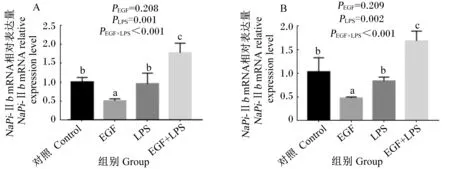
A:空肠NaPi-ⅡbmRNA相对表达量;B:回肠NaPi-ⅡbmRNA相对表达量。
A:NaPi-ⅡbmRNA relative expression level in the jejunum; B:NaPi-ⅡbmRNA relative expression level in the ileum.
图3EGF对LPS刺激的断奶仔猪小肠黏膜NaPi-ⅡbmRNA表达影响
Fig.3 Effects of EGF onNaPi-ⅡbmRNA expression in the small intestinal mucosa of weaned piglets challenged by LPS
肠道磷的吸收主要有被动扩散和主动吸收2种方式,NaPi-Ⅱb是调节肠道磷主动转运的主要载体[3-5],介导机体70%~90%磷的主动转运[15-16]。NaPi-Ⅱb的调控受许多因素的影响,如磷[1]、维生素D3[17]、雌二醇[2]、神经肽Y[4]、降钙素基因相关肽、EGF[5-8]等。EGF是一种含有53个氨基酸残基的小肽,其生物学功能的发挥是通过与其表皮生长因子受体(EGFR)结合后实现的[9]。EGFR广泛存在于小肠刷状缘顶端及基底侧,当动物摄取的EGF递送到小肠黏膜后与EGFR结合,形成二聚物,激活酪氨酸激酶(RTK)活性,促进RTK自我磷酸化,随后激活Ras/丝裂原活化蛋白激酶(Ras/MAPK)、磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)、磷脂酶C-γ/蛋白激酶C(PLC-γ/PKC)等一系列的信号通路,对细胞生存、增殖与分化、迁移、凋亡等具有重要作用[9-11,18]。前人在人Caco2细胞中的研究表明,EGF通过修饰c-myb蛋白,经蛋白激酶C/蛋白激酶A(PKC/PKA)和MAPK信号通路调节下游启动子功能,从而抑制细胞NaPi-Ⅱb的转录活性,降低其表达量[5-6]。本课题组在猪IPEC-J2细胞中同样发现EGF抑制了细胞中NaPi-Ⅱb的表达,进一步研究发现EGF作用NaPi-Ⅱb启动子区域位于-1 092~-1 085 bp区域(5′-TCCAGTTG-3′),且EGF通过激活EGFR、PKA、PKC、P38、细胞外信号调节激酶(ERK)、氨基末端激酶(JNK)等信号分子来下调IPEC-J2细胞中NaPi-Ⅱb的表达[7-8]。Tang等[11]研究表明,一定浓度的EGF可促进IPEC-J2细胞增殖,而细胞增殖过程中需要大量的磷用来合成RNA及DNA,说明EGF可促进磷的吸收,但不是通过NaPi-Ⅱb介导的磷的主动吸收,可能存在其他途径介导磷的吸收。
应激是动物生产过程中的普遍现象,可导致动物肠道损伤,影响生产成绩。LPS对小肠上皮细胞具有毒害作用,能刺激猪小肠上皮细胞分泌大量白介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)等促炎细胞因子,最终导致炎症的发生[19-21]。Tang等[11]研究表明,LPS刺激诱导了细胞氧化应激及细胞凋亡的发生,而EGF可通过缓解氧化应激减少细胞凋亡来保护LPS刺激的肠上皮细胞损伤。理论上讲,在EGF对受损肠细胞修复过程中,必然伴随大量DNA、RNA和蛋白质的合成,其前提需要经肠道吸收更多的磷,此过程中EGF是否解除对NaPi-Ⅱb表达的抑制作用,从而促进磷的主动吸收,以满足机体对磷的需要,还未见报道。因此,本研究采用细胞试验与动物试验相结合的方法研究EGF对应激状态下(LPS刺激)猪小肠磷吸收的影响,结果表明,EGF抑制IPEC-J2细胞的NaPi-ⅡbmRNA及蛋白的表达,抑制仔猪空肠与回肠黏膜NaPi-ⅡbmRNA的表达,这与Xu等[4-5]、Xing等[6]、邢廷杰等[7]研究结果一致,而EGF可促进LPS刺激的IPEC-J2细胞NaPi-ⅡbmRNA及蛋白的表达,促进LPS刺激的断奶仔猪空肠与回肠黏膜NaPi-ⅡbmRNA的表达,说明在非应激状态下EGF抑制NaPi-Ⅱb介导的磷的主动转运,在应激状态下,EGF可解除对NaPi-Ⅱb的抑制,调控NaPi-Ⅱb介导的磷的主动吸收,以满足机体对磷的需要,加快肠道修复进程。前人研究表明,EGF对断奶仔猪的生长及肠道发育具有促进作用[22-23],说明EGF是促进磷吸收,但不是通过NaPi-Ⅱb介导的磷的主动吸收。机体磷稳态的维持是通过肠道磷吸收与肾脏磷重吸收实现的[24]。肠道磷吸收有被动扩散和主动转运,除了NaPi-Ⅱb介导的主动转运,Ⅲ型钠离子依赖转运载体蛋白(type Ⅲ transporters PiT1 and PiT2)也能介导部分磷的主动吸收[25],肾脏重吸收主要由NaPi-Ⅱa与NaPi-Ⅱc 2种蛋白介导,当肠道磷吸收不足时,肾脏磷重吸收加强,从而满足机体磷的需要[26]。因此,本研究中EGF可能通过增强肠道磷的被动扩散吸收,或通过增强PiT1和PiT2介导的磷主动转运,或通过加强肾脏重吸收满足机体磷的需要,但具体通过何种途径调节磷的吸收还需进一步的研究。应激条件下EGF如何解除对NaPi-Ⅱb的抑制,从而介导磷的主动转运以满足机体需求还需进一步的研究。
4 结 论
EGF对肠道NaPi-Ⅱb的表达起抑制作用,但在免疫应激状态下可促进NaPi-Ⅱb的表达。
