周期性饥饿再投喂对虎斑乌贼幼体生长性能、抗氧化指标、消化酶活性、氨基酸组成和脂肪酸组成的影响
2018-10-17李晨晨朱婷婷罗嘉翔周歧存
李晨晨 朱婷婷 陆 游 罗嘉翔 金 敏 袁 野 周歧存
(宁波大学海洋学院鱼类营养研究室,宁波315211)
虎斑乌贼(Sepiapharaonis)隶属于软体动物门(Mollusca),头足纲(Cephalopoda),乌贼目(Sepiida),乌贼科(Sepiidae),乌贼属(Sepia),个体大,味道鲜美,营养丰富,具有很高的营养价值,是一种养殖前景明朗的头足类生物。在自然环境中,动物常常因为季节、气温、水质、食物在空间上的分布不均等原因而面临饥饿胁迫。在饥饿状态下,许多动物会通过减少代谢率以及消耗自身组织的贮存物质以应对饥饿胁迫[1]。动物通过调节身体内各种酶的活性来达到积极利用体内储存物质的目的,从而维持生命[2]。在应对饥饿胁迫的过程中,氨基酸和脂肪酸的利用顺序也有一定的差别。
动物经饥饿或者营养不足之后再恢复正常摄食时,所表现出来的超过正常生长速度的现象称为补偿生长[3]。水生动物补偿生长的程度会因为种类、生长阶段、饥饿以及恢复投喂时间的不同而有很大的差异[4-6]。根据恢复生长期间试验动物的特定生长率、体质量的变化程度,可将水生动物的补偿生长分为4类:超补偿生长、完全补偿生长、部分补偿生长、不能补偿生长[7]。研究表明,补偿生长可以促进水生动物的生长、提高饲料利用率、降低劳动成本[8-10],减少氮排放量从而降低水体污染[11]。目前国内外相关研究报道主要集中在鱼类[12-14]、甲壳类[15]、双壳类[16],而关于头足类[17]的报道较少。
在研究水生生物补偿生长时,采用不同的饥饿和恢复投喂方式会使得试验结果差异较大[18]。循环饥饿是获得理想补偿生长效果的一种方式[19],它可以降低饲养人员的劳动强度、节约人工成本、缩短饥饿时间。乐可鑫等[3]对虎斑乌贼初孵幼体阶段的补偿生长进行了研究,但对虎斑乌贼幼体阶段多重周期性饥饿胁迫后的补偿生长缺乏深入研究。鉴于此,本试验以虎斑乌贼幼体为研究对象,拟研究不同周期性饥饿再投喂模式对虎斑乌贼生长性能、肌肉常规营养成分、抗氧化指标、消化酶活性、氨基酸组成和脂肪酸组成的影响,探讨其在饥饿胁迫下的生理响应机制,以期为制订适合虎斑乌贼幼体的高效投喂策略提供科学依据。
1 材料与方法
1.1 试验设计
试验用虎斑乌贼幼体为象山来发水产育苗厂提供,试验在浙江省宁波市海洋与科技创新基地完成。虎斑乌贼幼体在试验前用冰鲜虾暂养1周,分组前停食24 h,挑选体格健壮、规格基本一致的个体[初始体重为(6.83±0.01) g]360尾,随机分为4组,即1个对照组和3个周期性饥饿再投喂组(S1F6组、S2F5组和S3F4组),每组3个重复,每个重复30尾,以重复为单位放养于300 L养殖桶中。每天上、下午各换水1次,每次换水量为50%左右。使用经暗沉淀和沙滤后的自然海水,盐度为21.2‰~26.7‰,温度为23.8~27.4 ℃,pH为7.5~8.0;采用自然光照,微流水充气养殖,饵料为小个体的冰鲜虾(冰鲜虾体成分以及氨基酸组成和脂肪酸组成见表1),每天投喂2次,投喂时间分别为07:30与15:30,投喂后1 h内观察其摄食情况。
1.2 试验设计
对照组:持续投喂14 d;S1F6组:饥饿1 d,再投喂6 d,共2个周期;S2F5组:饥饿2 d,再投喂5 d,共2个周期;S3F4组:饥饿3 d,再投喂4 d,共2个周期。试验期为14 d。
表1冰鲜虾体成分(湿重基础)、氨基酸(干重基础)和脂肪酸(占总脂肪酸的百分比)组成

Table 1 Body composition (wet weight basis), amino acid composition (dry weight basis) and fatty acid composition (percentage of total fatty acids) of chilled shrimps %

续表1项目 Items含量 Content氨基酸总量 TAA52.90必需氨基酸总量 TEAA25.59非必需氨基酸总量 TNEAA27.32必需氨基酸总量/氨基酸总量TEAA/TAA0.48脂肪酸 Fatty acid compositionC12∶00.17C14∶011.55C14∶1n0.24C16∶023.14C16∶1n9.84C18∶02.52C18∶1n-918.13C18∶2n-61.92C18∶3n-60.19C18∶3n-30.62C18∶4n-30.93C20∶00.11C20∶1n-91.92C20∶2n-60.06C20∶3n-60.13C20∶4n-60.65C20∶3n-30.06C20∶5n-3 (EPA)15.51C22∶00.20C22∶1n-91.78C22∶5n-60.08C22∶5n-30.41C24∶00.05C22∶6n-3 (DHA)9.76饱和脂肪酸 SFA37.74单不饱和脂肪酸 MUFA31.91多不饱和脂肪酸 PUFA30.32n-3多不饱和脂肪酸n-3 PUFA27.29n-6多不饱和脂肪酸n-6 PUFA3.03n-3/n-69.01DHA/EPA0.63
1.3 样本采集与分析方法
投喂试验结束后,鱼停食24 h,取样前每桶单独称重并计数,计算增重率、特定生长率和存活率;每个养殖桶随机取4尾乌贼,分别剥离肌肉用于肌肉常规成分以及氨基酸与脂肪酸组成的分析,剥离肝脏用于抗氧化指标与消化酶活性的测定以及脂肪酸组成的分析。所有操作均在冰上进行。
饲料、肌肉常规营养成分分析:水分含量测定采用105 ℃常压干燥法;粗灰分含量的测定采用马弗炉550 ℃焚烧失重法;粗蛋白质含量测定使用蛋白质分析仪(LECO FP-528);粗脂肪含量测定使用脂肪测定仪(SX360)。
氨基酸组成测定:在样品中加入6 mol/L盐酸沙浴24 h后,用50 mL容量瓶定容并吸取1 mL溶液进行旋转蒸发,将旋转蒸发后的样品加入0.02 mol/L的盐酸后使用高速氨基酸自动分析仪(L-8900,HITACHI公司,日本)测定氨基酸组成。
脂肪酸组成测定:饲料、肝脏及肌肉样品经过48 h冷冻干燥后,在盐酸-甲醇溶液和氢氧化钾-甲醇溶液中抽提脂肪进行前处理后,送往中国科学院宁波材料技术与工程研究所测定中心,使用气相-质谱仪(GCMS-QP2010 Plus,SHIMADZU公司,日本)测定脂肪酸组成。
抗氧化指标测定:先准确称取一定重量的待测组织,按重量(g)∶体积(mL)=1∶9的比例加入9倍体积的生理盐水,冰水浴条件机械匀浆,2 500 r/min离心10 min,取上清液于-80 ℃保存,待测。超氧化物歧化酶、谷胱甘肽过氧化物酶活性及还原型谷胱甘肽、丙二醛含量均采用南京建成生物工程研究所生产的相关试剂盒测定,相应操作均参照说明书进行。
消化酶活性测定:待测组织的前处理与抗氧化指标测定时的前处理方法一致。脂肪酶、淀粉酶活性均采用南京建成生物工程研究所生产的相关试剂盒测定,相应操作均参照说明书进行。
1.4 计算公式
增重率(%)=100×(终末均重-初始均重)/初始均重;特定生长率(%/d)=100×(ln终末体重-ln初始体重)/饲养天数;存活率(%)=100×(终末尾数-初始尾数)/初始尾数。
1.5 数据处理与分析
数据均以平均值±标准误(mean±SE)表示。用SPSS 19.0软件对所有数据进行单因素方差分析(one-way ANOVA),当组间有差异显著时,进行Tukey’s多重比较,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 周期性饥饿再投喂对虎斑乌贼幼体生长性能的影响
由表2可知,饥饿时间对增重率、特定生长率及存活率均有显著影响(P<0.05)。S3F4组的增重率、特定生长率及存活率均显著低于对照组(P<0.05),而S1F6组和S2F5组与对照组相比则无显著差异(P>0.05)。
2.2 周期性饥饿再投喂对虎斑乌贼幼体肌肉常规营养成分的影响
由表3可知,3个周期性饥饿再投喂组虎斑乌贼幼体水分、粗蛋白质、粗脂肪与对照组相比均无显著性差异(P>0.05)。
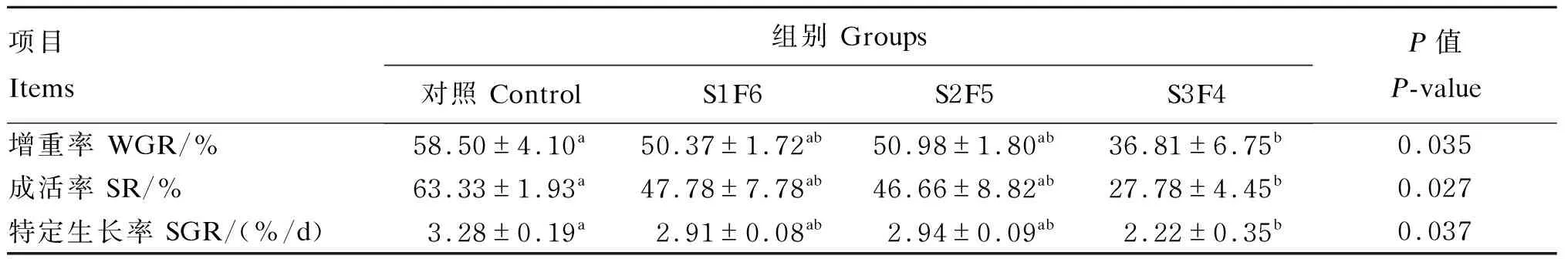
表2 周期性饥饿再投喂对虎斑乌贼幼体生长性能的影响
同行数据肩标无字母或有相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.

表3 周期性饥饿再投喂对虎斑乌贼幼体肌肉常规营养成分的影响(湿重基础)
2.3 周期性饥饿再投喂对虎斑乌贼幼体肝脏抗氧化指标的影响
由表4可知,不同饥饿时间对肝脏超氧化物歧化酶活性有显著影响(P<0.05)。随饥饿时间的延长,肝脏超氧化物歧化酶活性呈先降低后升高再降低的趋势,在S2F5组达到最大值。不同饥饿时间对肝脏对丙二醛和还原型谷胱甘肽含量以及谷胱甘肽过氧化物酶活性均无显著影响(P>0.05)。
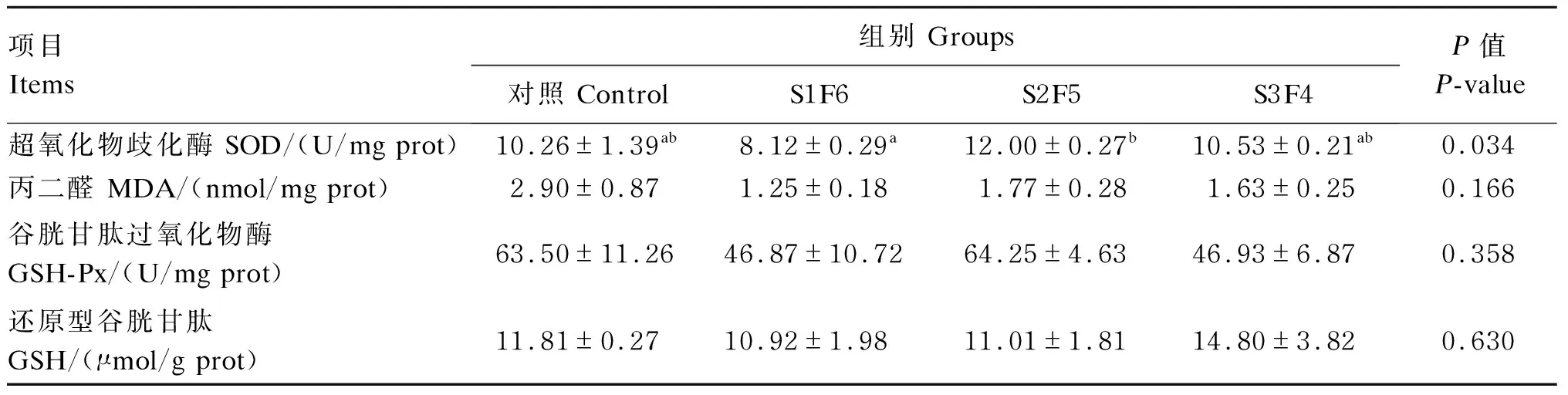
表4 周期性饥饿再投喂对虎斑乌贼幼体肝脏抗氧化指标的影响
2.4 周期性饥饿再投喂对虎斑乌贼幼体肝脏消化酶活性的影响
由表5可知,不同饥饿时间对肝脏淀粉酶和脂肪酶的活性有显著影响(P<0.05)。随着饥饿时间的延长,肝脏淀粉酶活性先下降后升高,在S1F6组有最小值,在S3F4组有最大值,这2组间差异显著(P<0.05);肝脏脂肪酶活性则先升高后降低再升高,在S2F5组有最小值,显著低于其他各组(P<0.05),在S1F6组有最大值,显著高于S2F5组和S3F4组(P<0.05)。

表5 周期性饥饿再投喂对虎斑乌贼幼体肝脏消化酶活性的影响
2.5 周期性饥饿再投喂对虎斑乌贼幼体肌肉氨基酸组成的影响
由表6可知,在虎斑乌贼幼体的肌肉组织中共检测出17种氨基酸,其中必需氨基酸有10种,非必需氨基酸有7种。经分析发现,10种必需氨基酸、7种非必需氨基酸的含量以及氨基酸总量、必需氨基酸总量、必需氨基酸总量/氨基酸总量各组间均差异不显著(P>0.05)。

表6 周期性饥饿再投喂对虎斑乌贼幼体肌肉氨基酸组成的影响(干物质基础)
2.6 周期性饥饿再投喂对虎斑乌贼幼体肝脏和肌肉脂肪酸组成的影响
由表7可知,在虎斑乌贼幼体肝脏组织中共检测出24种脂肪酸,起始碳链长度在12~24,其中饱和脂肪酸7种,单不饱和脂肪酸5种,多不饱和脂肪酸12种。肝脏单不饱和脂肪酸、多不饱和脂肪酸、饱和脂肪酸、n-6多不饱和脂肪酸含量各组间均无显著差异(P>0.05)。肝脏C22∶5n-3(DPA)、C22∶6n-3(DHA)含量在各组间无显著差异(P>0.05),但3个周期性饥饿再投喂组的肝脏C20∶5n-3(EPA)含量与对照组相比均出现了一定程度的降低,其中S1F6组和S2F5组与对照组的差异不显著(P>0.05),S3F4组则显著低于对照组(P<0.05)。3个周期性饥饿再投喂组的肝脏n-3多不饱和脂肪酸含量均较对照组出现了一定程度的降低,其中S3F4组与对照组的差异达到显著水平(P<0.05)。
由表8可知,在虎斑乌贼幼体肌肉组织中共检测出18种脂肪酸,起始碳链长度在12~22,其中饱和脂肪酸4种,单不饱和脂肪酸4种,多不饱和脂肪酸10种。肌肉饱和脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸、n-3多不饱和脂肪酸各组间均无显著差异(P>0.05),肌肉EPA、DPA、DHA含量各组间也无显著差异(P>0.05)。3个周期性饥饿再投喂组的肌肉n-6多不饱和脂肪酸含量与对照组均无显著差异(P>0.05),但S1F6组显著高于S2F5组(P<0.05)。

表7 周期性饥饿再投喂对虎斑乌贼幼体肝脏脂肪酸的影响(占总脂肪酸的百分比)

续表7脂肪酸 Fatty acids组别 Groups对照 ControlS1F6S2F5S3F4P值P-value多不饱和脂肪酸 PUFA34.21±0.8226.86±1.5830.77±3.6125.51±1.460.074n-3多不饱和脂肪酸n-3 PUFA30.43±0.93a23.15±1.33ab26.85±3.34ab21.39±1.37b0.048n-6多不饱和脂肪酸n-6 PUFA3.77±0.123.71±0.253.92±0.274.12±0.200.578

表8 周期性饥饿再投喂对虎斑乌贼幼体肌肉脂肪酸组成的影响(占总脂肪酸的百分比)
3 讨 论
3.1 周期性饥饿再投喂对虎斑乌贼幼体生长性能的影响
饥饿会影响水生动物的行为、存活、生长、代谢等一系列生理变化,饥饿胁迫后恢复投喂的水生动物会出现不能补偿生长、部分补偿生长、完全补偿生长、超补偿生长等响应状态[20]。Ribeiro等[21]认为摄食率和饲料转化率、蛋白质合成率及能量储备是反映试验动物是否出现补偿生长的衡量指标。张涛等[22]考虑到曼氏无针乌贼在受到饥饿胁迫时发生互相残杀的现象,在研究曼氏无针乌贼的周期性饥饿投喂模式时,将增重率与成活率作为衡量指标。阿荣等[23]在研究大菱鲆的补偿生长时,将体质量变化率以及特定生长率作为衡量标准。在综合前人试验的基础上,本试验将增重率、特定生长率及存活率作为衡量标准,结果表明,在饥饿与投喂总时间相等的情况下,不同饥饿时间对增重率、存活率、特定生长率均有显著影响。S1F6组和S2F5组与对照组相比存活率则有下降趋势,这可能是因为饥饿胁迫因子会影响虎斑乌贼幼体消化酶活性,进而影响其存活率,而增重率与特定生长率变化不显著,表明S1F6组与S2F5组虎斑乌贼幼体出现了补偿生长,与阿荣等[23]在大菱鲆幼鱼补偿生长研究中得到的结果相似。S3F4组增重率、存活率及特定生长率均显著低于饥饿时间较短的S1F6组、S2F5组及对照组,表明在饥饿3 d再投喂4 d的模式下,虎斑乌贼幼体不能出现补偿生长,说明饥饿时间过长可能不能出现补偿生长,不利于虎斑乌贼的产业化养殖。在本试验中虎斑乌贼幼体各组的存活率均较低,尤其S3F4组,该组的存活率与对照组相比出现了显著降低,这可能是因为在养殖过程中虎斑乌贼幼体由于饥饿胁迫而出现了自相残杀的现象。从节约劳动成本、提高饲料利用率以及减少水体环境污染的角度来看,虎斑乌贼幼体的最佳投喂模式为周期性饥饿2 d再投喂5 d。
3.2 周期性饥饿再投喂对虎斑乌贼幼体肌肉常规营养成分的影响
脂肪、糖类以及蛋白质是水生动物维持生命活动的主要储能物质,在饥饿期间,水生动物会消耗体内的储能物质,从而达到一种动态平衡。不同水生动物在饥饿期间对储能物质的利用不同[24],林小涛等[25]研究发现南美白对虾主要利用脂肪作为能量来源,沈文英等[26]研究发现草鱼能较好的利用糖类作为能量来源,Mehner等[27]研究发现河鲈主要利用蛋白质作为能量来源。本试验结果显示,3个周期性饥饿再投喂组虎斑乌贼幼体的肌肉水分、粗蛋白质、粗脂肪含量与对照组相比无显著差异,表明经补偿生长后,水分、粗蛋白质、粗脂肪在短期内均能恢复至对照组水平,周期性饥饿再投喂不会影响虎斑乌贼幼体的营养品质。
3.3 周期性饥饿再投喂对虎斑乌贼肝脏抗氧化指标的影响
3.4 周期性饥饿再投喂对虎斑乌贼肝脏消化酶活性的影响
在饥饿胁迫条件下,水生动物通过调节消化酶活性积极利用体内储能物质,从而维持机体生命[33-35]。目前,有关于饥饿胁迫引起消化酶活性下降的原因主要是因为食物会通过嗅觉、视觉等影响中枢神经对消化腺的分泌支配,而在饥饿胁迫下缺乏这些刺激[36-37]。饥饿会引起消化器官的实质性变化,如肝胰腺萎缩等,进而降低消化酶的分泌[38]。本试验结果表明,虎斑乌贼幼体肝脏中淀粉酶与脂肪酶活性在S2F5组均处于较低水平,这与乐可鑫等[3]所得到的结果类似。这表明,虎斑乌贼幼体在饥饿初期由于脂肪的匮乏,降低了肝脏脂肪酶的分泌以增强其适应性,而在饥饿3 d时,虎斑乌贼幼体对饥饿胁迫已具有一定适应性,从而肝脏脂肪酶活性又有一定升高。这与肌肉粗脂肪含量随着饥饿时间的延长呈先升高后降低的趋势相吻合。虎斑乌贼为肉食性动物,对碳水化合物的利用率较低,因此其淀粉酶的活性较低。在饥饿初期,由于食物的匮乏,肝脏淀粉酶的活性也随之降低,而在S3F4组肝脏淀粉酶的活性却出现升高,这可能是因为肝脏加大了对体内肌糖原与肝糖原的利用,以满足代谢活动的需要。
3.5 周期性饥饿再投喂对虎斑乌贼肌肉氨基酸组成的影响

3.6 周期性饥饿再投喂对虎斑乌贼肝脏和肌肉脂肪酸组成的影响
在饥饿胁迫下,水生动物对体内的不同种类的脂肪酸有着一定的利用顺序,首先是饱和脂肪酸,其次是低不饱和脂肪酸,最后是高不饱和脂肪酸[42]。本试验研究了周期性饥饿再投喂对虎斑乌贼幼体肝脏与肌肉中脂肪酸组成的影响,结果显示,3个周期性饥饿再投喂组肝脏和肌肉饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸的含量与对照组无显著性差异。从3种脂肪酸含量的总变化来看,在虎斑乌贼幼体肌肉组织中,首先被利用的是饱和脂肪酸,随饥饿时间延长,单不饱和脂肪酸和多不饱和脂肪酸交替被利用。而在虎斑乌贼幼体肝脏中,最先被利用的是多不饱和脂肪酸,随饥饿时间的延长,饱和脂肪酸和单不饱和脂肪酸变交替被利用。这表明在虎斑乌贼幼体不同组织中,不同种类脂肪酸的被利用顺序也不尽相同。
EPA与DHA是人体必需的高度不饱和脂肪酸,且哺乳动物自身不能合成。一般海水鱼中的EPA与DHA含量要高于淡水鱼[43]。EPA、DHA、DPA均属于n-3多不饱和脂肪酸,是海洋生物里的重要营养成分。EPA在免疫和炎症反应上起着至关重要的作用,DHA对神经功能发挥重要作用,且为视网膜正常发育以及发挥正常功能不可或缺的成分[43],DPA具有很强的抑制血小板凝集,促进牛主动脉内皮细胞迁移[44-45],可用于治疗高甘油三酯血症等[46]。3种周期性饥饿再投喂模式下,虎斑乌贼幼体肌肉中EPA、DHA和DPA的含量与对照组相比均无显著差异,而在肝脏中,虎斑乌贼幼体的EPA含量在S1F6组和S2F5组与对照组相比差异不显著,但S3F4组则显著低于对照组,但是肝脏DHA和DPA含量3个周期性饥饿再投喂组与对照组相比均无显著差异。这表明,在饥饿1 d再投喂6 d和饥饿2 d再投喂5 d投喂模式下,饥饿胁迫没有对虎斑乌贼幼体中的重要营养成分产生显著影响,但在饥饿3 d再投喂4 d投喂模式下,饥饿胁迫会造成虎斑乌贼幼体的营养成分缺失。
4 结 论
① 综上所述,S1F6组与S2F5组的虎斑乌贼幼体均出现了补偿生长,且肌肉常规营养成分没有发生显著变化。
② 从节约成本、减少污染以及补充生长等方面综合来看,建议在虎斑乌贼幼体的养殖过程中采用周期性饥饿2 d再投喂5 d的投喂模式。
