好氧砷还原菌对砷与铁还原释放的影响
2018-10-17
(湖南师范大学 湖南 长沙 410006)
As是一种类金属,自然界中的As有存在着很多不同的化学形态,它在环境中的赋存形态及其迁移转化过程很大程度上决定了其毒性[1]。环境中的无机砷的主要存在形式包括+3价的亚砷酸盐和+5价的砷酸盐[2],As(III)的毒性和迁移性高于As(V)。As(V)能稳定存在于土壤中,它在土壤的各种吸附过程中能与矿物组分共沉淀,与As(V)不同的是As(III)则不易在土壤介质中形成沉淀[3]。微生物在砷的形态转化过程中扮演着重要角色,也在砷的地球化学过程中起到关键性作用[3-4]。在好氧条件下,34微生物通过细胞内As(V)还原酶arsC将As(V)还原为As(III),再由As(III)运载蛋白arsB/acr3将其排出体外[5]。这类通过解毒机制进行砷还原的微生物叫做细胞质As(V)还原微生物。这类微生物能将易吸附于钙、铁、铝等矿物质上的As(V)还原为移动性和毒性更强的As(III),是好氧环境中参与砷活化和释放的重要微生物类群[6-7]。
As和Fe的相互作用对As在环境中的行为具有重要意义。在自然环境中,主要有两类矿物会富集As:一类是硫化物矿物,还有一类是铁氧化物矿物[8]。由于铁氧化物矿物具有对As有较高的亲和力,Fe元素和As素也是相互影响,相互作用,因而吸附了As的铁氧化物常常被用来用于实验研究。探讨还原菌体、含Fe矿物参与的As迁移转化过程有助于理解环境中As、Fe、微生物三者共同参与下的循环过程,也能帮助我们更好地理解As和Fe的地球化学作用[9]。
目前,很多研究主要是关于厌氧微生物对As(V)迁移转化影响[10-11],而在实际土壤环境中,土壤表层含氧量较高,存在有很多好氧微生物[12],而关于这些好氧微生物(如好氧As(V)还原菌)对As(V)的迁移转化研究很少。另一方面,不少的研究采用的是模拟体系,如用石英砂来模拟实际土壤环境,而对于实际土壤环境中As在微生物作用下的迁移转化的研究有限,因此,本实验是探究在好氧条件下As(V)还原菌对铁氧化物吸附态As(V)及土壤中结合态As(V)的迁移转化的影响[13],研究石门雄黄矿区高As壤中耐As土著微生物的生长化学特征、土著微生物对不同价态As的氧化还原作用,是为了让我们更好的理解耐As土著微生物在As的迁移转化中所起的作用,也为了让我们更好的研究高As土壤的As释放过程,同时对丰富As的迁移转化过程提供了参考价值
一、实验材料与方法
(一)样品来源
供试土壤为取自湖南石门县雄黄矿区As污染土,采样点是矿区小门卫前地块。土样采集后经风干、研磨后4℃冰箱保存备用.土壤基本元素含量用北京海光仪器LC-AFS 6000测定了采样点的土壤总As含量,其余元素使用原子吸收光谱仪(Agilent 240 AA)测定。
水铁矿的制备是根据Schwertmann提出的方法制备[14]。
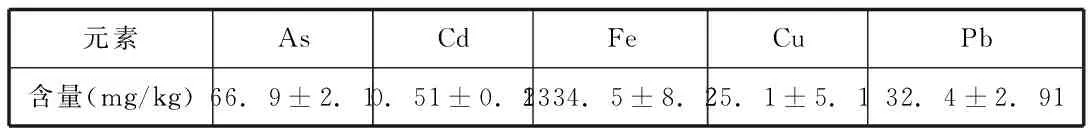
表1 土壤基本元素含量表
(二)培养基的制备
分离菌株采用LB培养基:5g L-1酵母膏,10g L-1胰蛋白胨,10g L-1Na Cl,PH为7.4,培养基中加入固体Na2HAsO4·7H2O使得溶液中As(V)的总浓度为200 mg L-1。
固体培养基需在此基础上加入20g琼脂粉即可。
二、
(一)实验方法
1.好氧As(V)还原菌的分离与鉴定
在富集耐As(V)微生物的土样中取1g新鲜土壤放置于100m L无菌锥形瓶中(高压灭菌),加入30ml 200 mg/L无菌As(V)溶液,置于30 ℃,200 r/min摇床中振荡24 h后,取上清液按10-2-10-5梯度稀释涂布于LB平板。平板置于30 ℃恒温培养箱内培养2天,挑取单菌落,反复于平板上划线纯化至获得耐As(V)纯菌。将纯菌株放于4 ℃冰箱保存以备后续实验使用。将得到的耐As(V)菌接种到200 mg/L As(V)浓度的液体培养基过夜培养,培养条件为200r/min,30℃摇床培养。取菌液过0.22 μm微孔滤膜,上级检测As形态,所用仪器为原子荧光-高效液相色谱联用仪(北京海光仪器LC-AFS 6000),将出现一定浓度As(III)的菌株进行标记,筛选出5株具有较强As(V)还原能力的菌株用于后续实验。
实验采用16S r RNA基因序列分析法,鉴定所分离出的As(V)还原菌株。具体方法为:采用FastDNA® Spin Kit for Soil(土壤基因组DNA提取试剂盒)提取分离得到的纯菌株的DNA,并以其DNA为模版对菌株的16S r RNA基因进行PCR扩增,PCR扩增后使用0.8%琼脂糖凝胶电泳检测PCR产物,随后进行PCR产物的纯化与16S r RNA基因测序(湖南擎科)。
2.好氧As(V)还原菌体内的As(V)还原酶基因扩增分析
该实验以分离得到的纯菌株经过提取后的DNA为模版,以引物P52F和P323R对As(V)还原酶基因arsC进行PCR扩增,扩增引物为P52F和P323R[15]。
3.好氧As(V)还原菌的耐As能力分析
实验中采用LB培养基,As(V)浓度As(V)为分别为200 mg/L和2 mg/L,研究五株As(V)还原菌SM4,SM9,SM12,SM14,SM15分别在200 mg/L和2 mg/L As(V)溶液中的生长情况。设置空白对照组(不加微生物),实验组菌液与培养基比例为1 m L:50 m L,空白组用无菌超纯水取代菌液,反应条件均为30℃,200 rpm 振荡培养。设置时间梯度为4h,6h,14h,16h,18h,20h。在不同时间段测定OD600值(紫外可见分光光度计,上海精科752N)[16]。
(1)好氧As(V)还原菌对液相As(V)的还原转化
实验中采用LB培养基,As(V)浓度为200 mg/L,设置空白对照组(不加微生物),实验组菌液与培养基为1 m L:50 m L,空白组用无菌超纯水取代菌液。反应条件均为30℃,200 rpm振荡培养24h。将样品过0.22μm微孔滤膜,用北京海光仪器LC-AFS6000测定As形态。
(2)好氧As(V)还原菌对水铁矿吸附态As(V)和Fe(Ⅲ)的转化
在前面的液相实验中,五株菌株都具有较强的As(V)还原能力,从中选取了一株具代表性的菌株,即SM14,进行接下来的水铁矿吸附态As(V)的转化实验。
实验过程为1ml培养液离心(15000g,10min),得到沉淀用灭菌的0.8%的Na Cl溶液清洗,再溶到1mL Na Cl溶液中得到1ml细胞悬浮液,加到19ml无菌水中,后加入0.05g吸附As(V)后的水铁矿。实验设置两个对照,一个为不加水Fe(Ⅲ)矿的阴性对照,另一个为不接种As(V)还原菌的空白对照。空白组用无菌超纯水取代菌液。反应条件均为30℃,200 rpm振荡培养24h。将样品过0.22μm滤膜,用北京海光仪器LC-AFS6500测定As形态,用紫外可见分光光度计测定Fe形态。
(3)好氧As(V)还原菌对As污染土壤中的As(V)和Fe(Ⅲ)转化
将石门取回的新鲜土壤反复三次高压灭菌,取1g灭菌土与19ml灭菌水制成土壤悬浮液。1ml培养液离心(15000g,10min),得到沉淀用灭菌的0.8%的Na Cl溶液清洗,再溶到1mlNa Cl溶液中得到1ml细胞悬浮液,加到19 ml的土壤悬浮液中,空白组用无菌超纯水取代菌液,30℃,200 rpm振荡培养,培养一定间隔时间取样测定As形态和Fe形态。另取一份相同土壤经过同样处理静置培养7天。将样品过0.22μm滤膜,用北京海光仪器LC-AFS6000测定As(V)形态,用紫外可见分光光度计测定Fe形态。

图2-2 包含菌株SM4,SM9,SM12,SM14,SM15在内的系统发育树
(二)结果与讨论
1.好氧As(V)还原菌的鉴定结果
将测序结果用BLAST数据库(https://www.ncbi.nlm.nih.gov/)进行对比鉴定。经比对鉴定,分离出五株As(V)还原菌株,它们都属于芽孢杆菌属,与Bacillus序列相似度达99%,分别命名为SM4,SM9,SM12,SM14,SM15。得到的对应的NCBI数据库编号分别为1937185,1937190,1937193,1937196,1937199。类似地,陈倩等人用琼脂平板培养法从湖南石门县雄黄矿区土壤中筛选出43株耐As(V)细菌。其中27.91%属于芽孢杆菌属Bacillus sp.[17]。
测序结果经过软件Contig Express拼接之后得到拼接序列,Crustal X软件align之后,用Mega软件构建出系统发育树,采用方法为neighbor-joining方法,步点值(Boot straps)为1000。该发育树结果表明得到的五株好氧As(V)还原菌株SM 4,SM 9,SM 12,SM 14,SM 15与芽孢杆菌属的关系最近,但分属于不同的种。
2.好氧As(V)还原菌体内的As(V)还原酶基因的鉴定
将测序结果用BLAST数据库(https://www.ncbi.nlm.nih.gov/)进行对比鉴定。经比对鉴定,五株As(V)还原菌内均有As(V)还原酶基因,且该还原酶基因属于arsC基因。很多研究表明和Bacillus sp.具有As(V)操纵子arsC,这一基因编码了As(V)还原酶,在As(V)到As(III)的生物转化过程中具有重要作用[18]。这与我们的实验结果也是一致的,实验中我们检测到了arsC编码基因的存在,片段大小为275bp左右。
3.好氧性As(V)还原菌的耐As能力分析
图2-3(左)给出了菌株在As(V)浓度为200 mg/L的溶液中菌株的生长情况,CK为无接种微生物对照。由图可以看出,菌株SM 12,SM 15大致在10 h后开始对数生长期并在14 h时达到最大生长量,菌株SM 4,SM 9,SM 14大致在14 h后开始对数生长期SM 14在18 h达到最大生长量,SM 4,SM 9在20 h达到最大生长量。而CK检测不到菌株的生长。图2-3(右)给出了菌株在As(V)浓度为2 mg/L的溶液中菌株的生长情况。同样地CK为无接种微生物对照。由图可以看出,五株菌株在6 h后开始对数生长期并在10 h时左右达到最大生长量,说明高As(V)浓度下菌株生长比低As(V)浓度情况下缓慢,但24 h后不同As浓度胁迫下菌株的生长量基本持平,无显著差异。

图2-3 200mg/L(左)和2 mg/L(右)As(V)溶液体系中CK以及菌株SM 4,SM 9,SM 12,SM 14,SM 15的生长情况
Figure2-3ThegrowthofCKandstrainSM4,SM9,SM12,SM14,SM15in200mg/Land2mg/LAs(V)solutionsystem
(1)好氧As(V)还原菌对液相As(V)的转化
如图3-2所示,实验结果表明,五株菌株均可以在200 mg/L As(V)溶液中生长,并且都能将As(V)还原成As(III)。随着培养时间的增加,As(V)浓度慢慢降低,As(III)浓度慢慢升高,并且菌株的生长量是跟其还原量同步的,在菌株大量增长的对数生长期,其As(V)还原速率也是最快的。五株菌株基本能够在24h内将200 mg/L As(V)完全还原As(III)。其中10-20h是一个快速还原时期,这可能是由于菌株逐渐达到了较大生长量,还原能力不断增强,此结果与图2-2表现出的菌株生长规律一致。五株菌株SM4,SM9,SM12,SM14,SM15的As(V)还原量相差无几,都能达到200 mg/L,但是达到最大还原量所需的时间分别是18h,24h,16h,20h,24h,显然菌株SM12的还原速率最快。As(III)的最大值低于起始的200 mg/L As(V)浓度值可能是因为部分As(III)存在于菌株的细胞液中,暂未释放到溶液中。
过本章的液相As溶液实验,可以知道我们所得到的五株好氧型As(V)还原菌能够在200 mg/L的As(V)溶液中生长并且能够将As(V)全部还原成为As(III),随着培养时间的增加,还原效率降低,一方面是因为菌株经过了对数生长期并且逐渐衰亡,其还原能力下降,另一方面,随着As(III))浓度的升高,溶液中的毒性不断增强,抑制了菌株的生长,这点与前面提到的As(III)毒性高于As(V)结论一致。
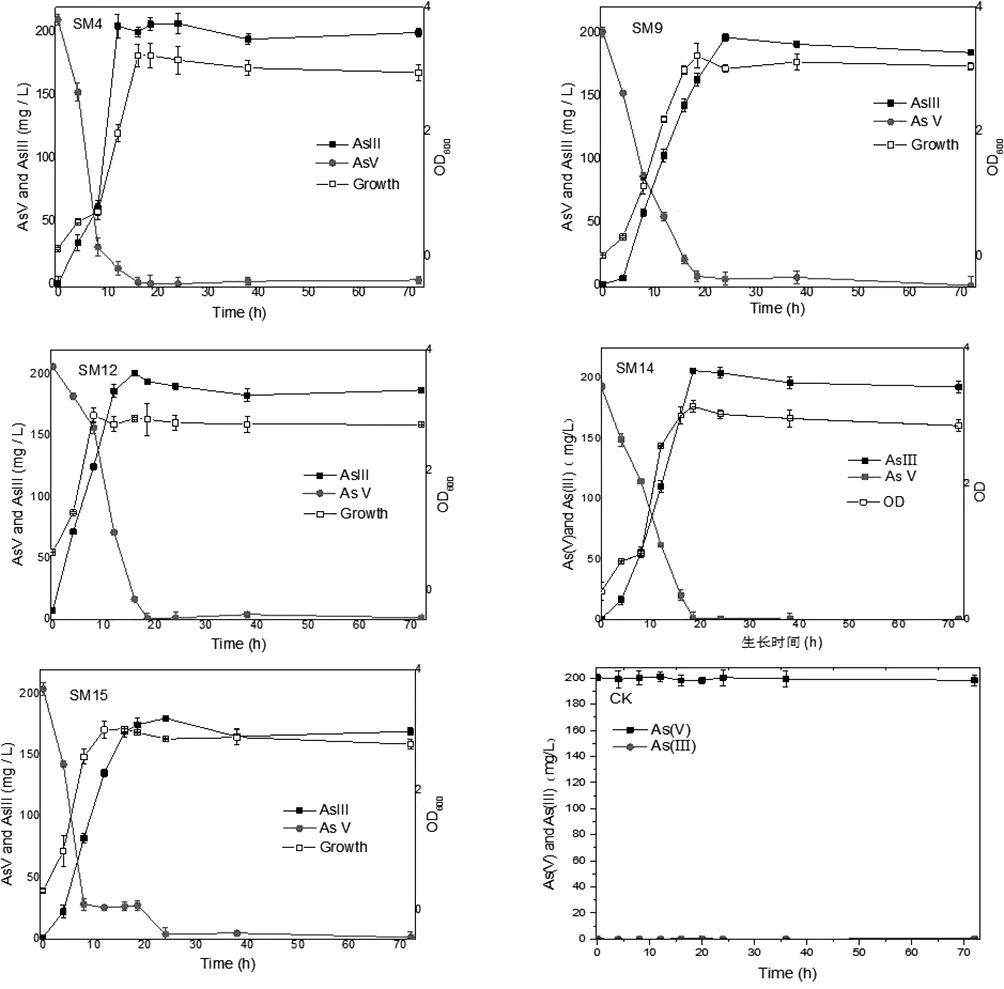
图3-2好氧还原菌SM4,SM9,SM12,SM14,SM15以及CK对液相As(V)的还原转化
Fig.3-2TransformationandreductionofarsenicbyaerobicarsenicreducingbacteriaSM4,SM9,SM12,SM14,SM15andCKinliquidAs(V)
(注:每个小图左上角SM4,SM9,SM12,SM14,SM15,CK为菌株名称)
(2)好氧As(V)还原菌对水铁矿吸附态As(V)的还原转化
在水铁矿吸附态As(V)(200 mg/L)的实验中,收集到的上清液仅为98.46 ug/L,这足以说明水铁矿对As(V)具有强大的吸附能力,吸附效率高达99.95%。并且吸附所需的时间仅为24 h,这也说明水铁矿对As(V)具有很强的亲和力,这与前面提到的铁氧化物与As具有密切关系观点一致。这也是本文为何选取水铁矿作为吸附材料的原因。
在0-10h内,As(V)浓度逐渐下降,As(III)浓度逐渐上升,这意味着在此期间As(V)快速被还原成As(III),10 h即可达到最大As(V)还原量,即As(III)浓度达到了最大值66.72μM(即4.998 mg/L)。并且As(III)浓度达到的最大值远大于As(V)的最大浓度值。由此可以说明,在此期间,As(V)还原菌株SM14还原了部分吸附在水铁矿表面的固相As(V)。此时Fe(II)也达到了一个较高值1.168 mM(即65.408 mg/L)。而CK组在0-10 h内As(V)浓度由33.16 mg/L下降到26.42 mg/L,这个值远低于实验组的As(III)浓度值。并且在CK溶液中检测不到As(III)的存在,如图3-3(2)所示。此时溶液中也出现了部分Fe(II)。
如图3-3(1)所示在10-72h时间段内,实验组As(III)浓度有所下降,As(V)浓度有所上升,这可能是因为被还原到液相中的As(III)又被吸附到水铁矿的表面,因为水铁矿对As(V)具有强大的吸附能力。Fe(II)浓度则呈现一种缓慢上升的状态。而CK组中As(V)浓度虽然有微小的上升阶段,最终也恢复到与起始浓度值持平的状态,Fe(II)浓度则呈现一种相对稳定的状态,溶液中始终没有检测到As(III),如图3-3(2)所示。

图3-3 好氧还原菌SM14(a)和CK(b)对水铁矿吸附态As(V)的还原转化
Fig.3-3ReductionandtransformationofadsorptivearseniconferrihydritebyaerobicarsenicreducingbacteriaSM14(left)andCK(right)
3.好氧As(V)还原菌对土壤As(V)和Fe(Ⅲ)的转化
如图3-4 B和D所示,在灭菌组中,接种好氧As(V)还原菌株的样品As(III)浓度和Fe(II)浓度值明显比未接种样品As(III)浓度和Fe(II)浓度高,未接种处理中As(III)浓度几近为零,(As(V)形态的检测限为0.05 ug/L),对比之下,接种好氧As(V)还原菌的处理样品中As(III)浓度最大值达到了82.46 ug/L,Fe(II)浓度也达到了74.21 mg/L,SM14对土壤中的As(V)和Fe(III)起到了明显的还原作用。
如图3-4 A所示,原始无处理样品(未接种未灭菌),出现了一定浓度的As(III),As(V),Fe(III),Fe(II),而灭菌样品中检测不到As(III)的出现,说明As(III)的出现与土壤中的土著微生物关系密切。如图3-4 A和C所示,在未灭菌组中,接种好氧As(V)还原菌株SM14的样品As(III)浓度值也比未接种样品As(III)浓度高,Fe(II)浓度值也比未接种样品Fe(II)浓度高。说明好氧As(V)还原菌株SM14促进了As(V)和Fe(Ⅲ)的转化。接种组中As(III)和Fe(II)的浓度随培养时间的增加慢慢,说明还原过程一直在持续进行。
图3-5表明,经过七天的培养时间,As(V)还原菌株SM14明显促进了As(V)的溶出与还原。在灭菌组中,经过7天时间的培养,最大As(III)还原量达到3524.96 ug/L,而其对照组仅仅为24.19 ug/L,还原量是对照的145.7。说明接种的As(V)还原菌株SM14在As(V)还原到As(III)的过程中起到了十分重要的作用。在未灭菌组中,接种As(V)还原菌株SM14的样品As(III)浓度为2675.15 ug/L,还原量是对照的3.9倍,对照处理仅为683.45 μg/L。
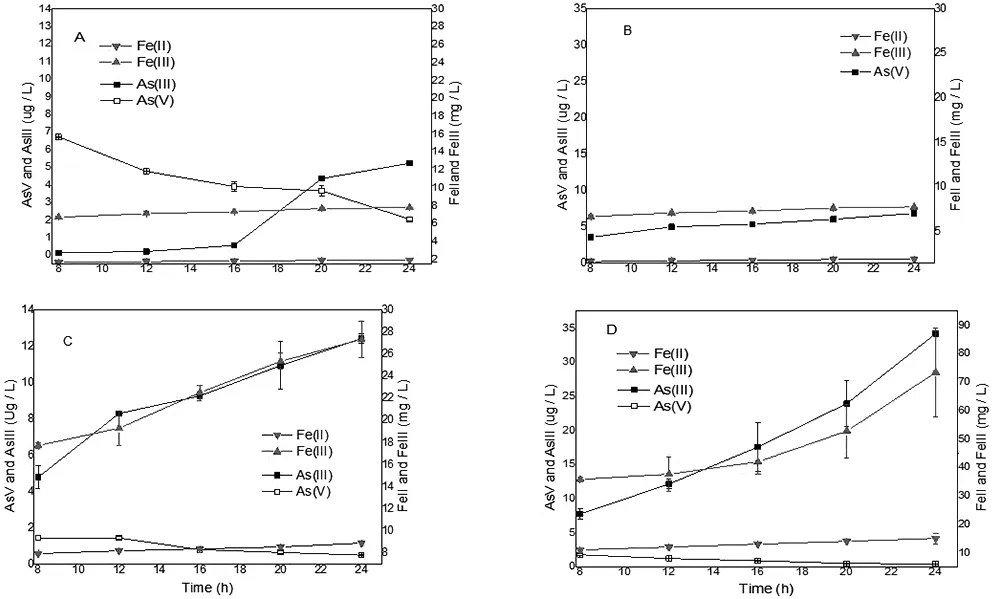
图3-4 好氧还原菌SM14对土壤As(V)和Fe(III)的转化
Fig.3-4ReductionandtransformationofAs(V)andFe(III)insoilbyaerobicarsenicreducingbacteriaSM14
(注:A、C土壤未灭菌,其中A未接种菌株SM14,C接种菌株SM 14;B、D土壤进行灭菌,其中C未接种菌株SM14,D接种菌株SM14)
实验结果表明,菌株SM14对吸附在水铁矿表面的吸附态As(V)具有还原效果。在还原过程中,在无微生物加入的情况下,水铁矿也会自然溶出部分As(V),这可能由于吸附了As(V)的水铁矿发生的化学性溶解。但加入As(V)还原菌株后,溶出量明显增加,As(Ⅲ)浓度值明显大于As(V)浓度值。这说明,As(V)还原菌株促进了As(V)的溶解,并将As(V)还原成As(III),除了液相中的As(V)被还原,还有部分固相As(V)被还原。
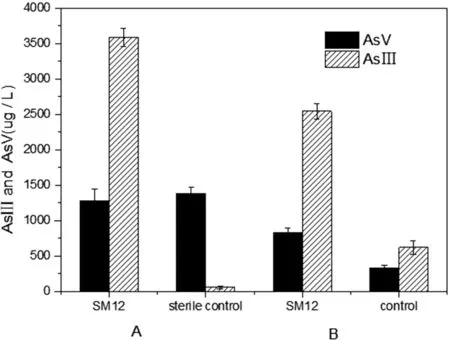
图3-5静置培养7天后好氧还原菌和CK对灭菌土壤(A)和未灭菌原始土壤(B)中As(V)的还原
Fig.3-5ReductionandtransformationofAs(V)insterilesoil(A)andoriginalsoil(B)byaerobicarsenicreducingbacteriaSM14andCKafterstaticculturefor7days
在土壤实验中,不同处理都能检测到少量的Fe(II),说明Fe(III)的还原的出现并不是由于实验添加的As(V)还原菌所引起的,灭菌处理中Fe(II)的出现可能是Fe(Ⅲ)在还原环境下发生的自然过程,也可能是在少数微生物的作用下发生的,如Fe(Ⅲ)还原菌。除了灭菌处理中没有接种As(V)还原菌的对照组没有检测到As(III),其他处理都能检测到微量的As(III),这是由于其他处理中都存在着微生物,这个结果也印证了As(V)的还原是在微生物参与下进行的这一观点。不管是灭菌处理还是不灭菌处理中,As(V)还原菌株的加入都使得As(III)和Fe(II)的浓度值有所增加,说明该As(V)还原菌确实能促进土壤As(V)和Fe(III)的还原。
结论
(1)高As浓度下,菌株达到最大生长量所需要的时间比低As浓度长,但是不同的As(V)浓度下,As(V)的最大生长量无显著性差异。
(2)好氧As(V)还原菌株SM 4,SM 9,SM 12,SM 14,SM 15都对水溶态表现出一致的还原溶解能力;
(3)相比而言,菌株SM 14对液相As(V)的还原速率较快,对水铁矿结合态和污染土壤结合态As(V)的还原速率较低;
(4)菌株SM 14可以同时还原水铁矿结合态Fe(III)成为液相Fe(II),且对Fe(III)的还原量大于对于As(V)的还原量。
(5)静置七天培养,As(III)的还原量有很大的提高,在此过程中,好氧As(V)还原菌株SM 14起到了重要作用。
