AC方案联合吉非替尼序贯治疗EGFR基因敏感突变的肺腺癌患者的临床疗效观察
2018-10-17陈文福
陈文福
近年来,随着我国工业化进程、人口老龄化加剧等,肺癌在我国的发病率和死亡率呈现逐年上升的趋势,并已超越肝癌,居我国恶性肿瘤死亡原因首位,约占全部恶性肿瘤的22.7%[1]。肺腺癌是肺癌的常见类型,占肺癌患者的40%,三分之一的患者就诊时已处于晚期[2]。含铂类双药是晚期肺腺癌的标准一线化疗方案,但其有效率仅为30%左右,中位生存期只有8~11个月,2年生存率仅为10%~20%,5年生存率更是低于5%[3]。含铂类双药的疗效已达到平台期,因此,探索新的化疗药物和化疗方案具有重要意义。
随着分子生物学进步,肿瘤细胞生长的信号转导通路成为肺腺癌治疗的重要靶点, EGFR的过量表达与预后差、肿瘤转移、生存期短等密切相关[4]。吉非替尼是EGFR的小分子络氨酸激酶抑制剂,其在EGFR基因突变患者中的疗效已被多项临床试验证实[5]。为了获得更好的疗效,传统化疗药物和吉非替尼同步治疗方案与传统化疗药物序贯吉非替尼治疗方案,成为目前研究热点。本文研究AC方案与吉非替尼不同时序给药对EGFR基因突变肺腺癌患者的疗效和不良反应,探讨AC方案与吉非替尼的合理使用顺序。
1 资料与方法
1.1 一般临床资料
选取2015年3月至2016年3月期间我院肿瘤科收治经病理学确诊的肺腺癌患者64例,且经基因筛查存在EGFR基因敏感突变。按照随机数表法将所有患者分为观察组和对照组,其中观察组32例,男性13例,女性19例;年龄18~80岁;临床分期:ⅢB期24例,Ⅳ期8例;突变类型:19外显子突变缺失17例,21位外显子L858R突变15例。对照组32例,男性15例,女性17例;年龄18~80岁;临床分期:ⅢB期22例,Ⅳ期10例;突变类型:19外显子突变缺失19例,21位外显子L858R突变13例。本研究在患者完全知情并签署知情同意书下进行,并经本院伦理委员会批准同意。两组患者一般临床资料统计见表1,差异无统计学意义(P>0.05),可有临床可比性。
1.2 纳入与排除标准
纳入标准:确诊为晚期肺腺癌患者;诊断为EGFR基因突变患者;年龄18~80岁;无手术、化疗、放疗及其他治疗史者;KPS评分>60分,预计生存时间>3个月;依从性好。
排除标准:无明确病理学诊断;其他类型的肺癌患者;有小分子络氨酸激酶抑制剂治疗既往史者;预计生存期<3个月者。
1.3 方法
观察组患者给予AC方案序贯吉非替尼化疗。第1 d,培美曲塞(法国Lilly S.A.S公司)500 mg/m2,每2天静脉滴注卡铂AUC 5;第8 ~21 d口服吉非替尼250 mg/d;每4周为1个周期,最多6个周期,然后每4周进行一次培美曲塞单药联合口服吉非替尼维持治疗。
对照组患者给予AC方案同步吉非替尼化疗。第1 d,培美曲塞500 mg/m2,卡铂AUC 5,每4周为1个周期,最多6个周期,然后每4周进行1次培美曲塞单药维持治疗。每天口服吉非替尼250 mg/次/d。
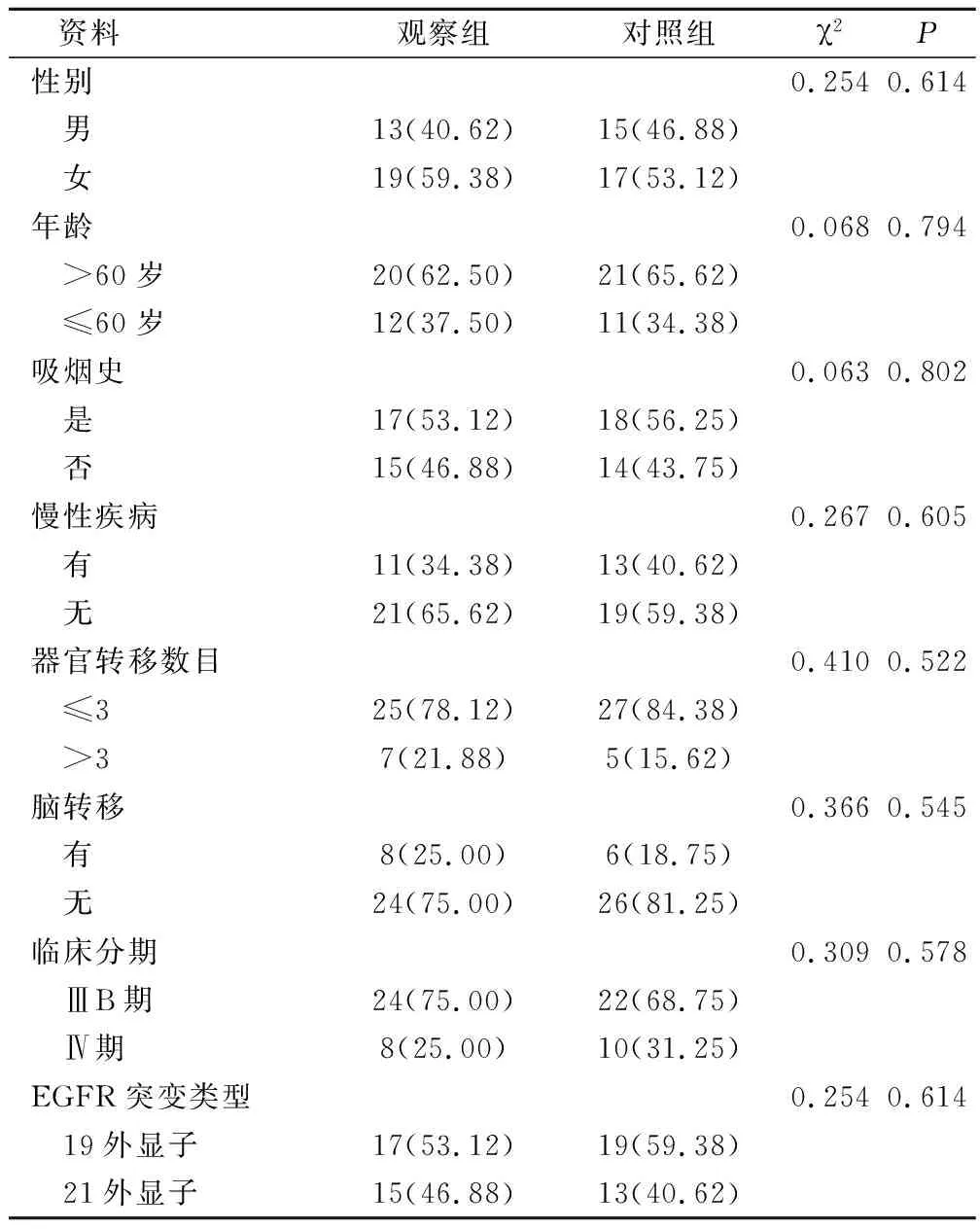
表1 两组患者一般临床资料对比(例,%)
1.4 疗效评价
疗效评价参照实体瘤疗效评价标准(RECIST 1.1)。完全缓解(complete response,CR);部分缓解(partial response,PR);疾病稳定(stable disease,SD);疾病进展(progressive disease,PD)。
1.5 观察指标
观察两组患者的ORR(%)、DCR(%)和12个月的PFS。ORR(%)=(CR+PR)/总例数×100%;DCR(%)=(CR+PR+SD)/总例数×100%。PFS:患者确诊至疾病第一次进展或死亡时间。
每周期结束时,所有患者行血常规、尿便常规、肝肾功能等检查,评估血液学毒性、肝肾毒性、心脏毒性等。根据世界卫生组织(world health organization,WHO)化疗不良反应分级标准记录不良反应发生情况。同时对出现严重的骨髓抑制或肝肾损害的患者,进行对症积极治疗,重新评估后进行下1个周期化疗。
1.6 统计学处理
应用统计软件SPSS 19.0进行统计分析。采用Kaplan-Meier法绘制生存曲线,计数资料以例(%)表示,组间比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组疗效对比
两组疗效结果见表2。观察组患者CR 0例,PR 11例,SD 13例,PD 8例,客观缓解率ORR为34.38%,疾病控制率DCR为75.00%。对照组患者CR 0例,PR 4例,SD 10例,PD 18例,客观缓解率ORR为12.50%,疾病控制率DCR为43.75%。两组患者的ORR和DCR差异有统计学意义(P<0.05),观察组ORR和DCR显著高于对照组。
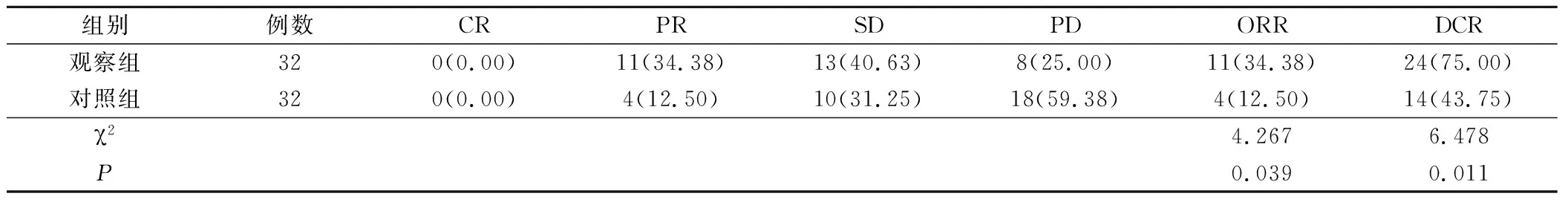
表2 两组患者疗效对比(例,%)
2.2 两组生存期对比
所有患者均得到随访,两组患者12个月的生存曲线如图1所示。观察组的12个月PFS分别为9.1个月(95%CI为7.85~10.35),对照组的PFS分别为6.4个月(95%CI为4.60~8.20),两组PFS曲线见图1,观察组PFS显著长于对照组(P<0.05)。
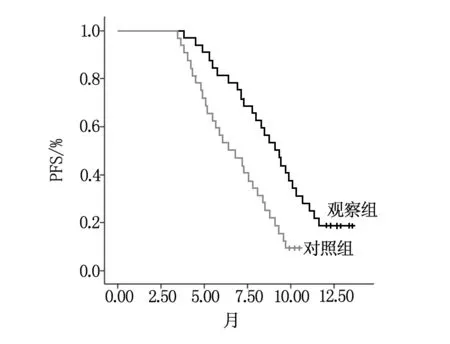
图1 两组患者PFS曲线
2.3 两组患者不良反应
两组患者不良反应结果见表3。两组患者不良反应主要为Ⅰ~Ⅱ级反应,且两组患者各项不良反应发生率比较差异无统计学意义(P>0.05)。
3 讨论
化疗仍然是晚期NSCLC患者有效的治疗手段。第三代化疗药物联合铂类的两药联合方案是目前公认的晚期NSCLC的标准一线治疗方案[6]。培美曲塞是一种新的、多靶点叶酸拮抗剂,可以通过破坏叶酸依赖性代谢过程,抑制肿瘤细胞复制,从而抑制肿瘤的生长。在2008年的JMDB研究中,培美曲塞联合顺铂方案对肺腺癌的疗效显著优于吉西他滨联合顺铂方案,中位生存期分别为12.6 vs 10.9个月,且血液学毒性、呕吐等不良反应的发生率更低[7]。因此,培美曲塞于2008年被美国食品药品监督管理局(FDA)批准用于肺腺癌的一线治疗。但是,晚期肺腺癌的含铂类双药化疗方案总体效果不尽人意,其疗效已达到平台期,现有化疗药物的重新组合难以提高患者的生存率。
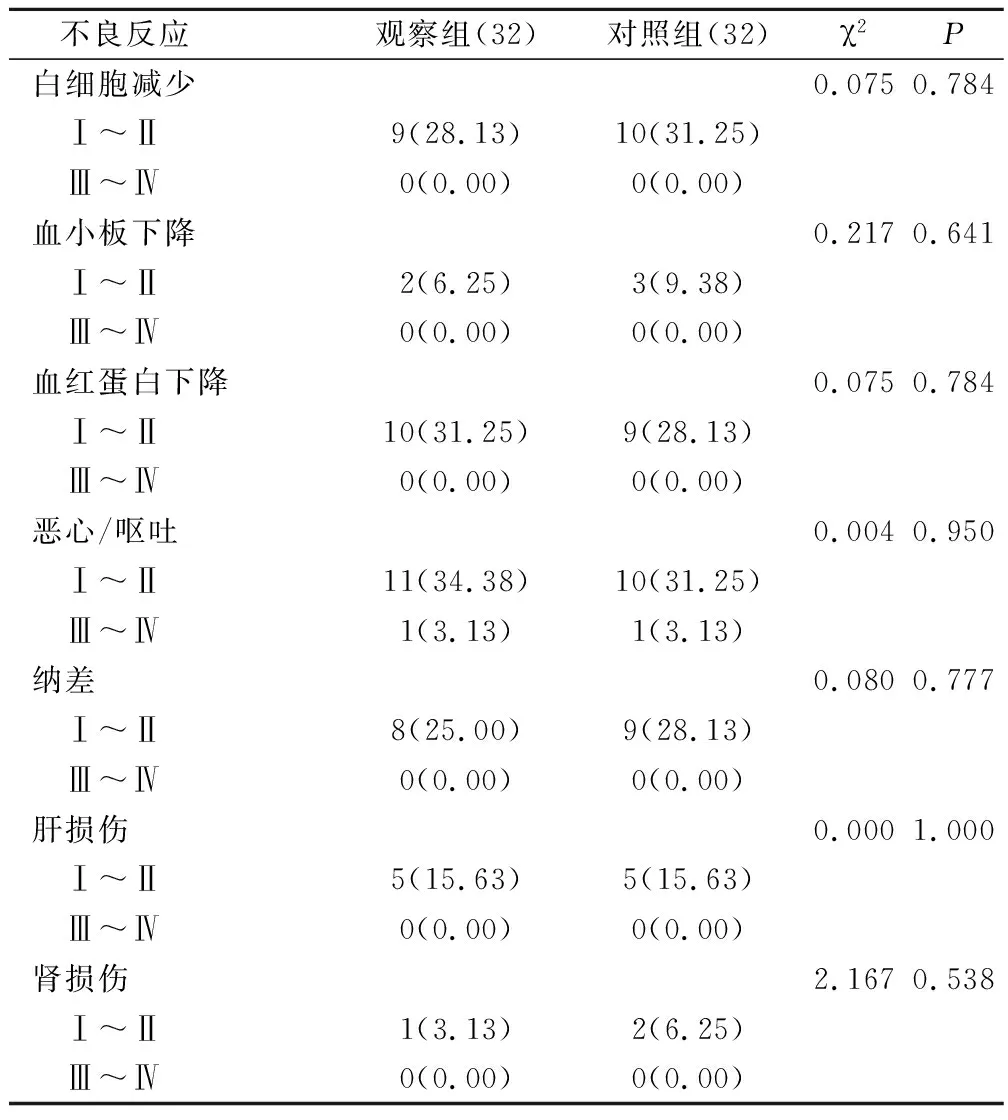
表3 两组患者不良反应对比(例,%)
EGFR是原癌基因cerbB-1表达产物,属于受体络氨酸激酶(tyrosine kinase,TK),通过与表皮生长因子(epithelial growth factor,EGF)结合而活化,发生二聚化,使其酪氨酸残基磷酸化,激活EGFR中TK,并进一步激活下游的信号通路,从而调节细胞对外界刺激的反应,与肿瘤发生和转移密切相关[8]。研究发现,EGFR在45%~70% NSCLC细胞中过度高表达,络氨酸激酶抑制剂可以通过与ATP竞争结合其受体络氨酸激酶胞内端,阻断自身底物磷酸化,切断下游信号转导,抑制肿瘤细胞增殖、转移等[9]。
吉非替尼是可逆性的表皮生长因子受体络氨酸激酶抑制剂(EGFR-TKIs),用于治疗既往接受过化疗或不适合化疗的局部晚期或转移性NSCLC[8],机制包括:①通过阻断蛋白激酶自身和底物磷酸化,阻断EGFR信号转导通路;②通过抑制有丝分裂原活化蛋白激酶的活化和肿瘤血管形成,诱导肿瘤细胞凋亡。然而,随着治疗时间延长,对EGFR-TKIs治疗敏感的EGFR基因突变患者,最终都不可避免的出现耐药性,出现病情恶化[10]。因此,晚期肺腺癌新的化疗策略-EGFR-TKI联合传统化疗药物,成为研究热点。
多项临床研究结果显示,吉非替尼与吉西他滨或紫杉醇同时应用时的有效率和生存期并未优于单纯给药[11-14]。该项研究失败的重要原因之一是试验开展时尚未认识到EGFR-TKIs基因突变状态与EGFR-TKIs疗效的关系,入组患者缺乏针对性[15]。而一项2008年的FAST-ACT研究显示,EGFR基因突变患者给予吉西他滨序贯厄洛替尼治疗的中位PFS和OS均显著长于吉西他滨序贯安慰剂患者[16]。本文对比研究了AC方案序贯吉非替尼化疗方案与AC方案同时吉非替尼化疗方案,结果显示:观察组ORR(CR 0例+PR 11例)为34.38%, DCR(CR 0例+PR 11例+SD 13例)为75.00%,对照组ORR(CR 0例+PR 4例)为12.50%, DCR(CR 0例+PR 4例+SD 10例)为43.75%,观察组ORR和DCR显著大于对照组(P<0.05)。观察组的PFS分别为9.1个月(95%CI为7.85~10.35),对照组的PFS分别为6.4个月(95%CI为4.60~8.20),观察组PFS显著长于对照组(P<0.05)。两组患者不良反应主要为Ⅰ~Ⅱ级反应,且两组不良反应发生率差异无统计学意义(P>0.05)。其机制可能与培美曲塞与吉非替尼具有协同增效作用。研究发现,吉非替尼对EGFR、AKT、ERK磷酸化水平呈抑制作用,而培美曲塞可以上调EGFR、AKT、ERK磷酸化水平,从而使吉非替尼抑制EGFR、AKT和ERK磷酸化的敏感度增强[17]。此外,研究还发现,吉非替尼可以降低TS酶从而增加培美曲塞效应[18]。Davies等[19]研究发现,EGFR-TKIs主要使肿瘤细胞阻滞于G1期,而培美曲塞主要作用于细胞周期S期。因此,如果吉非替尼先于或同时培美曲塞给药,则大量肿瘤细胞被阻滞于G1期,使培美曲塞疗效降低。
综上所述,AC方案血管吉非替尼可以有效缓解和控制EGFR基因突变肺腺癌患者的病情,提高患者生存期,且不良反应较轻。
