CDC20、TOP2A、NEK2在食管鳞癌中的表达及其与临床病理特征及预后的相关性
2018-10-17牛东生
牛东生
多项研究报道,食管鳞癌(esophageal squamous cell carcinoma,ESCC)已由全球恶性肿瘤第8位上升至第7位,且有着极高的死亡率[1]。随着医疗研究对ESCC生物机制及分子研究的不断深入,ESCC相关的基因和蛋白质发生机制亦有重大突破,如Kim等[2]证实TOPA2表达与肿瘤细胞凋亡有着密切关联,研究亦发现细胞分裂周期蛋白20(CDC20)可以促进肿瘤细胞浸润性;有丝分裂监管相关激酶2(NEK2)在肿瘤的终末阶段病理组织中被证实大量表达[3]。本文从肿瘤细胞增殖,肿瘤细胞分裂及肿瘤标志物临床应用研究等角度探讨食管鳞癌的发病机制,并探析CDC20、TOP2A、NEK2与ESCC转移、复发及预后的关系。
1 材料与方法
1.1 一般资料
选取本院2012年5月至2015年5月收治且成功实施根治性手术的食管鳞癌患者70例,均经病理组织学诊断,符合食管鳞癌诊断标准[4]。新鲜组织标本均在食管鳞癌根治术中切取,A组(癌组织),B组(癌旁组织),C组(正常组织)。全部患者中有48例男性、22例女性;年龄<60岁者40例、≥60岁者30例;按瘤体大小分为41例<5 cm、29例≥5 cm;按肿瘤病灶位置分为37例上段、33例中、下段;按TNM分期为11例Ⅰ期、31例Ⅱ期、17例Ⅲ期、11例Ⅳ期;按肿瘤分化程度分为37例中-高分化、33例低分化;按淋巴转移情况分为28例淋巴转移、42例无淋巴转移;按静脉浸润情况分为29例静脉浸润、41例无静脉浸润。纳入标准:①术前未开展放化疗干预;②符合手术切除指征;③病例资料齐全;④知情同意。排除标准:①伴有严重并发症;②术前已接受放化疗;③病例资料不全;④随访调查失联者。
1.2 方法
所有标本均常规甲醛(10%)固定4~6 h,梯度脱水,组织浸蜡,石蜡包埋,切片;免疫组化S-P法进行染色,应用奥林巴斯BX51型显微镜阅片,辅助Image pro plus 5.0图像处理软件观察CDC20、TOP2A、NEK2在食管鳞癌中的表达灰度值。结果判定:2名病理医师双盲法状态下,高倍镜(×400)观察肿瘤细胞,细胞核或细胞质中出现黄色或棕黄色颗粒判为阳性细胞。每份标本随机选择5个视野,每个视野下计数100个肿瘤细胞,共计500个,计算阳性细胞所占百分比。阳性细胞率≥10%判断为阳性,阳性细胞率<10%判断为阴性。半定量逆转录聚合酶链反应(RT-PCR)检测病理组织内CDC20、TOP2A、NEK2表达情况,依据Trizol RNA试剂盒标准方案作基因RNA提取,DEPC备制,再行琼脂糖凝胶电泳鉴定 mRNA完整性。即选用实用ABI7500型实时定量PCR仪做标本基因扩增,经 UVIpro紫外凝胶成像及分析系统观察、扫描、拍照,分析图片中的CDC20、TOP2A、NEK2与β-actin表达强度,2-△△Ct算法计算相对表达量。
1.3 统计学方法
数据纳入SPSS 19.0统计软件分析,计数χ2比较,计量t检验,Kaplan-Meier法评估预后OS、PFS,Log-rank分析相关因素,多因素生存分析采用Cox比例风险模型,P<0.05为差异有统计学意义。
2 结果
2.1 食管鱗状细胞癌组织镜下CDC20、TOP2A、NEK2表达特征
S-P 法检测观察,癌细胞可呈癌巢状分布,伴有不规则细胞列,细胞异型,核分裂状,可见于细胞质内,阳性染色颗粒明显。
2.2 不同食管组织标本中CDC20、TOP2A、NEK2表达分析
A组CDC20、TOP2A、NEK2表达水平最高,与B、C差异明显(P<0.05);B组CDC20、TOP2A、NEK2表达水平低于A组,高于C组,差异明显(P<0.05)。见表1。

表1 不同食管组织标本中CDC20、TOP2A、NEK2表达分析
注:a为与C组对比,P<0.05,b为与B组对比,P<0.05。
2.3 CDC20、TOP2A、NEK2表达与ESCC临床病理特征关系分析
ESCC患者性别、年龄、瘤体大小、位置等因素与CDC20、TOP2A、NEK2表达无相关性(P>0.05);TNM分期、淋巴转移及浸润因素与CDC20、TOP2A、NEK2阳性表达率呈正相关性(P<0.05);肿瘤分化与CDC20、TOP2A、NEK2阳性表达率呈负相关;CDC20与TOP2A,CDC20与NEK2,TOP2A与NEK2表达均呈正相关性。见表2。
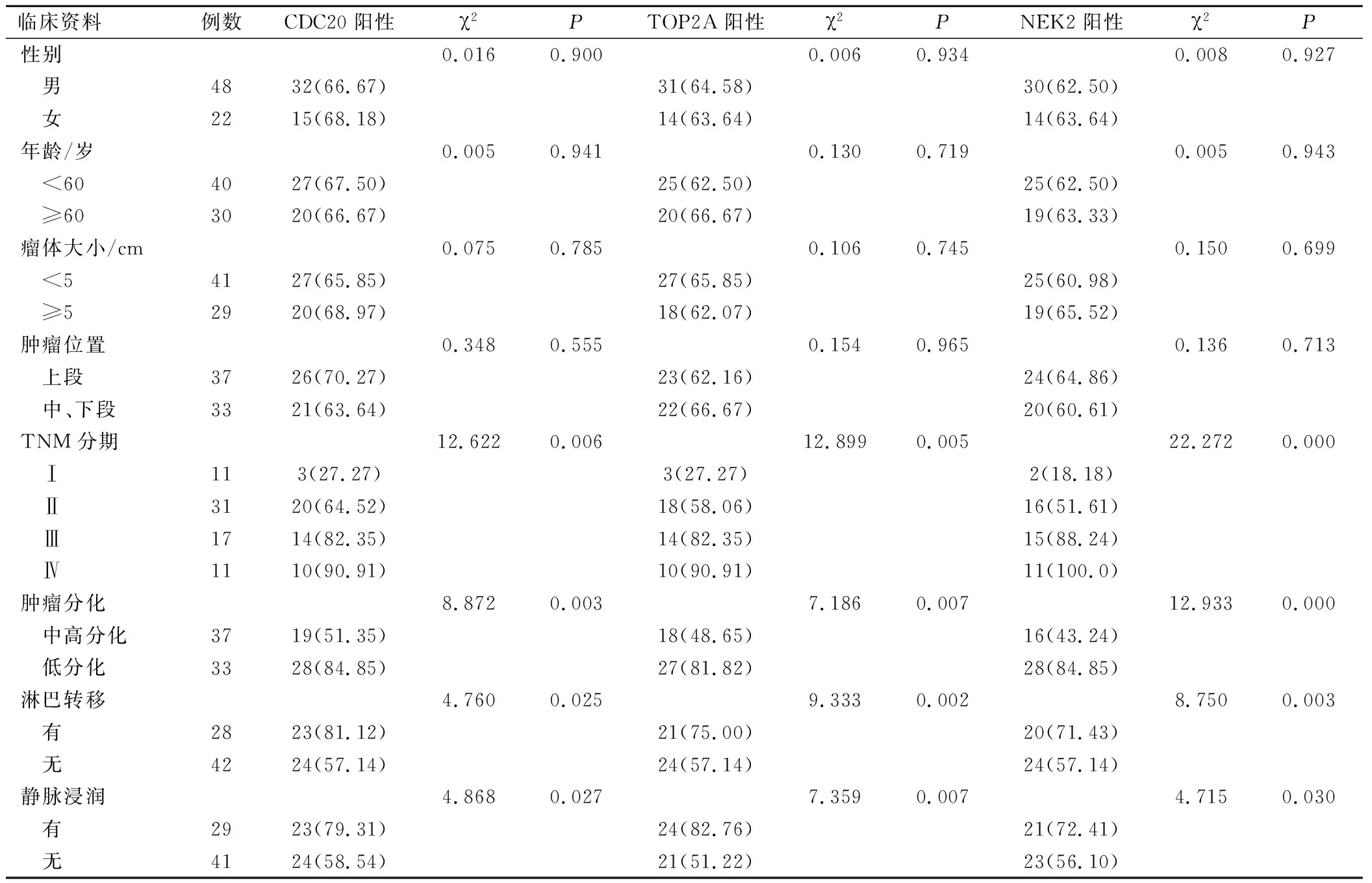
表2 CDC20、TOP2A、NEK2阳性表达与ESCC临床病理特征关系分析(例,%)
2.4 CDC20、TOP2A、NEK2表达与ESCC患者预后相关性分析
所有病患术后均持续随访6个月~3年,采取Cox比例风险模型将TNM分期、肿瘤分化、淋巴转移、浸润及CDC20、TOP2A、NEK2阳性表达做多因素分析,结果证实TNMⅢ~Ⅳ期、低分化肿瘤、淋巴转移、静脉浸润及CDC20、TOP2A、NEK2阳性表达均是影响ESCC患者预后存活的危险因素。见表3。
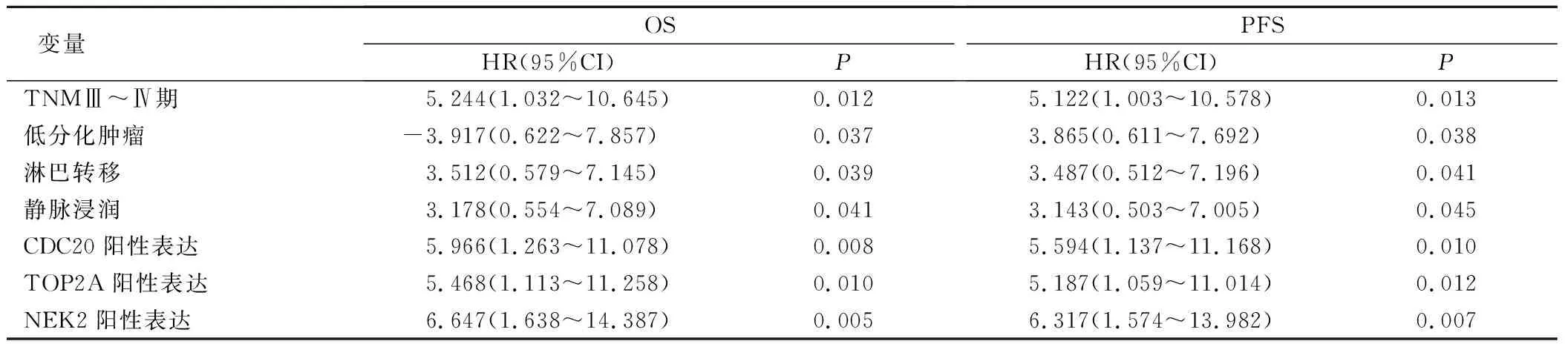
表3 CDC20、TOP2A、NEK2表达与ESCC患者预后OS、PFS相关性分析
3 讨论
ESCC病发是多因素、多步骤、多阶段及多基因改变的过程,而细胞周期调控异常、细胞增殖失控是肿瘤发生的重要机制。对此众多学者提出结合ESCC肿瘤增殖、浸润的分子机制,探析符合ESCC诊疗的高敏感、特异性良好的诊断指标来评估ESCC转移、复发及预后变化。
CDC20属细胞周期蛋白,亦是保证细胞有丝分裂正常进行的关键蛋白,主要调节细胞有丝分裂S期~G2/M期细胞染色体DNA完成分裂复制的关键,也是后期促进复合体/周期体APC/C 的正调控子[5]。研究证实,CDC20出现异常表达可导致有丝分裂出错,并能引起一些癌症基因的过表达和抑癌基因的丢失或者突变[6]。乐祥阳[7]研究发现,CDC20表达异常能够对癌细胞增殖形成促进效应,且提升癌细胞自我修复,引起肿瘤患者肿瘤抑制失控。另外有学者发现CDC20亦可减缓肿瘤细胞凋亡速度,对肿瘤的进展均有参与[8]。对此有学者建议将CDC20作为肿瘤治疗的新靶点。
新近研究指出ESCC与原癌基因的激活、抑癌基因的失活、调节DNA的修复及维持基因稳定性的调节蛋白的功能障碍等分子生物学因素密切相关[9]。TOP2A是一类细胞核内数量仅次于组蛋白的蛋白酶之一,是控制和改变DNA的转录网络拓扑状态以及影响DNA转录的重要调控酶,均有调节染色体缩合、染色单体分离的功能[10]。研究表明TOPA2可以剪切DNA,形成TOP-DNA-AMPPNP复合体从而参与细胞有丝分裂。
NEK2是本地化的中心体,通过调控中心体正确地复制、分离、成熟最终建立双极纺锤体。目前已有研究证实,NEK2在多种肿瘤如急性髓系白血病、前列腺癌、乳腺癌、胃癌及恶性胶质瘤等组织中均呈现高表达,且其表达水平与组织的恶性进程有关[11]。Fang等[12]通过人体细胞系研究指出,NEK2表达异常可造成中心体结构异常改变,导致功能性缺陷,而这类不稳定因素将感染基因整体稳定性,由此诱导细胞恶性转化,联级效应参与肿瘤的转移、浸润。
本次研究中针对ESCC患者病理特征分别对不同组织样本做S-P法染色,观察并通过RT-PLR法做CDC20、TOP2A、NEK2基因表达检测,结果发现,ESCC癌组织内CDC20、TOP2A、NEK2均呈高表达,与癌旁组织及正常组织相比呈梯度型递增,各组差异明显;且与TNM分期、肿瘤分化、淋巴转移及浸润因素呈正相关性。表明CDC20、TOP2A、NEK2与ESCC患者病理进展、转移有明显关联。另外,研究证实TNM Ⅲ~Ⅳ期、高分化肿瘤、淋巴转移、静脉浸润是影响ESCC患者预后存活的危险因素,说明CDC20、TOP2A、NEK2异常表达可预示ESCC的侵袭、转移、复发,尤其当TNM分期越严重,其指标表达越高。通过CDC20、TOP2A、NEK2联检可对ESCC肿瘤恶化发展机制、肿瘤分期评估、分化程度等做辅助参考评估,提升ESCC临床诊疗作用。研究指出,针对CDC20、TOP2A、NEK2表达对肿瘤细胞的作用机制做靶向抑制[13],以RNA干扰技术进行基因表达调节,减少肿瘤细胞的增殖、进展,为从基因水平治疗食管鳞癌提供新的思路。
综上所述,CDC20、TOP2A、NEK2高表达与食管鳞癌转移、复发、预后均密切相关,三项指标联检可准确评估食管癌病理状态,为患者预后判定提供参考。
