酸/碱预处理对两株木霉降解玉米秸秆效果的影响
2018-10-17关春峰王昱蓉
张 悦 , 季 静 *, 关春峰 , 金 超 ,李 倩 , 闫 豹 , 王 罡*, 王昱蓉
(1. 天津大学 环境科学与工程学院,天津 300072;2. 天津市天大天福生物技术有限公司,天津 300384)
我国是以农业为第一产业的大国,生物质能源每年有一半为秸秆资源,可见我国拥有相当庞大的秸秆资源保有量,但因为降解技术不发达、工业化难度较大、资源利用成本高,使秸秆综合利用率呈现下降趋势[1]。在秸秆的构成中,纤维素、半纤维素和木质素互相联结呈现出复杂且不连续的层状结构,这种结构使得秸秆降解的难度加大,进而降低了秸秆的开发与利用率[2]。目前研究与利用木质纤维素发酵的科研机构都围绕着以下关键工艺进行:一是预处理工艺,即通过不同物理、化学或生物等方法,使纤维素、半纤维素和木质素的结构被破坏,从而易于被降解;二是水解工艺,即通过酸法或酶法把纤维素和半纤维素水解成五碳糖和六碳糖;三是发酵工艺,选用特殊的菌种共同培养,对上述的五碳糖和六碳糖进行发酵[3]。但单一的处理方法存在着成本高、耗时长或降解效率低等问题。结合秸秆资源开发优势大及降解难的现状,可见秸秆资源的高效利用需进行多种工艺结合研究。
利用某些微生物可以高效降解秸秆纤维素类和木质素类物质的功能,大大提高秸秆的降解率。真菌是目前研究深入、应用广泛的降解菌种之一。其不仅能够分泌胞外酶,而菌丝对木质素的醋质层也有较强的机械穿透作用,大量研究表明,白腐菌对木质素的降解最为彻底,但是由于白腐菌产酶存在培养条件控制困难、酶活力较低、发酵周期长、生产成本高等问题,很难在短时间内培养出大量且均一的培养液。而木霉、青霉、曲霉等的菌种对胞外纤维素酶的分泌能力较强且适合大规模的固体或液体培养,所以在生产中得到了广泛的应用,目前已成为市场内应用前景最佳的纤维素酶工业[4]。且研究表明复合霉菌降解秸秆与单一菌株相比失重率提高了 21.3%~59.6%[5]。而在化学方法降解秸秆的研究中,李轶[6]、杭志喜等[7]则分别研究了稀酸和碱对秸秆的降解并得到了明显效果,降解率最高可达39.28%。
综上所述,对秸秆进行降解的方法与工艺有很多,但单一的降解方法问题多、困难大,利用生物与化学途径结合则可有效缩短降解时间、提高降解速率。而另一方面,因为微生物菌肥可显著改善农田土壤生态微环境、土壤理化性质及植物营养状况,可有效提高植物抗逆性,增加作物产量,目前已在农作物市场中得到广泛应用[8]。故本实验从菌肥中筛选出两株纤维素酶高产霉菌,欲利用此霉菌对化学法预处理工艺进行优化,通过秸秆干粉失重率探究不同预处理对两株木霉降解玉米秸秆效果的影响,为农作物秸秆的高效利用提供一些理论依据。
1 实验
1.1 材料
实验所用预处理原材料为秸秆粉末,来自田间玉米秸秆研磨制成,约存放半年,秸秆中约含15%~17%水分,其余成分主要为纤维素、半纤维素、木质素等有机物及少量灰分;预处理试剂为冰乙酸、氢氧化钠溶液;微生物菌肥为黑曲霉菌肥、哈茨木霉菌肥和绿色木霉菌肥。1.1.1培养基
羧甲基纤维素钠(CMC-Na)固体培养基:CMC-Na 15 g;NH4NO31 g;KH2PO41 g;MgSO4·7H2O 0.5 g;蛋白胨1 g;琼脂 20 g;蒸馏水1 000 mL;pH 7.0,121℃灭菌20 min。
羧甲基纤维素钠(CMC-Na)液体培养基:CMC-Na 15 g;NH4NO31 g;KH2PO41 g;MgSO4·7H2O 0.5 g;蛋白胨1 g;蒸馏水1 000 mL;pH 7.0,121℃灭菌20 min。
1.1.2 主要试验试剂
1)0.05mol/L pH 5.0柠檬酸缓冲液
A液(浓度为0.1 mol/L 的柠檬酸溶液):准确的称量柠檬酸样品21 g,溶解于蒸馏水后,移入 1 000 mL容量瓶准确定容并摇匀,4℃保存备用。
B液(浓度为0.1 mol/L 的柠檬酸钠溶液):准确的称量柠檬酸钠样品29 g,溶解于蒸馏水后,摇匀并定容于1 000 mL容量瓶,4℃保存备用。
分别量取A液205 mL以及B液295 mL,混匀后定容于1 000 mL容量瓶中,即为配制好的0.05 mol/L,pH 5.0的柠檬酸缓冲液,4℃保存备用。
2)浓度为0.51%的CMC-Na标准溶液
称量CMC-Na样品0.51 g溶于少量柠檬酸缓冲液中,水浴锅50℃~70℃加热至完全溶解,再用柠檬酸缓冲液准准确容至100 mL,4℃保存备用。
3)DNS试剂
准确的称量0.5 g 3,5-二硝基水杨酸,再加入20 mL 浓度为2 mol/L的NaOH溶液和50 mL蒸馏水充分搅拌至完全溶解后加入30 g酒石酸钠,待其冷却后定容于100 mL容量瓶中,最终移入棕色试剂瓶中室温放置7 d,待其稳定后备用。
4)浓度为1 mg/mL的葡萄糖标准溶液
于105 ℃干燥葡萄糖至衡重,准确称取0.1 g,用少量蒸馏水溶解后,移入100 mL容量瓶中准确定容并充分摇匀,于4℃冰箱保存备用。
1.2 实验方法
本研究采用微生物菌种的复合体系构建与化学预处理结合的方法,通过测定降解前后玉米秸秆的失重率,探讨不同预处理对两株木霉降解玉米秸秆效果的影响。
1.2.1 秸秆粉碎
研磨玉米秸秆将其粉碎为粉末,后121℃高压灭菌30 min,取出后60℃烘箱烘干,完成第一步玉米秸秆粉末的制备。
1.2.2 秸秆化学试剂预处理
每锥形瓶分别加入1 g粉碎秸秆,每锥形瓶分别加入不同比例化学试剂,加入量如表1所示,充分摇匀室温培养7 d。

表1 化学试剂比例
1.2.3 纤维素降解菌的初筛
将不同组合培养获得的单菌落培养皿用刚果红进行染色,此步骤用于对不同菌种对纤维素降解的能力进行初步筛选。首先利用1 mg/mL的刚果红染色液对待测培养基进行30 min染色,染色结束后弃去染液,再利用1 mol/L的NaCl溶液对培养基进行30 min脱色,脱色结束后弃去废液,观察培养基内是否有以菌落为中心的透明圈产生,并根据每个培养皿透明圈的清晰程度以及透明圈直径和菌落直径比值的大小可以初步判断不同菌系对纤维素的降解能力。
1.2.4 降解纤维素复合菌系的构建
将初筛获得的菌种接种于CMC-Na液体培养基中,120 r/min条件下30℃振荡培养,后取培养液进行CMC及FPA酶活力的测定,所测酶活力大小可作为复筛的判断依据。
粗酶液的制备方法:将待测培养液6 000 r/min离心10 min,取离心后上清液即为备用粗酶液。
酶活力的定义:取1 mL得酶液在1 min规定时间内水解底物所生成的1 μmol的还原糖量即为1个酶活力单位(U/mL)。
酶活力大小的计算方式:测定的酶活力大小根据公式(1)进行计算。

式中,X为待测定的酶活力大小(U/mL),S为还原糖的含量(mg),V1为稀释后粗酶液的定容体积(mL),V2为反应加入待测酶液的体积(mL),V为待测粗酶液的体积(mL)。
1.2.4.1 酶活力的测定方法(本实验采用还原糖法)
1)CMC酶活力的测定方法
准备4支干燥清洁的25 mL试管,1支为空白对照管,剩余3支为待测管,首先于各试管中分别加入1.5 mL CMC-Na标准溶液,再放置50℃水浴锅中进行5 min预热,同时将适当稀释后的粗酶液进行预热,并向各待测管中加入0.5 mL粗酶液,充分混匀后将其与空白管同时进行30 min的50℃水浴反应,反应结束后取0.5 mL适当稀释的粗酶液于空白管中,并向空白管和待测管内同时加入3 mL DNS试剂,沸水浴中反应5 min,反应结束后迅速冷却,并用蒸馏水准确定容至25 mL。在540 nm波长下,以空白对照管调零,测定待测管溶液在该波长下的吸光度大小,后根据所绘葡萄糖标准曲线确定待测液中还原糖的含量,并准确计算出CMC酶活力的大小。
2)FPA酶活力的测定
取4支干燥清洁的25 mL试管,1支为空白对照管,其余3支为待测管,首先分别称取0.5 g滤纸条加入所有试管中,后于 50℃水浴锅预热 5 min,于此同时适当预热稀释后的粗酶液,并向各待测管中加入0.5 mL粗酶液,充分混匀后将其与空白管同时进行30 min的50℃水浴反应,反应结束后取0.5 mL适当稀释的粗酶液于空白管中,并向空白管和待测管内同时加入3 mL DNS试剂,沸水浴中反应5 min,反应结束后迅速冷却,并用蒸馏水准确定容于25 mL试管中。将波长调至540 nm,通过空白对照管进行调零,测定待测管溶液在该波长下的吸光度,后根据所绘葡萄糖标准曲线确定待测液中还原糖的含量,并准确计算出FPA酶活力的大小。
1.2.4.2 葡萄糖标准曲线的绘制
准备6支干燥清洁的25 mL试管,分别将不同含量的葡萄糖标准溶液和不同含量的蒸馏水加入试管中,充分的振荡混匀后再加入3 mL DNS溶液,摇匀后沸水浴反应5 min,沸水浴反应结束后将其迅速冷却,并利用蒸馏水定容至25 mL试管中,后测定每管在540 nm波长下的吸光度大小。以葡萄糖的含量作为横坐标,溶液的吸光度大小作为纵坐标,准确的绘制葡萄糖标准曲线。
1.2.5 复合菌系与化学试剂组合
调节各组合预处理液pH值于4.5~5.5之间,按5%接种比例向各锥形瓶中接入经过筛选后纤维素酶产能力最强的复合菌系,28℃震荡培养7天。
1.3 测定项目及方法
实验结束后将各实验组高温灭菌,将剩余物质用无菌水进行充分洗涤后烘干至恒重,将剩余干物质质量记为M1(g),试验前秸秆质量记为M0(g),秸秆的失重率(D)利用下述公式(2)进行计算。

式中,D为待测定的失重率,M0为发酵前的秸秆质量,M1为发酵后剩余干物质的质量。
2 结果与讨论
2.1 纤维素降解菌的初筛
经刚果红染色后所有的CMC-Na培养基均获得了不同大小的透明圈,各组透明圈对比如图1所示,透明圈直径与菌落直径比值的结果比较如图2所示。
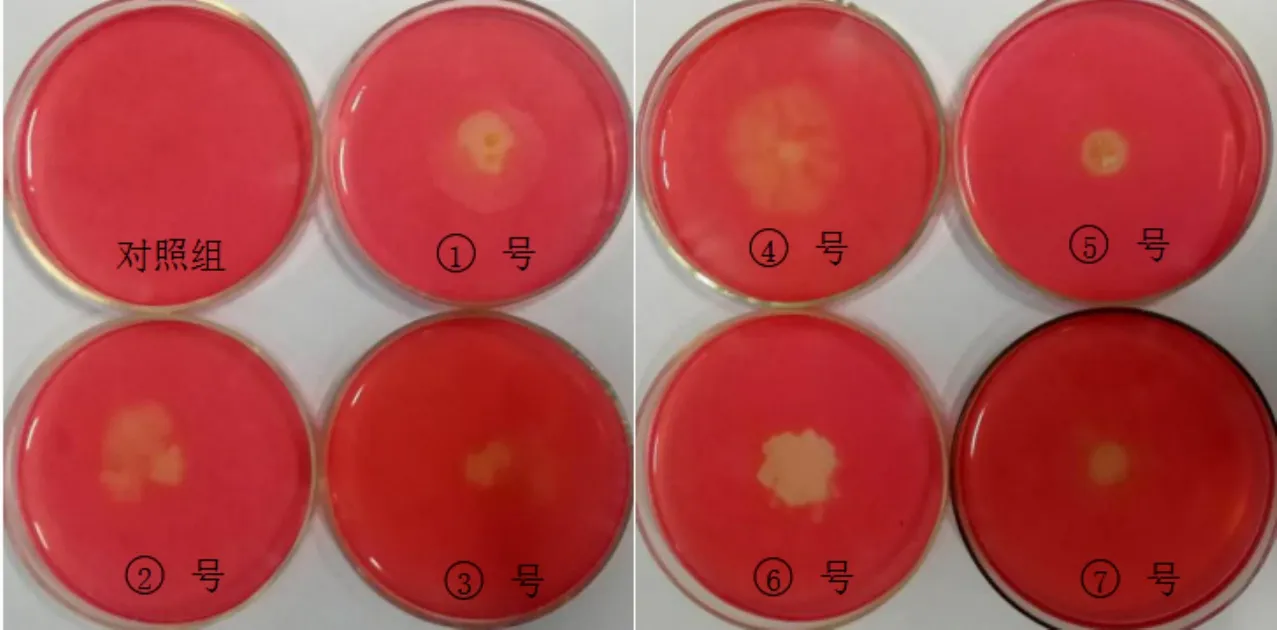
图1 透明圈对比图

表2 透明圈直径与菌落直径比值大小
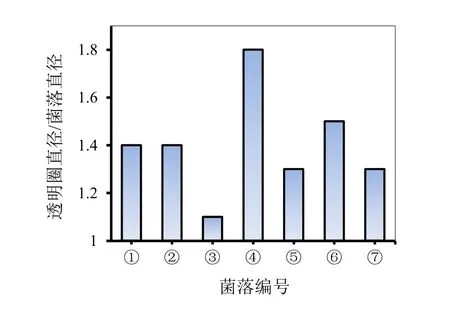
图2 不同菌系透明圈直径与菌落直径对比图

图3 葡萄糖标准曲线
由于刚果红染液可以与纤维素类物质相互结合,所以经刚果红染色后的复合物会呈现出红色。但如果培养基中纤维素类物质已经被分解,刚果红则因无可结合受体而在脱色中被洗涤掉,导致培养基中呈现出以菌落为中心的透明圈,叶姜瑜等人认为能够利用透明圈的是否产生作为微生物菌落是否具有产生纤维素酶能力的判断依据[9]。高榕等人又进一步的提出,可以利用透明圈直径和菌落直径的比值大小来判断菌种降解纤维素能力的大小,这种方法也适合于实践应用中。而后来大量的研究结果也证实了其所具备的可参考价值,并且应用于图2不同菌系透明圈直径与菌落直径对比图的实际操作中[10]。根据表2中的测量结果对比可以初步判断不同菌系产纤维素酶活力的大小为:④>⑥>①≈②>⑤≈⑦>③。
2.2 纤维素降解菌的复筛
2.2.1 葡萄糖标准曲线的测定
图3为葡萄糖标准曲线图。
2.2.2 不同菌株的酶活力大小测定
能够将纤维素水解生成葡萄糖的一系列酶被统称为纤维素酶,为包含多种功能相似酶的复合酶系的统称。根据纤维素酶在作用过程中催化的功能和性质差异,可基本将其分为三类:内切β-1,4-葡聚糖苷酶或称Cx酶即为CMC酶,外切β-1,4-葡聚糖苷酶也可称为C1酶,以及β-葡萄糖苷酶[11]。
纤维素酶对纤维的降解机理有好多种说法,其中一种C1-Cx假说认为,在纤维素的水解过程中CMC酶起到至关重要的作用,不仅如此,CMC酶对纤维素大分子水解生成纤维二糖和三糖的过程也有很大影响,因此其可以作为纤维素酶能力强弱的一个重要判断依据[12]。
而纤维素酶在以滤纸条为底物进行降解时所体现出的酶活性被称为FPA酶活力,因滤纸中的纤维素结构较松散的结晶度和聚合度,使其较容易被降解利用,故FPA酶活力一般可视作一个纤维素酶系的总酶活力大小判断依据,不同酶系之间的协同作用大小既是通过FPA酶活力体现的。将初筛所取得的7种菌系分别接种到CMC-Na液体培养基中振荡培养,测定纤维素酶活。
7种菌系酶活力大小如图4、图5所示。根据两图显示结果可知不仅不同种菌株产生的同一种酶活力之间存在不同,而且同一种菌株产生不同酶的能力大小也存在差异。而纤维素的降解过程是在多种酶的协同参与下完成的,由于单一的菌株所产酶的功能和性质都具有一定的局限性,所以不能靠单一的菌种来提供降解纤维素的全部酶系。所以为了进一步实现高效降解纤维素的目标,需要结合不同功能比较强的酶协同作用。故结合图2中透明圈直径与菌落直径的比值对比以及图4、图5中对不同菌系酶活的大小比较可得出④号酶系的综合能力较强,能够用来与化学法预处理组进行进一步的秸秆降解。

图4 不同菌系CMC酶活力比较
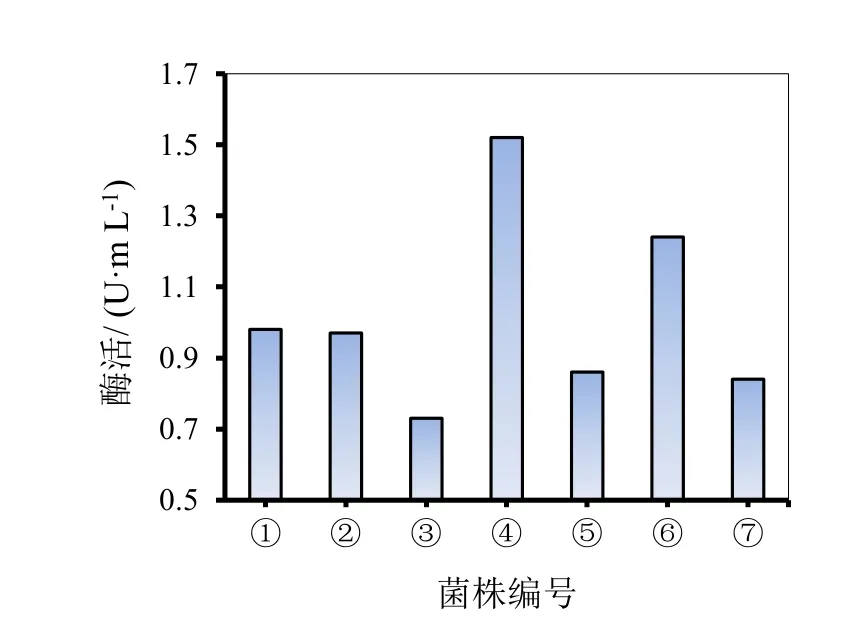
图5 不同菌系FPA酶活力比较
2.3 降解工艺的确定
④号jw-1和jw-2复合菌系与不同浓度酸、碱预处理组结合降解后各组的失重率如图6、图7所示,由两图可知复合菌系与10% NaOH降解效果最佳,失重率可达76.8%。故选定10% NaOH预处理结合木霉jw-1与jw-2复合菌系为降解玉米秸秆效果最优工艺。

图6 不同浓度NaOH预处理组失重率

图7 不同浓度冰乙酸预处理组失重率
3 结论
研究结果表明,在复合菌系的构建中,通过对透明圈与菌落直径比值大小的对比可知,木霉jw-1与木霉jw-2产纤维素酶能力较高,透明圈与菌落直径比可达到1.8,而通过CMC酶活与FPA酶活大小的比较可得出jw-1与jw-2产纤维素酶活力最高,CMC酶活为2.76 U/mL,FPA酶活为1.52 U/mL;在化学预处理与菌系结合降解工艺的筛选中,10% NaOH与 jw-1和 jw-2复合菌系结合降解效果最好,降解率可达76.8%。
与前人研究结果相比,本实验在化学法预处理中得出添加10% NaOH溶液对秸秆预处理降解效果最好的结论,这与李轶等[6]在试验中添加10% NaOH溶液后加入绿色木霉的处理方式对秸秆木质素的降解效果较好且降解率达到39.28%的研究结果一致。本研究意在利用两株纤维素酶高产菌优化预处理工艺,并取得了可靠的分析结果。在复合菌系的构建中,将3种纤维素酶产量高的菌种进行混合筛选,并且最佳工艺降解效率达到了76.8%,与单一菌种处理相比提高了1.9倍。但对于处理原材料的选择方面,本研究仅选取玉米秸秆作为实验原材料,可在以后的研究中适当增加材料的选取种类,对其他农作物秸秆进行有关研究,以便更好的发挥其实际应用价值。
