百合磷茎中Regaloside A、Acetylregaloside C与Regaloside B高速逆流色谱分离及生物活性研究
2018-10-16刘仲华肖文军傅冬和谢红旗曾建国
陆 英,刘仲华,肖文军,傅冬和,谢红旗,曾建国
(1.湖南农业大学 园艺园林学院,湖南 长沙 410128;2.湖南农业大学 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;3.国家中药材生产(湖南)技术中心,湖南 长沙 410128)
百合(Liliaceae)是多年生草本植物,全世界约有90多种,我国约有46种18个变种,其中卷丹(LiliumlancifoliumThunb)、百合(LiliumbrowniiF.E.Brown var.viridulumBaker)或细叶百合(L.pumilumDC.)的干燥肉质鳞茎是我国药典中记载的药用品种,也是民间广泛使用的药食同源植物。《中华人民共和国药典》中所载百合的功效为养阴清肺、清心安神。《神农本草经》认为百合“主邪气腹胀、心痛。利大小便,补中益气”。《本草述》中记载,“百合之功,在益气而兼之利气”。现代药理研究表明,百合在抗抑郁[1]、抗肿瘤[2]、降血糖[3]、抗氧化[4]、免疫调节[5]等方面具有很好的疗效。百合中除富含对人体有益的营养元素外,研究人员还从不同品种的百合磷茎及地上部分分离出酚酸甘油酯苷、酚酸甘油酯、甾体皂苷、生物碱、甘油苷、黄酮等多种化学成分[6-13]。现代药理研究也逐步阐释并挖掘百合的传统功效,但由于百合中化学成分制备繁琐复杂,重现性差,目前对其药理研究集中于有效部位、有效总成分,对单体化合物活性的研究很少,功能物质有待进一步阐明。2015 年版《中华人民共和国药典》也仅通过性状和薄层鉴别来控制百合质量,缺乏有效成分的量化标准。
高速逆流色谱(HSCCC)是近年来发展的一种液-液分配色谱技术,具有操作简便、重现性好、制备量大的特点,广泛用于天然活性物质的制备[14-15]。Luo等[14]以正己烷-乙酸乙酯-甲醇-0.05%三氟乙酸水(3∶5∶3∶5,体积比)为溶剂结合HSCCC技术从卷丹百合中分离得到7个酚酸甘油酯化合物,并对其体外抗氧化作用做了初步研究。然而,由于品种不同,卷丹百合与百合在化学成分上有一定差异,本文建立了HSCCC分离百合(LiliumbrowniiF.E.Brown var.viridulumBaker)中3个酚酸甘油酯苷化合物的方法,并对化合物的抗氧化性及其对猪胰α-淀粉酶活性的影响进行了初步研究,首次发现此3种化合物对α-淀粉酶活性有一定的促进作用,该结果可为进一步研究百合的消食益气功能提供一定的科学依据。
1 实验部分
1.1 仪器、试剂与材料
TBE-300A型高速逆流色谱仪(内径1.6 mm,柱容积280 mL,上海同田生化技术有限公司);LC-20 A高效液相色谱仪(日本岛津公司);721紫外可见分光光度计(上海仪电分析仪器有限公司);RE-52AA 旋转蒸发器(上海亚荣生化仪器厂);MODULYOD-230冷冻干燥机(美国热电公司);AUW220D电子天平(日本岛津公司)。
甲醇(色谱纯,美国天地公司);乙酸乙酯、正丁醇、甲醇(分析纯,天津市恒兴化学试剂制造有限公司);乙酸(分析纯,国药集团化学试剂有限公司);95%乙醇为食用级;1,1-二苯基-2-三硝基苯肼(DPPH,东京化成工业株式会社);α-淀粉酶(Sigma 公司)。
百合购于湖南省龙山县(品种为LiliumbrowniiF.E.Brown var.viridulumBaker),置于50 ℃烘箱中干燥,粉碎备用。
1.2 高效液相色谱(HPLC)分析条件
采用WondasilTMC18(4.6 mm×250 mm)色谱柱;流动相:A为水,B为甲醇,梯度洗脱程序:0~40 min,20%~80%B;流速1.0 mL/min;柱温:30 ℃,进样量20 μL。
1.3 百合磷茎提取物的制备
取830 g干燥百合粉,加入6倍质量的60% 乙醇,于60 ℃水浴提取3次,每次1 h,合并滤液,减压浓缩至无醇味(约3 200 mL)。将该提取液以26 mL/min流速通过装有800 mL D101大孔吸附树脂的层析柱(4.6 cm×48 cm)。吸附后静置0.5 h,用1 600 mL蒸馏水淋洗除去杂质,再用70%乙醇洗至洗脱液颜色很浅(流速均为26 mL/min),将乙醇洗脱液(2 900 mL)减压浓缩至小于200 mL后冷冻干燥,即得百合磷茎过柱提取物6.5 g,置于冰箱中避光保存,作为HSCCC的进样原料。
1.4 高速逆流色谱(HSCCC)分离过程
按乙酸乙酯-正丁醇-0.5%乙酸水溶液(3∶1.5∶5,体积比)配制溶剂体系,将所有溶剂按体积比充分混合,静置分层过夜后;将上相与下相分离,超声脱气10 min后将上相溶剂以20 mL/min的流速泵入主机管路,待上相溶剂充满管路后,再以850 r/min 转速正向旋转,柱温箱25 ℃,将下相以2 mL/min 的流速泵入,检测波长280 nm。平衡后取“1.3”制备的样品250 mg,用20 mL下相溶解,进样,80 min后进行图谱采集,根据峰形手动分段收集流出液,减压浓缩后冷冻干燥,得粉末状化合物1、2、3。
1.5 化合物结构的鉴定
采用质谱(MS)、核磁共振(1H NMR 和13C NMR)对3个化合物进行结构鉴定。质谱采用电喷雾电离源ESI,负离子模式;核磁共振样品用氘代甲醇(CD3OD)溶解,频率为400 MHz。
1.6 化合物的生物化学研究
化合物对DPPH的自由基清除作用研究参照文献[16],对脂质过氧化抑制作用研究参照文献[17],对猪胰α-淀粉酶活性影响的研究参照文献[18]。
2 结果与讨论
2.1 百合磷茎提取物的HPLC分析
分别考察了甲醇-水、乙腈-水作为流动相对百合乙醇提取液中各组分的分离效果,发现两种体系下,提取液中各主要色谱峰均能获得满意的分离且峰形基本一致,综合溶剂的环保性能,最终选择甲醇-水溶液为流动相。在“1.2”分析条件下,百合乙醇提取液的HPLC谱图见图1。PDA检测器显示,HPLC图中各色谱峰均具有相似的紫外吸收光谱,且在311 nm左右有最大吸收,在280 nm处有肩峰,其中1、2、3号峰相对较高,确定为分离目标组分。

2.2 百合磷茎提取物的制备
2.2.1乙醇体积分数的选择实验考察了不同体积分数(20%、40%、60%、80%)乙醇对提取效果的影响。结果表明,60%乙醇对百合磷茎中目标化合物的提取效果最佳。
2.2.2HSCCC上样原料的制备百合磷茎60%乙醇提取液中除目标组分外还含有糖、淀粉、蛋白质等杂质,这不仅会降低目标组分的含量,还可能在后续高速逆流分离时造成固定相流失,因此,本实验采用大孔吸附树脂吸附目标组分,再采用70%乙醇洗脱的方式去除杂质,使目标组分得到较好的富集。
2.3 HSCCC溶剂体系的选择及分离效果
HSCCC作为一种液-液分配色谱,可供选择的溶剂体系比较广泛,可通过改变溶剂体系实现对不同极性物质的分离,因此溶剂体系的选择对分离效果至关重要,一般可通过化合物K值确定。目标组分具有一定的亲水性,实验考察了亲水性较强的溶剂体系乙酸乙酯-甲醇-水(5∶5∶1,体系1)、乙酸乙酯-正丁醇-水(3∶2∶5,体系2)和乙酸乙酯-正丁醇-水(3∶1.5∶5,体系3)对分离的影响。结果表明,体系1中化合物1、2的K值太小,体系2 中化合物1、3的K值很接近,难以分开。体系3中加入0.5%乙酸后,对化合物1、2的K值影响不大,但使化合物3的K值增大,经HSCCC上机分离后,化合物1、2、3能实现完全分离,因此选择溶剂体系乙酸乙酯-正丁醇-水(0.5%乙酸,3∶1.5∶5)。
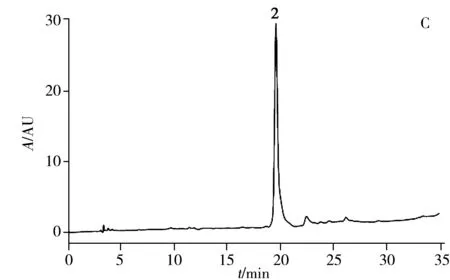
在“1.4”条件下HSCCC分离的色谱图见图2,根据峰形收集得到3个化合物,经浓缩、冷冻干燥并进行HPLC分析得到4.2 mg纯度为96.2%的化合物1,2.3 mg纯度为95.1%的化合物2,5.8 mg纯度为98.8%的化合物3(在254 nm波长下采用面积归一法计算)。HSCCC分离图谱及HPLC色谱图见图2。

2.4 化合物结构的鉴定
化合物1:浅黄色粉末,MSm/z399.1372[M-H]+;1H NMR(CD3OD):7.45(2H,d,J= 8.1 Hz,H-2’,6’),δ7.65(1H,d,J= 16.0 Hz,H-7’),6.80(2H,d,J= 8.1 Hz,H-3’,5’),6.36(1H,d,J= 16.0 Hz,H-8’),4.29~3.00(H-1-3,H-1’’-6’’);13C NMR(CD3OD):δ67.45(C-1),70.58(C-2),72.30(C-3),127.91(C-1’),132.00(C-2’),117.60(C-3’),162.07(C-4’),117.60(C-5’),132.00(C-6’),147.59(C-7’),115.69(C-8’),169.95(C-9’),105.45(C-1’’),75.85(C-2’’),78.73(C-3’’),72.71(C-4’’),78.63(C-5’’),63.45(C-6’’)。MS、1H NMR及13C NMR均与文献[6]相符,确定为:(2S)-1-O-p-coumaroyl-3-O-β-D-glucopyranosylylycerol((2S)-1-O-p-香豆酰-3-β-葡萄糖甘油酯苷,俗名王百合苷A,Regaloside A),分子式为C18H24O10。
化合物2:黄色粉末,MSm/z457.1442[M-H]-;1H NMR(CD3OD):6.26(1H,d,J= 16.0 Hz,H-8),6.77(1H,d,J= 8.2 Hz,H-5),6.95(1H,dd,J= 1.8,8.0 Hz,H-6),7.04(1H,d,J=1.8 Hz,H-2),7.54(1H,d,J= 16.0 Hz,H-7),δ1.95(3H,s,CH3),4.50~3.19(H-1-3,H-1’’-6’’);13C NMR(CD3OD):δ75.92(C-1),64.67(C-2),78.66(C-3),127.36(C-1’),123.85(C-2’),147.60(C-3’),150.50(C-4’),115.92(C-5’),114.66(C-6’),148.24(C-7’),117.27(C-8’),169.60(C-9’),172.99(COCH3),21.77(COCH3),105.47(C-1’’),78.66(C-2’’),75.74(C-3’’),69.53(C-4’’),72.28(C-5’’),63.45(C-6’’)。MS、1H NMR及13C NMR均与文献[10]相符,确定为:(2S)-1-O-acetyl caffeoyl-3-O-β-D-glucopyranosylylycerol((2S)-1-O-乙酰咖啡酰-3-O-β-D-葡萄糖甘油酯苷,俗名乙酰化王百合苷C,Acetylregaloside C),分子式为C20H26O12。



图3 化合物1~3的化学结构式Fig.3 Chemical structures of compounds 1-3
化合物3:浅黄色粉末,MSm/z441.1478[M-H]-;1H NMR(CD3OD):7.30(2H,d,J= 8.9 Hz,H-2’,6’),δ7.45(1H,d,J= 16.1 Hz,H-7’),6.63(2H,d,J= 8.9 Hz,H-3’,5’),6.16(1H,d,J= 16.0 Hz,H-8’),4.34~3.00(H-1-3,H-1’’-6’’),1.85(3H,s,OCH3);13C NMR(CD3OD):δ69.53(C-1),75.73(C-2),64.70(C-3),173.05(COCH3),21.77(COCH3),127.80(C-1’),132.07(C-2’),117.62(C-3’),162.16(C-4’),117.62(C-5’),131.07(C-6’),147.85(C-7’),115.34(C-8’),169.63(C-9’),105.44(C-1’’),72.82(C-2’’),78.78(C-3’’),72.24(C-4’’),78.66(C-5’’),63.47(C-6’’);MS、1H NMR及13C NMR均与文献[6]相符,确定为(2S)-1-O-p-coumaroyl-2-O-β-D-glucopyranosylylycerol-3-O-acetylglycerol((2S)-1-O-p-香豆酰-2-O-β-D-葡萄糖-3-O-乙酰甘油酯苷,俗名王百合苷B,Regaloside B),分子式为C20H26O11。
3种化合物的化学结构式见图3。
2.5 化合物的抗氧化活性研究
3种化合物对DPPH自由基的清除作用见表1,化合物1、3对DPPH自由基清除作用很弱,体系中样品质量浓度最大时也仅为14%左右,二者间无显著差异。化合物2对DPPH自由基清除作用较强,且呈显著的量效关系(R2=0.996),半抑制浓度IC50为27.97 mg/L。阳性对照抗氧化剂VC、化合物2以及化合物1、3间有显著差异,清除DPPH自由基强弱为:VC>化合物2>化合物1≈化合物3。

表1 化合物对DPPH自由基清除作用(n=3)Table 1 Antioxidative activities of compounds on scaveging DPPH(n=3)
* there is no significant difference in the same letters;there are significant differences between different letters,p<0.01(相同字母表示无显著性差异;不同字母表示有显著性差异,p<0.01)
化合物对脂质的过氧化抑制作用见表2,化合物1、3对脂质过氧化抑制作用无显著差异,当体系样品浓度进一步增大时其抑制率增加缓慢,样品浓度最大时也低于50%。化合物2对脂质过氧化抑制很强,在实验最低浓度时即可达到85%左右,在低浓度时与VC有显著差异,但在高浓度时无显著差异;化合物1及化合物3在不同浓度下均无显著性差异。化合物对脂质过氧化抑制作用强弱为:化合物2>VC>化合物1≈化合物3。

表2 化合物对脂质过氧化抑制作用(n=3)Table 2 Inhibitory effects of compounds on lipid peroxidation(n=3)
* there is no significant difference in the same letters;there are significant differences between different letters,p<0.01(相同字母表示无显著性差异;不同字母表示有显著性差异,p<0.01)
文献[14]对卷丹百合中7个酚酸甘油酯化合物DPPH清除作用的IC50为13~1 265 mg/L,不同化合物之间差异很大,1-O-p-coumaroylglycerol 及1,3-O-di-p-coumaroylglycerol 的活性远弱于1-O-caffeoyl-O-p-coumaroylglycerol及1,2-O-p-diferuloylycerol。本研究也表明,香豆酰基甘油酯苷化合物对自由清除作用远弱于咖啡酰基甘油酯苷。同时,化合物对脂质的过氧化抑制作用与对自由基清除作用虽然效果不同,但规律相似,因此可以推测,化合物对脂质过氧化的抑制作用与化合物结构中与甘油形成酯的酸相关,咖啡酸强于对香豆酸。
2.6 化合物对淀粉酶活性的影响
实验表明,分离的3个化合物对淀粉酶活性具有一定的促进作用。由表3可见,3个化合物在不同浓度时对α-淀粉酶活性有一定的增强作用,但化合物间无显著性差异。

表3 化合物对淀粉酶的促进作用(n=3)Table 3 Sitmulation of coumpounds on α-amylase(n=3)
* there is no significant difference in the same letters;there are significant differences between different letters,p<0.01(相同字母表示无显著性差异;不同字母表示有显著性差异,p<0.01)
3 结 论
本文以乙酸乙酯-正丁醇-水(0.5%乙酸,3∶1.5∶5)为溶剂体系,通过高速逆流色谱从百合中制备分离得到3个化合物,经质谱及核磁共振鉴定为酚酸甘油酯苷化合物。对化合物的抗氧化作用和对α-淀粉酶活性影响进行了初步研究,结果表明,Regaloside A 与Regalside B 对DPPH自由基的清除作用很小,但对脂质过氧化具有一定的抑制作用;Acetylregaloside C 对自由基清除作用和对脂质过氧化作用均较强,推测香豆酰基甘油酯苷化合物的抗氧化作用弱于咖啡酰基甘油酯苷。本实验首次发现3个化合物对α-淀粉酶活性具有一定的促进作用,但化合物间无显著差异。研究结果为中药百合的药理研究及质量控制中化学成分的高效稳定制备提供了方法。
