石墨烯-壳聚糖修饰电极构建石杉碱甲免疫传感器
2018-10-16陈媛媛刘媛媛尤金坤张红艳余宇燕
陈媛媛,高 璇,刘媛媛,尤金坤,张红艳,余宇燕
(福建中医药大学 药学院, 福建 福州 350122)
石杉碱甲(Huperzine A, HupA)是我国科学家刘嘉森于1986年从草药千层塔(蛇足石杉)中分离得到的一种新型石松类生物碱有效单体[1]。作为一种天然、高效、可逆的乙酰胆碱酯酶(AchE)抑制剂,近年来从蛇足石杉中提取的石杉碱甲被广泛用于治疗轻、中度老年性痴呆(又名阿尔兹海默症)。虽然石杉碱甲是一种有潜力的治疗老年痴呆的药物,但其在植物中含量较低,存在形式多样,还伴有成分复杂、结构类似的共生生物碱,可供利用的野生资源极其有限,利用常规方法获得大量天然的石杉碱甲相当困难[2]。除蛇足石杉外,还有多种植物如金线莲[3]、伏贴石杉、皱边石杉、四川石杉、金丝条马尾杉、小接筋草等也含有石杉碱甲成分[4],这促使人们开始研究从其他植物中提取石杉碱甲。因此,建立快速、灵敏度高、特异性强的石杉碱甲检测方法,可为获取石杉碱甲提供新方向,且对石杉碱甲相关药物的质量控制和检测水平提高具有重要作用。
目前,测定石杉碱甲的常用方法有薄层扫描法[5]、高效液相色谱法[1]、液相色谱-串联质谱联用法[6]、酶联免疫试剂盒[7]等。电化学分析法是基于物质在溶液中的电化学性质的一类仪器分析方法,与常用检测方法相比,该法操作更简便、成本较低、灵敏度高,近年来被广泛应用[8]。HupA具有抗氧化作用,利用该特点可研究其与[Fe(CN)6]3-/4-氧化还原体系的相互作用以建立检测HupA的电化学方法。本实验室前期建立了应用裸玻碳电极检测石杉碱甲的电化学方法[9],但该方法的检测灵敏度与特异性存在局限性。
电化学免疫传感器分析法具有电化学分析的高灵敏性以及免疫分析的高特异性,近年来发展迅速[10]。壳聚糖(CS)具有优异的成膜能力和良好的附着力,但绝缘性导致其在电化学传感器开发中的应用受限[11-12]。随着纳米材料与纳米技术的飞速发展, 纳米材料的引入成为制备高性能电化学生物传感器的有效途径。Au、Ag、Pt等贵金属[13-15]以及碳纳米管[16]等纳米材料均已成功用于固定生物酶。还原态氧化石墨烯(rGO)是一类新型的二维蜂窝状碳纳米材料,具有较高的比表面积和很多含氧基团,可提供较多的活性位点,且其电子传导能力和生物相容性好,作为碳材料在传感器构建领域具有很好的应用潜力[17]。将石墨烯/壳聚糖制成复合物可达到促进电极表面的电子转移,有效固定抗体以及其他分子的目的[18-20]。本研究通过采用石墨烯-壳聚糖复合物修饰玻碳电极,将HupA抗体固定于电极上构建石杉碱甲免疫传感器,建立了一种操作简单、灵敏度高、特异性强的检测石杉碱甲的新方法。该方法为获取HupA提供了新方向,对HupA相关药物质量的控制和检测水平提高具有一定的积极意义。
1 实验部分
1.1 仪器与试剂
高分辨率透射电子显微镜(日本日立公司)。FiveEasy Plus型精密pH计、ME204E电子分析天平(梅特勒-托利多仪器上海有限公司);KQ116型超声波清洗器(昆山市超声仪器有限公司)。Ingsen-1030电化学分析仪(广州盈思传感仪器有限公司),辰华660D 电化学工作站(上海辰华仪器有限公司 ),所有电化学实验均通过三电极系统完成:Ag/AgCl 为参比电极,铂电极为对电极,修饰的玻碳电极为工作电极。
1 mg/mL石墨烯分散液(rGO,南京先丰纳米有限公司);石杉碱甲单抗(anti-HupA实验室自制);KCl、KH2PO4、Na2HPO4·12H2O、K3[Fe(CN)6]、K4[Fe(CN)6]·3H2O(西陇化工股份有限公司);石杉碱甲对照品(>99%,上海源叶生物科技有限公司);壳聚糖(CS)、N-羟基丁二酰亚胺(NHS)(国药集团化学试剂有限公司);N,N-二甲基甲酰胺(DMF)、1-乙基(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl)(上海阿拉丁生化科技股份有限公司);牛血清白蛋白(BSA,北京索莱宝科技有限公司);Tween-20(北京博奥拓达科技有限公司);金线莲干燥全草购自福建省同春药业有限公司,产地广西,经福建中医药大学范世明教授鉴定。
1.2 实验方法
1.2.1rGO-CS复合物的制备准确称取0.002 g壳聚糖加入到10 mL 1%乙酸中,持续搅拌至无气泡后得到透明壳聚糖溶液,于4 ℃储存。准确量取5 mL rGO水溶液(1 g/L)于5 mL离心管中离心,除去上清液,加入DMF定容至5 mL,超声溶解30 min,得到分散均匀的石墨烯悬浊液。取4 mL该悬浊液加至2 mL壳聚糖乙酸溶液中,超声分散20 min,得到石墨烯-壳聚糖悬浊液(rGO-CS),于4 ℃保存待用。
1.2.2电化学免疫传感器的制备依次用0.3、0.05 μm 的氧化铝粉末将玻碳电极抛光成镜面,并先后于无水乙醇和水中各超声5 min,将电极在室温下晾干。于GCE表面修饰10 μL的rGO-CS溶液并使其在室温下自然风干后,将修饰好的电极置于400 mmol/L EDC 和100 mmol/L NHS 混合溶液中活化40 min,取出后将15 μL anti-HupA 溶液修饰于电极上,置于37 ℃孵育2 h,最后将电极于37 ℃下在含3%BSA的0.1 mol/L磷酸盐缓冲液(PBS,pH 7.4)中浸泡50 min,以封闭活性基团,得到rCO-GS 复合材料修饰的电化学免疫传感器,用含0.05%吐温-20的磷酸盐缓冲液(PBST,pH 7.4)冲洗3次,于4 ℃保存待用。电化学免疫传感器制备如图1所示。
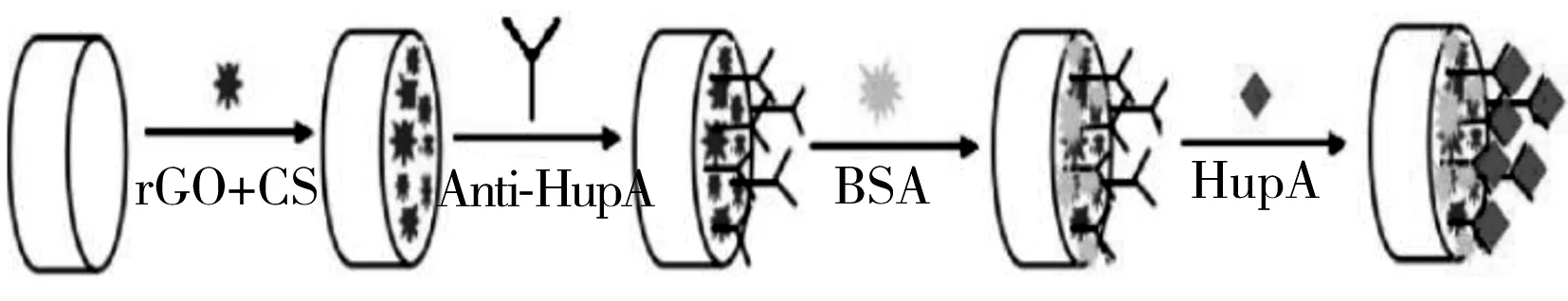
图1 电化学免疫传感器制备图Fig.1 Preparation of HupA electrochemical immunosensor
1.2.3不同修饰电极的电化学表征采用CV法以及EIS法研究电极修饰过程中不同修饰电极的电化学行为。CV法的电位为-0.2~0.6 V,扫速为50 mV/s;EIS的检测频率为0.1~105Hz。
1.2.4电化学免疫传感器对HupA的电流响应测试将自制的石杉碱甲电化学免疫传感器在不同浓度的HupA标准溶液中于37 ℃下孵育15 min,然后置于测试底液中,在室温下进行DPV测量,脉冲范围为-0.2~0.6 V,脉冲周期400 mV/s,间隔时间为50 ms,记录峰电流变化值ΔIp,对不同浓度HupA标准品作标准曲线,并用DPV法检测样品中的石杉碱甲浓度。
2 结果与讨论
2.1 rGO-CS复合物的透射电镜(TEM)表征
图2为rGO和 rGO-CS复合物的TEM表征图,还原氧化态石墨烯呈现均匀的片状结构(图2A),壳聚糖具有良好的成膜性,且还原氧化态石墨烯在壳聚糖溶液中均匀分散(图2B),该表征结果与文献[11]一致。


图2 rGO(A)及rGO-CS复合物(B)的TEM图Fig.2 TEM images of rGO(A)and rGO-CS complex(B)
2.2 不同修饰电极的电化学表征

图3 不同修饰电极交流阻抗图Fig.3 AC impedance diagrams of different modified electrodes
交流阻抗法(EIS)是研究修饰电极表面特性的有效方法,通过EIS法研究了电极修饰过程中不同修饰电极在0.1 mol/L KCl+10 mmol/L K3[Fe(CN)6]-K4[Fe(CN)6]+0.1 mol/L PBS(pH 7.0)测试底液中的电化学行为。图3显示了不同修饰过程中电极的奈奎斯特曲线。由图可知:裸玻碳GCE表面修饰CS后,可得到显著增强的阻抗图谱,这表明CS已被成功固定在电极表面,并阻碍了电子的转移。当rGO-CS修饰到GCE上,rGO-CS/GCE的交流阻抗图几乎为一条直线,表明电极材料优异的导电性使电子在电极表面与测试底液之间的转移非常容易。当将anti-HupA修饰到rGO-CS/GCE电极后,谱图中半圆的直径增大,这是由于生物大分子抗体具有绝缘性质。其后将修饰好的电极在BSA中封闭,得到的阻抗较大,这是由于BSA封闭了电极上剩余的活性位点所致。上述研究结果表明构建的生物传感界面可成功将anti-HupA固定。
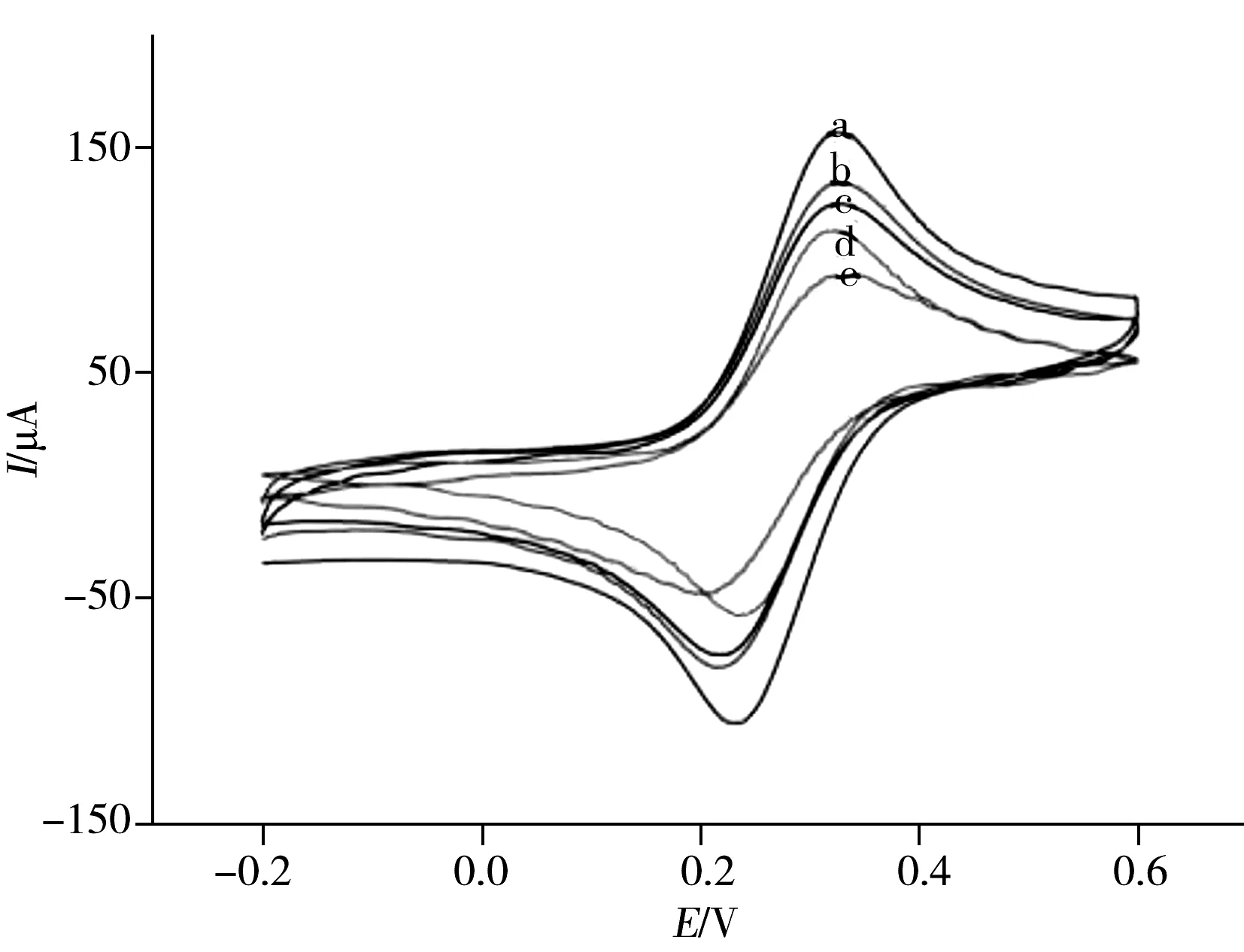
图4 不同修饰电极的循环伏安曲线Fig.4 Cyclic voltammograms of different modified electrodesa.rGO-CS/GCE, b.anti-HupA/rGO-CS/GCE, c.BSA/anti-HupA/rGO-CS/GCE, d.bare GCE, e.CS/GCE
CV曲线用于表征修饰电极过程中电子的传递速率,图4为不同修饰电极在0.1 mol/L KCl+10 mmol/L K3[Fe(CN)6]+0.1 mol/L PBS(pH 7.0)测试底液中的循环伏安曲线。裸玻碳电极CV图(曲线d)有1对可逆的氧化还原峰,当在裸电极上修饰壳聚糖后(曲线e),响应电流明显下降,这是由于壳聚糖对电极表面的电子转移有明显的阻碍作用;经石墨烯-壳聚糖复合膜修饰之后电极电流明显增大(曲线a),表明石墨烯能提高修饰电极的电化学性能,石墨烯-壳聚糖复合膜有利于电化学方法检测灵敏度的提高。当rGO-CS/GCE电极修饰上anti-HupA后,氧化还原电流减小(曲线b),表明anti-HupA已被成功固定在电极表面;修饰好的电极用BSA封闭50 min后,其峰电流进一步减小(曲线c),说明BSA已成功修饰在电极表面,封闭了电极上修饰抗体后剩余的活性位点。研究结果表明,rGO-CS纳米复合物对于HupA的电化学传感和传感界面的成功构建具有重要作用。
2.3 实验条件优化
2.3.1不同扫速的影响考察了扫速对氧化还原峰电流的影响,在10 mmol/L K3[Fe(CN)6]+0.1 mol/L KCl+0.1 mol/L PBS(pH 7.0)测试底液中,将工作电极以不同扫速在-0.2~0.6 V电位范围内进行CV扫描。结果显示,在10~1 000 mV/s扫速范围内,随着扫速的增加,氧化峰电流明显增大,还原峰电流明显减小。在100~900 mV/s范围内,峰电流与扫速呈良好的线性关系,线性方程分别为Ip=0.787 5x+213.88(r=0.992 0);Ip=-0.626 4x-199.94(r=0.991 8),说明电极表面主要是受吸附控制的电极过程。
2.3.2抗体修饰量的选择分别用4、6、8、10、15、20 μL anti-HupA(100 mg/L)修饰电极,于相同条件下孵育后,采用DPV法于10 mmol/L K3[Fe(CN)6]+0.1 mol/L KCl+0.1 mol/L PBS(pH 7.0)测试底液中检测修饰电极的电流响应。结果表明,随着抗体修饰量的增加,固定到免疫传感器上的anti-HupA增多,造成峰电流减小。抗体量大于15 μL时,峰电流变化趋于平缓,说明此时抗体固定量已饱和,继续增加用量将会出现抗体量过剩,因此实验选择15 μL作为抗体最佳修饰量。
2.3.3测试底液浓度的选择测试底液浓度对免疫传感器的电化学响应灵敏度有重要影响。在K3[Fe(CN)6]+0.1 mol/L KCl+0.1 mol/L PBS(pH 7.0)测试底液中,分别考察了不同浓度(1、5、10、15、20、25 mmol/L)K3[Fe(CN)6]对免疫传感器电化学响应值的影响。将制备的免疫传感器置于HupA待测液中孵育后,分别在上述不同浓度的测试底液中进行DPV扫描,结果显示在15 mmol/L K3[Fe(CN)6]测试底液中,免疫传感器免疫反应前后的电流变化量最大,此浓度下免疫传感器的灵敏度最高,因此实验选择浓度为15 mmol/L K3[Fe(CN)6]+0.1 mol/L KCl+0.1 mol/L PBS(pH 7.0)的测试底液。
2.3.4测试底液pH值的选择考察了测试底液pH值分别为6.0、6.5、7.0、7.5、8.0时对免疫传感器电化学响应值的影响。将制备的免疫传感器置于HupA待测液中孵育后,分别在上述不同pH值的测试底液中进行DPV扫描。结果显示,在pH 6.5的测试底液中,免疫传感器免疫反应前后电流变化量最大。因此,实验选择15 mmol/L K3[Fe(CN)6]+0.1 mol/L KCl+0.1 mol/L PBS(pH 6.5)的测试底液。
2.3.5孵育时间的选择抗原抗体反应需要一定的时间,因此孵育时间对免疫反应非常重要。将石杉碱甲免疫传感器放入1.0×10-6mol/L HupA溶液中反应不同时间,利用DPV法考察了孵育时间(2~25 min)对免疫反应的影响。结果显示,在2~15 min范围内DPV响应电流差值随孵育时间的延长而增大,说明免疫反应随着时间的延长不断进行。当反应时间达到15 min后,电流变化趋于平缓,说明抗原抗体在15 min后已基本反应完全。因此实验选择15 min作为最佳孵育时间。
2.3.6孵育温度的选择通常升高抗原的孵育温度有利于抗原与抗体反应的进行,但也可能导致抗体失活,故选择适宜的孵育温度十分重要。将制备的电化学免疫传感器分别置于1.0×10-6mol/L HupA溶液中于25~50 ℃范围内孵育,利用DPV法研究孵育温度对电流响应的影响。结果显示,在25~37 ℃范围内,ΔI随温度升高不断增大,这是因为抗原抗体的反应程度随温度升高而增强,随着抗原-抗体复合物不断增多,电极表面的电子传递阻力加大,使得响应电流变化值增大。在37 ℃时ΔI达到最大值,当温度高于37 ℃时,电流变化量反而减小,原因是较高的温度会导致抗体失活,使得产生的抗体-抗原复合物减少,电极表面的电子传递阻力减小。因此实验选择37 ℃为最佳孵育温度。
2.4 标准曲线及检出限

图5 不同浓度HupA的差示脉冲伏安曲线Fig.5 DPV curves of electrochemical immunosensor to HupA HupA concentration(a-f):1.0×10-10, 3.0×10-11, 3.0×10-12, 3.0×10-13, 1.0×10-13 , 0 mol/L;insert:ΔI vs lgc
本文选择DPV法对HupA进行定量测定。配制不同浓度的HupA标准溶液,在优化条件下,利用DPV法研究免疫传感器的峰电流变化值与HupA浓度的关系(图5)。由图可知,当溶液中HupA浓度逐渐增大时,抗体与HupA的结合量随之增加,而抗原-抗体复合物的增加使得电极表面的导电能力下降,因此DPV峰电流的降低值ΔI逐渐增大。ΔI值与HupA浓度(c)的对数在1.0×10-13~1.0×10-10mol/L范围内呈良好的线性关系,线性方程为ΔI= 20.629 lgc+ 283.98,r=1.000 0,检出限(S/N=3)为3.0×10-14mol/L。如表1所示,与其他分析方法[1,6-7,9]相比,本文制备的免疫传感器有较高的检测灵敏度。
2.5 免疫传感器的选择性与特异性

表1 与其它分析方法的对比Table 1 Comparison between this method and other analysis methods
在优化条件下,将制备的电化学免疫传感器置于1.0×10-10mol/L的HupA标准溶液中孵育后,测定DPV响应值。在HupA标准溶液中分别加入10倍量的消旋山莨菪碱、丁溴东莨菪碱、阿托品孵育后,利用DPV分别测定,记录电流值。电化学免疫传感器在HupA标准溶液以及分别与3种干扰物共存时的Ip值分别为183.745、179.896、171.01、168.684 μA。数据表明,在加入干扰物的条件下电流变化值较小,说明该免疫传感器具有良好的选择性。
将制备的电化学免疫传感器分别置于HupA和100倍量的消旋山莨菪碱、丁溴东莨菪碱、阿托品中孵育后,记录电流变化值ΔI分别为78.021、3.064、3.945、8.541 μA。可见,该传感器在分别检测100倍量消旋山莨菪碱、丁溴东莨菪碱、阿托品时电流变化值较小,检测石杉碱甲时变化值明显,说明该免疫传感器对HupA具有较强的特异性。
2.6 免疫传感器的重复性与稳定性
将制备的免疫传感器于HupA标准溶液中孵育后,利用DPV法重复测定10次,峰电流变化为3.9%。将该免疫传感器置于4 ℃密闭保存,每隔2 d于相同条件下用DPV法进行检测,1周后电流值为初始值的90.6%,说明电极经rGO/CS复合物修饰后具有良好的生物相容性,可以较长时间保持抗体的活性,从而使石杉碱甲免疫传感器具有较好的重复性与稳定性。
2.7 实际样品的测定与加标回收率
将中药材金线莲粉碎,称取0.6 g干粉于50 mL具塞三角瓶中,加入25 mL 70%的甲醇水溶液,超声提取30 min,过滤,弃初滤液,收集续滤液作为供试品。在优化条件下,采用DPV法测得金线莲提取液中的HupA含量为8.883×10-12mol/L。取适量金线莲提取液3份,分别加入7.5×10-12、9.0×10-12、1.0×10-11mol/L的HupA标准溶液进行加标回收率实验,平行测定3次,得回收率为99.4%~102%,回收率良好。
3 结 论
基于还原态氧化石墨烯rGO的大比表面积和良好导电性,以及rGO/CS复合材料良好的生物相容性,本研究通过将石杉碱甲抗体固定到 rGO/CS 复合膜修饰的玻碳电极表面,制备了高灵敏度的石杉碱甲电化学免疫传感器,通过检测石杉碱甲抗原抗体特异性反应阻断[Fe(CN)6]3-/4-氧化还原反应体系电子转移的电流值变化,建立了检测石杉碱甲的电化学免疫传感器方法。将该法用于实际样品中HupA含量的检测,结果良好。与其他分析方法相比,该免疫传感器具有操作简便、快速、灵敏度高、特异性强且成本低的特点,为HupA的获取提供了新方向,也为HupA相关药物质量的控制和检测提供了新的平台,对药物质量控制的提高具有一定的积极意义。
