液-液萃取/气相色谱-串联质谱测定纸制食品接触材料中9种挥发性全氟化合物前体物的迁移量
2018-10-16张子豪钟怀宁李全忠刘莹峰郑建国
张子豪,肖 前,钟怀宁,李全忠,刘莹峰,李 丹,郑建国
(广东出入境检验检疫局,广东 广州 510623)
全氟化合物(PFCs)是一类人工合成的化合物,因具有优良的化学稳定性、高表面活性及疏水疏油性能,被大量地应用于金属制品、纺织品、食品接触材料等诸多与生活息息相关的领域中[1]。随着对PFCs研究的日益深入,人们发现全氟类化合物能在生物体内富集,且部分全氟化合物具有生殖毒性,会危害人类健康[2-3]。2017年1月,欧洲化学品管理局(ECHA)发布的欧盟REACH法规中包含了7种全氟高关注度物质[3],基于欧盟REACH法规,2017版Oeko-Tex[4]中的全氟化合物增至24种,这将对PFCs的监测和风险评估推向了一个新高度。全氟脂肪醇和全氟磺酰胺类物质分别为全氟羧酸和全氟烷基磺酸类物质的挥发性前体物[5-6],其中1H,1H,2H,2H-全氟癸烷-1-醇(8∶2FTOH)为全氟辛酸(PFOA)的前体,1H,1H,2H,2H-全氟十二醇(10∶2FTOH)为全氟癸酸(PFDA)的前体,十七氟-N-(2-羟乙基)-N-甲基-1-辛基磺酰胺(N-MeFOSE)则为全氟辛烷磺酸(PFOS)的前体。研究表明,摄入人体的挥发性全氟化合物的前体物质通过体内转化最终氧化生成全氟羧酸与全氟烷基磺酸[6-8]。因此,通过摄入挥发性全氟化合物,在体内转化得到全氟酸可能是人体PFCs的主要暴露途径之一[5,8]。
目前,国内外有关全氟化合物的检测技术,主要采用液相色谱-质谱法[9-12]和气相色谱-质谱法[13]。而对于全氟化合物的前体物质全氟脂肪醇、全氟脂肪醇丙烯酸酯和全氟磺酰胺的检测较少,对于纸制食品接触材料中挥发性全氟化合物前体物迁移量的检测方法尚未见报道,因此亟需建立挥发性全氟化合物前体物的检测方法,以降低或控制风险。本文利用气相色谱-串联质谱技术建立了9种挥发性全氟化合物前体物的检测方法,该法灵敏度高、准确可靠,可用于纸制食品接触材料中全氟化合物前体物的检测分析。
1 实验部分
1.1 仪器与试剂
Agilent 7890B-7000C气相色谱-串联质谱仪(美国安捷伦公司),Chemstation和MassHunter软件数据处理系统;DB-5MS毛细管柱30 m×0.25 mm(内径)×0.25 μm(膜厚)色谱柱(美国安捷伦公司);Milli-Q超纯水机(美国密理博公司);可调移液器(德国普兰德公司);10 μL微量注射器。
1H,1H,2H,2H-全氟己烷-1-醇(4∶2FTOH,97.0%)、1H,1H,2H,2H-全氟己醇丙烯酸酯(6∶2FTA,99.0%)、1H,1H,2H,2H-全氟辛烷-1-醇(6∶2FTOH,99.0%)、1H,1H,2H,2H-全氟癸烷-1-醇(8∶2FTOH,99.0%)、1H,1H,2H,2H-全氟十二醇(10∶2FTOH,97.0%)、1H,1H,2H,2H-全氟辛醇丙烯酸酯(8∶2FTA,97.0%)、1H,1H,2H,2H-全氟癸醇丙烯酸酯(10∶2FTA,98.0%)均购自挪威Chiron 公司;十七氟-N-(2-羟乙基)-N-甲基-1-辛基磺酰胺(N-MeFOSE,98.0%)和十七氟-N-(2-羟乙基)-N-乙基-1-辛基磺酰胺(N-EtFOSE,99.0%)均购自德国Dr.Ehrenstorfer GmbH。甲醇、二氯甲烷、乙腈均为HPLC级,购自Tedia公司。
1.2 标准工作溶液
称取一定量的各全氟化合物前体物质系列标准物质,配成50 mg/L的9种全氟化合物单标储备液。移取一定量各单标储备液,配成0.5、5.0 mg/L的全氟化合物前体物质标准混合中间液。
水基模拟物(3%乙酸、10%乙醇、50%乙醇):分别移取0.5 mg/L的全氟化合物前体物质标准混合中间液 20、40、100 μL至10 mL容量瓶中,用对应的水基模拟物定容;分别移取5.0 mg/L的全氟化合物前体物质标准混合中间液20、100、200 μL至10 mL容量瓶中,用对应的水基模拟物定容。将上述6个容量瓶中的溶液分别转入6个20 mL顶空瓶中,各加入2 mL二氯甲烷,盖上瓶盖,涡旋振荡5 min,静置分层,下层有机相溶液即为全氟化合物前体物质的水基模拟物标准工作溶液,9种全氟化合物前体物质的质量浓度分别为5、10、25、50、250、500 μg/L。
橄榄油模拟物:分别移取10 g(精确至0.01 g)橄榄油于6个20 mL顶空瓶中,向其中加入0.5 mg/L的全氟化合物前体物质标准混合中间液20、40、100 μL,再加入5.0 mg/L的标准混合中间液20、100、200 μL,加入2 mL 乙腈,涡旋振荡5 min,静置分层,上层乙腈萃取液即为全氟化合物前体物质的橄榄油模拟物标准工作溶液,9种全氟化合物前体物质的含量分别为5、10、25、50、250、500 ng/g。
1.3 样品预处理
样品按照欧盟(EU)2017/752[14]进行处理,每6 dm2纸制食品接触材料用1 L模拟物浸泡。水基食品模拟物(3%乙酸、10%乙醇、50%乙醇):取10 mL食品模拟物于20 mL PCR 管中,加入2 mL二氯甲烷,涡旋振荡5 min,静置分层,取下层溶液,过0.22 μm针式尼龙滤膜,待测定。橄榄油模拟物:取10 g橄榄油至20 mL PCR 管中,加2 mL 乙腈,涡旋振荡5 min,静置分层,取上层溶液过滤,待测定。
1.4 气相色谱-串联质谱条件
气相色谱条件:高纯氦气为载气,柱流速为1.0 mL/min,进样口温度250 ℃,脉冲不分流进样,进样量2 μL,进样脉冲压力:20.7 kPa,脉冲时间:1.5 min,分流出口的吹扫流量:100 mL/min,吹扫时间:2 min,色谱柱为DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm),升温程序为:初温75 ℃(保持3 min),以30 ℃/min升温至250 ℃,再以50 ℃/min快速升至300 ℃(保持5 min)。
质谱条件:电子轰击离子源(EI)温度为 230 ℃,四极杆质量分析器温度为 150 ℃,传输线温度为300 ℃,电离能量:70 eV,多反应监测负离子模式(MRM),溶剂延迟2 min。
2 结果与讨论
2.1 橄榄油提取溶剂的选择
橄榄油食品模拟物中的全氟化合物需通过液-液萃取转移到有机溶剂后进行测试。以甲醇配制10 mg/L的混合标样,用橄榄油模拟物进行加标回收试验。称取10.00 g空白橄榄油模拟物,向其中加入0.1 mL 10 mg/L的混合标准溶液,分别考察了甲醇、乙醇、乙腈、甲醇-乙腈(1∶1) 4种萃取溶剂及其体积(1.0、1.5、2.0、2.5、3.0 mL)和萃取时间(5、10、15 min)对橄榄油模拟物中含氟化合物回收率的影响。结果表明:甲醇和乙腈的萃取效率最高,乙醇次之。用乙腈和甲醇-乙腈(1∶1)进行萃取时,上层溶剂与橄榄油分层清晰,回收率较高;而用甲醇或乙醇为萃取溶剂时,虽然含氟脂肪醇的回收率较高,但醇类与橄榄油混合后萃取溶液均存在界面乳化现象,分层不明显。
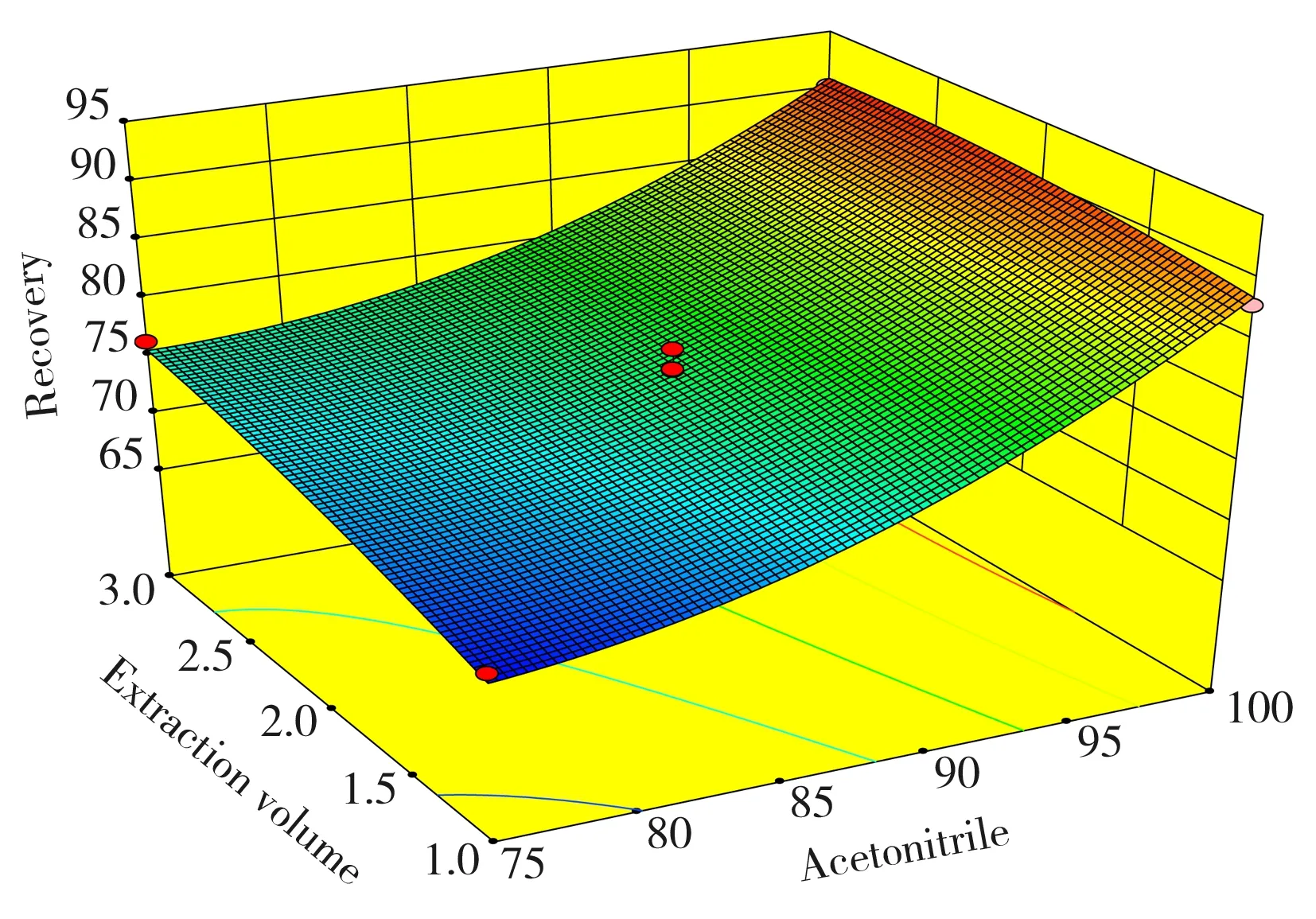
图1 根据Box-Behnken中心组合实验得到的方程拟合曲面结果Fig.1 Box-Behnken central composite design and the results of experiments
根据以上实验结果,采用响应面模型进一步对橄榄油中8∶2FTOH的萃取条件进行了优化。以乙腈体积分数(A,%)、萃取溶剂体积(B,mL)、萃取时间(C,min)作为变量,8∶2FTOH的回收率为响应值,根据 Box-Behnken 中心组合实验设计原理,进行3因素3水平共15次实验,得到回归模型方程:Recovery=77.57+8.84A+2.40B+2.69C+3.76A2-1.89C2,根据方程拟合的曲面模型见图1。
实验结果显示,模型拟合程度良好,预测值与实测值之间有较好的相关性。运用Box-Behnken中心合成设计计算F值的结果为A:263.72,B:19.45,C:24.39,A2:25.18,B2:0.07,C2:6.37。从F值可以看出,模型的一次项A影响极显著,B、C影响不显著。各因素对回收率的影响顺序依次为A>C>B,即乙腈体积分数>萃取时间>萃取溶剂体积; 二次项A2影响显著,B2影响不显著。在萃取溶液体积考察时,使用2.0 mL乙腈进行萃取,目标化合物回收率最好,乙腈大于或小于2.0 mL时,回收率有所降低。此外,萃取时间对目标物回收率的影响较小,涡旋萃取时间为5~15 min时,目标化合物的回收率基本不变。因此选取萃取时间为5 min。综上所述,最终选定乙腈作为萃取溶剂,萃取体积为2.0 mL,萃取时间为5 min,此时的萃取效率最大。
2.2 水基食品模拟物提取溶剂的选择
考察了正己烷、二氯甲烷、乙醚-正庚烷(1∶1) 3种萃取溶液及其体积(1.0、1.5、2.0、2.5、3.0 mL)对两种水基模拟物(3%乙酸,50%乙醇)中含氟化合物回收率的影响。结果表明,上述3种萃取溶剂均能有效萃取水基模拟物中的含氟化合物,但弱极性的正己烷对含氟脂肪醇的萃取效率低;乙醚-正庚烷(1∶1)的萃取效率一般,且乙醚的沸点较低,涡旋时压力较高,存在一定危险性;而采用二氯甲烷作为萃取溶剂时,含氟脂肪醇与含氟丙烯酸酯的回收率较好,且二氯甲烷的密度大,萃取液在水基溶液的下方,因此选择二氯甲烷为萃取溶剂。
2.3 质谱条件的优化
将9种全氟化合物标准溶液逐个在EI全扫描模式下进行一级质谱扫描,发现全氟脂肪醇和全氟丙烯酸酯易于形成质荷比小的碎片分子离子峰,如[C3H3O]+(M=55)或[C3H5F2O]+(M=95),见图2;其次,9种全氟化合物分子中均含有[C3H3F4O]+(M=131)分子离子峰。以0~60 eV的碰撞能量进行子离子模式扫描,结果表明,9种全氟化合物均含有离子对[C3H3F4O]+(M=131)→[CF3]+(M=69);全氟脂肪醇类化合物含有离子对[C3H5F2O]+(M=95)→[CF3]+(M=69);全氟丙烯酸酯因具有丙烯酸基团而存在[C3H3O]+(M=55)→[C2H3]+(M=27)离子对 ;9种全氟化合物优化后的参数见表1。多反应监测色谱图见图3。


No.Compound(abbreviation)StructureRetentiontime(min)MRM transition(m/z)Collisionenergy(eV)11H,1H,2H,2H-Perfluoro-1-hexanol(4∶2FTOH)1.78196.0>51.0∗,95.0>69.025,2521H,1H,2H,2H-Perfluoro-1-octanol(6∶2FTOH)2.4695.0>69.0∗,131.0>69.023,2731H,1H,2H,2H-Perfluoro-1-decanol(8∶2FTOH)3.6995.0>69.0∗,131.0>69.025,2541H,1H,2H,2H-Perfluoro-1-dodecanol(10∶2FTOH)4.7895.0>69.0∗,131.0>69.026,2551H,1H,2H,2H-Perfluorooctylacrylate(6∶2FTA)4.4055.0>27.0∗,131.0>69.015,3061H,1H,2H,2H-Perfluorod-ecylacrylate(8∶2FTA)5.3455.0>27.0∗,131.0>69.05,2071H,1H,2H,2H-Perfluorod-ecylacrylate(10∶2 FTA)6.0555.0>27.0∗,131.0>69.060,458N-Methyl-perfluoroctanesul-fonamidoethanol(N-MeFOSE)7.29131.0>69.0∗,526.0>169.0259N-Ethyl-perfluoroctanesul-fonamidoethanol(N-EtFOSE)7.53131.0>69.0∗,540.0>169.025
*quantitative ions
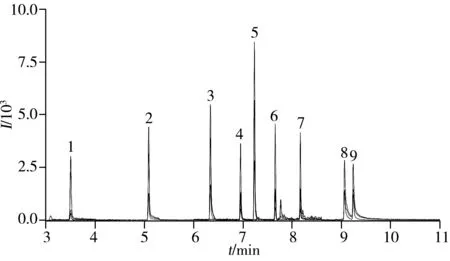
图3 9种全氟化合物(0.01 mg/L)的多反应监测色谱图Fig.3 MRM chromatogram of 9 perfluorinated compounds(0.01 mg/L) 1.4∶2FTOH,2.6∶2FTOH,3.8∶2FTOH,4.6∶2FTA,5.10∶2FTOH,6.8∶2FTA,7.10∶2FTA,8.N-MeFOSE,9.N-EtFOSE
2.4 线性范围与定量下限
采用本方法对9种全氟化合物混合标准工作溶液以MRM模式进行测试,以各物质的质量浓度(X,μg/L)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,9种全氟化合物在5~500 μg/L范围内线性良好,相关系数为0.995 2~0.999 7。以10倍信噪比(S/N=10)作为定量下限,并通过实际样品模拟液加标实验得出,9种全氟化合物在3%乙酸、10%乙醇、50%乙醇及橄榄油模拟物中的定量下限分别为3.3~4.4、3.5~4.2、3.3~4.9 μg/L和4.2~5.1 ng/g,均小于5 μg/L(见表2)。

表2 9种全氟化合物的线性方程与相关系数(r)
2.5 回收率与相对标准偏差
分别在3%乙酸、10%乙醇、50%乙醇和橄榄油基质空白的模拟物中对9种全氟化合物进行加标回收实验。定量添加3个不同水平的全氟化合物混合标准溶液,经上述方法处理后,得到最终添加质量分别为10、100 、500 ng的基质加标溶液,每个加标水平平行测试6次(见表3)。结果表明:9种全氟化合物在3%乙酸基质加标液中回收率为85.6%~112%,相对标准偏差(RSD)≤7.8%;在10%乙醇基质加标液中回收率为89.0%~112%,RSD≤7.3%,在50%乙醇基质加标液中回收率为85.7%~109%,RSD≤5.1%;在橄榄油基质加标液中回收率为85.0%~115%,RSD≤7.6%,方法的精密度和准确度均满足定量分析的要求。

表3 9种全氟化合物的回收率及相对标准偏差Table 3 Recovery and RSDs of 9 perfluorinated compounds
(续表3)

CompoundRecovery/%(RSD/%)3% Acetic acid10% Alcohol50% AlcoholOlive oil10 ng100 ng500 ng10 ng100 ng500 ng10 ng100 ng500 ng10 ng100 ng500 ng10∶2 FTA93.1(6.2)102(2.9)100(3.0)98.3(6.8)96.8(3.3)104(3.1)109(3.1)102(3.0)96.4(2.8)89.1(5.7)95.1(4.8)97.5(4.1)N-MeFOSE89.2(7.8)93.2(4.1)103(4.2)94.1(3.6)98.6(3.2)102(3.6)106(2.9)96.7(2.2)104(3.1)85.1(4.8)107(4.9)102(4.6)N-EtFOSE90.4(5.2)95.6(4.3)102(3.5)104(3.2)101(3.4)96.4(3.3)87.2(2.6)85.7(1.9)94.3(2.8)85.7(5.2)98.2(4.8)96.7(3.9)

图3 涂布卡纸食品包装材料样品的MRM色谱图Fig.3 MRM chromotagram of a coated card board
2.6 实际样品的测试
采用本方法对市场上带涂层的纸制品、耐热食品包装纸、烘焙吸油纸、防水食品包装纸和涂布包装卡纸等纸制食品接触材料进行上述9种全氟化合物前体物的迁移量检测。结果表明,涂布包装卡纸检出率近20%,其次为防水功能的食品包装纸,主要检出物质均为全氟脂肪醇类化合物,其检出量:某涂布卡纸样品为6∶2FTOH 5.48 μg/L,N-MeFOSE 7.83 μg/L;某防水包装纸样品为8∶2FTOH 4.64 μg/L,8∶2FTA 6.43 μg/L;带涂层纸杯样品为10∶2 FTA 6.56 μg/L。某涂布卡纸样品的MRM色谱图见图3。
3 结 论
本文建立了纸制食品接触材料中9种挥发性全氟类化合物前体物的测定方法。利用响应面法和比较实验对前处理条件进行优化,采用气相色谱-串联质谱技术对全氟脂肪醇类、全氟丙烯酸酯类和全氟磺酰胺类化合物进行测定。该方法具有操作较简便、灵敏度高、精密度好的特点,能满足纸制食品接触材料中全氟化合物前体物质的测定要求。对市场上纸制食品接触材料的检测结果表明,这些含氟化合物有一定程度的存在,应引起关注。
