脉冲强光对大肠杆菌的灭活效果及其动力学模型的建立
2018-10-16潘忠礼马海乐周存山
洪 晨,潘忠礼,王 蓓,马海乐,*,周存山
(1.江苏大学食品与生物工程学院,江苏镇江 212013) (2.美国加州大学戴维斯分校生物与农业工程系,美国戴维斯 95616) (3.美国农业部西部研究中心,美国奥尔巴尼 94710)
大肠杆菌是肠道中的正常栖息菌,但一些具有特殊血清性的大肠杆菌如O157∶H7等却具有病原性,常引起呕吐、腹泻、败血症等疾病[1],因此控制和杀灭大肠杆菌对提高食品的食用安全性具有重大意义,对于大肠杆菌的杀灭程度直接决定了一种灭菌方法是否能够达到工业生产的要求。
脉冲强光技术是一种新型的杀菌技术,它利用瞬时高压脉冲能量产生的光热效应和光化效应破坏菌体的结构及其内部遗传物质,从而杀死食品中的微生物[2]。与传统热杀菌和化学杀菌相比,具有杀菌效率高、能耗低、易操作等优点。目前国内外大多数关于脉冲强光的研究集中于杀菌工艺优化以及实际应用探讨[3-4],已有研究表明,影响脉冲强光灭活效果的因素有很多,如处理条件、介质条件和微生物因素等,其中,以脉冲处理条件对灭活效果的影响最大[5]。而关于脉冲强光杀菌动力学的研究却较少。
在众多动力学模型中,Linear模型和Weibull模型的运用较为广泛,分别用于线性模型和非线性模型的拟合。王蓓[6]发现,Weibull+Tail模型和Weibull模型较Linear模型对脉冲强光灭活黄曲霉菌的杀菌曲线拟合度较高。Chen等[7]用Linear、Weibull和log-logistic模型拟合超高压对牛奶中食源性病菌的杀菌作用,证明Weibull和log-logistic模型较Linear模型拟合效果更好。目前,尚未见脉冲强光对大肠杆菌杀菌动力学相关方面的研究报道,本文将着重对此进行研究,从而找到适合描述脉冲强光灭活大肠杆菌的动力学模型。本文以大肠杆菌为目标微生物,研究微生物因素(不同生长期)、介质因素(pH和温度)对脉冲强光杀菌效果的影响,拟采用Linear模型和Weibull模型拟合脉冲强光杀菌曲线,获得其杀菌特性,为脉冲强光在饮用水处理中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
大肠杆菌ATCC 8739 美国农业部西部研究中心;蛋白胨、牛肉浸出粉、氯化钠、琼脂粉、氢氧化钠、盐酸 美国Sigma-Aldrich公司。
SteriPule-XL® 3000实验室规模脉冲强光杀菌系统 美国Xenon公司;NU-425-600型生物安全柜 美国NuAire股份有限公司;FFU20F3AWA型恒温培养箱 美国Scientific Division Jouan股份有限公司;SR-24C型高压灭菌锅 美国Consolidated Stills & Sterilizers公司;PG2002-S型电子秤 美国Mettler-Toledo有限责任公司;5804R型高速离心机 美国Fisher Scientific公司。
1.2 实验方法
1.2.1 菌悬液的配制 取出斜面冷藏的大肠杆菌菌种,挑取一至三环接入已灭菌的营养肉汤(NB)培养基中,180 r/min、37 ℃振荡培养24 h,进行活化。取活化后的大肠杆菌培养液1 mL,接入100 mL NB培养基中,180 r/min、37 ℃振荡培养24 h,作为种子培养液。取1 mL种子培养液接种到装有100 mL NB培养基的锥形瓶中(1%接种量),180 r/min、37 ℃振荡培养一定时间后,离心(4000 r/min,10 min)取沉淀,用已灭菌的生理盐水洗涤三次,最终重置于100 mL的无菌生理盐水中,配成待处理的菌悬液。
1.2.2 脉冲强光处理 将直径为95 mm的无菌平板至于脉冲强光杀菌室中央,向其中加入20 mL菌悬液,此时菌液厚度约为3 mm[8],进行脉冲强光处理。以未经脉冲强光处理的相同菌悬液为空白对照,每个实验重复三次。脉冲强光设备参数设为:脉冲距离13 cm(0.35 J/cm2/pulse)、脉冲频率4 pulses/s、脉冲时间1 s。在此条件下,选择大肠杆菌不同生长期、菌液pH、菌液初始温度作为影响因素,研究微生物因素和介质因素对脉冲强光杀菌效果的影响。
1.2.3 单因素实验参数设置 本试验采用单因素逐级优化的方法,来确定微生物因素和介质因素对脉冲强光杀菌效果的影响,选取最优条件为研究脉冲强光杀菌动力学建模做准备,具体实验条件如下。
1.2.3.1 大肠杆菌生长曲线的测定 分别取1 mL大肠杆菌种子培养液,接种到已编号的14个装有100 mL NB培养基的锥形瓶中,180 r/min、37 ℃振荡培养。当培养0、1.5、3、4、6、8、10、12、14、16、18、20、22、24 h时,取出大肠杆菌培养液,并以未接种的NB培养基作空白对照,在600 nm波长下进行比浊测定,重复三次。对于浓度较大的培养液,需用培养基进行稀释后测定,使其光密度值在0.1~0.65之间。以培养时间为横坐标,OD值为纵坐标,绘制生长曲线。
1.2.3.2 大肠杆菌不同生长时期对脉冲强光杀菌效果的影响 因为大肠杆菌培养到不同的生长时间其菌落浓度不一样,经测定延迟期为107cfu/mL,稳定期为109cfu/mL。已有研究表明,大肠杆菌菌液浓度对脉冲强光杀菌效果有影响,杀菌效果会随着菌液浓度的增大而逐渐减小[9]。为测定脉冲强光对不同生长时期大肠杆菌杀菌效果的影响,本实验将培养到对数期和稳定期制备的菌悬液统一稀释到107cfu/mL进行处理。在介质温度35 ℃,pH7.0条件下,对培养了1.5、4、6、8、10、12、14、16、18 h的大肠杆菌的菌悬液进行杀菌实验,研究大肠杆菌不同生长时期对脉冲强光杀菌效果的影响。大肠杆菌不同生长期参数设置:依据生长曲线的结果选取不同的培养时间。
1.2.3.3 pH对脉冲强光杀菌效果的影响 大肠杆菌培养6 h之后,将其配成不同pH的菌悬液,在菌液初始温度35 ℃条件下利用脉冲强光对不同pH(4、5、6、7、8)的菌悬液进行杀菌实验,研究pH对脉冲强光杀菌效果的影响。pH参数设置:根据菌种自身可生长pH范围并参考文献[9]确定其参数,采用1 mol/L的HCl或NaOH调节pH。
1.2.3.4 温度对脉冲强光杀菌效果的影响 大肠杆菌培养6 h之后,将其配成pH4.0的菌悬液,利用脉冲强光对不同初始温度(5、15、25、35、45 ℃)的菌悬液进行杀菌实验,研究温度对脉冲强光杀菌效果的影响。初始温度参数设置:根据菌种自身可存活温度范围并参考文献[10]确定其参数,采取冰浴及恒温箱冷却和恒温水浴锅加热的方式控制菌液温度。
1.2.4 杀菌效果检验 菌落总数的测定按照GB 4789.2-2016[11]。对脉冲强光处理后的样品立即进行微生物计数,吸取1 mL杀菌完成的菌液,按1∶10的比例进行梯度稀释,选取三个适合的稀释梯度的菌液,用倾注法进行平板接种,37 ℃下培养48 h进行计数。杀菌效果采用残存率的对数值lg(N/N0)表示,即为处理前后大肠杆菌降低的对数。
式(1)
其中:N0为脉冲强光处理前的初始大肠杆菌数量(cfu/mL);N为处理后的大肠杆菌数量(cfu/mL)。
1.2.5 脉冲强光杀菌动力学建模 在以上微生物因素和介质因素确定的基础上,本文分别研究了脉冲距离为13 cm(0.35 J/cm2/pulse)和17 cm(0.30 J/cm2/pulse)条件下脉冲强光的杀菌动力学,采用Linear和Weibull模型来进行杀菌动力学拟合[7]。
Linear数学模型为:
式(2)
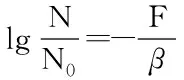
式(3)
其中:D为指数递减时间即杀灭90%的微生物所用的时间(s),t为脉冲强光处理时间(s),F为辐射通量(J/cm2),β为杀灭90%的微生物所需的辐射通量(J/cm2)。
式(4)

式(5)
其中:b为尺度参数,n为形态参数,t为脉冲强光处理时间(s),F为辐射通量(J/cm2)。当n=1时,Weibull模型与Linear模型一致,此时一级动力学方程可以看成Weibull模型的特定形式。
F辐射通量与辐射强度和处理时间之间的关系为:
F=I×t
式(6)
其中:I为辐射强度(W/cm2),t为辐射处理时间(s)。
1.2.6 模型拟合度评价 采用Matlab R2014b软件对Weibull模型进行拟合,得到杀菌效果随时间和辐射量变化的动力学方程,以均方根误差RMSE、决定系数R2、精确因子Af和偏差因子Bf这四个参数来评判拟合度的优劣[12]。计算公式如:
式(7)
式(8)
式(9)
其中:p为预测值,a为实际值,n为实验次数。Af反映了预测值与实际值偏离的程度,其值越接近1,表明模型的预测值与实际值相差越小,模型越精确。当Bf>1表示模型的预测值比实际值高,相反则表示模型预测值比实际值低,其值越接近1模型拟合度越高。决定系数R2和RMSE表示模型的精确度、可靠度,R2越接近于1,RMSE越小,模型拟合度越髙[13]。
1.3 数据统计分析
本文中所有实验均平行三次。所有数据均以平均(mean)±标准差(SD)表示。运用Microsoft Excel 2016软件统计,采用单因素方差分析(ANOVA)进行显著性差异分析(p<0.05)。模型拟合图由Matlab软件完成。
2 结果与分析
2.1 大肠杆菌的生长曲线
大肠杆菌在NB培养基中的生长曲线如图1所示。由图1可知,大肠杆菌ATCC 8739的延迟生长期处于0~1.5 h,而1.5~14 h为对数生长期,培养14 h后进入稳定生长期,这为后续实验中大肠杆菌不同生长时期参数的设置提供依据。

图1 大肠杆菌在NB培养基中的生长曲线Fig.1 Growth curve of E. coli in the nutrient broth medium
2.2 大肠杆菌不同生长时期对脉冲强光杀菌效果的影响
大肠杆菌不同生长期对脉冲强光杀菌效果的影响见图2。如图2所示,结果表明:大肠杆菌ATCC 8739在对数生长期的前期,比延迟生长期和稳定生长期对脉冲强光更敏感,特别在大肠杆菌生长6 h时,对其灭活效果最好,这与王合利等[10]和Ortuno等[14]的研究结果类似。这可能是因为此时的大肠细菌形态、染色、生物活性都很典型,细菌以最大速率生长和分裂,代谢旺盛,当受到外界环境因素干扰时,DNA复制容易出错,此时作用效果才会较为明显。因此,选取培养时间为6 h用来制备菌悬液,此时菌悬液浓度为109cfu/mL。

图2 大肠杆菌不同生长期对脉冲强光杀菌效果的影响Fig.2 Effect of different growth phases on the log reduction of E. coli treated by pulsed light
2.3 pH对脉冲强光杀菌效果的影响
未经脉冲强光作用时不同pH条件下大肠杆菌的初始菌落数如图3所示。由图3可知,不同pH环境下,任意两组之间大肠杆菌的初始菌落数没有显著性差异(p>0.05)。因此,在后续实验中可以排除pH本身对大肠杆菌死亡的影响,因为单纯的酸碱性并不是造成大肠杆菌死亡的原因。这与张策[15]的结论类似。

图3 未经脉冲强光作用不同pH下大肠杆菌的初始菌落数Fig.3 Initial microbial count of E. coli at different pH untreated by pulsed light注:相同字母表示差异不显著(p>0.05),不同字母表示差异显著(p<0.05);图5同。
pH对脉冲强光灭活大肠杆菌的影响如图4所示。脉冲处理1 s后,与未经脉冲强光处理的菌悬液相比,当pH为4.0时,大肠杆菌降低了(3.61±0.05) lg cfu/mL;当pH为5.0时,降低了(3.10±0.07) lg cfu/mL;当pH为6.0时,降低了(2.89±0.01) lg cfu/mL;当pH为7.0时,降低了(2.60±0.09) lg cfu/mL;当pH为8.0时,降低了(3.24±0.15) lg cfu/mL。大肠杆菌在pH为7.0时,对脉冲强光的抗性最大,这可能是因为,pH7.0是大肠杆菌的最适生长pH,此时微生物生长速度最快,生存状态最佳,导致强光作用后不易死亡。而在过酸(pH4.0~6.0)或过碱(pH8.0)环境中,脉冲强光的灭活作用增强,尤其是在酸性环境中,随着pH的降低,大肠杆菌的残留越来越少。

图4 介质pH对脉冲强光杀菌效果的影响Fig.4 Effect of pH on the germicidal efficacy of E. coli treated by pulsed light
2.4 温度对脉冲强光杀菌效果的影响
在脉冲强光处理前,用不同温度温育菌悬液30 min。初始菌落数如图5所示,可以发现不同温度环境下,任意两组之间大肠杆菌的初始菌落数没有显著性差异(p>0.05)。因此,后面的实验中温度本身对大肠杆菌的影响可以排除。

图5 未经脉冲强光作用不同温度下大肠杆菌的初始菌落数Fig.5 Initial microbial count of E. coli at different temperature untreated by pulsed light
介质温度对脉冲强光灭活效果的影响见图6。由图6可知,介质温度在5~25 ℃时,脉冲强光对大肠杆菌的杀菌效果影响较小,处理1 s后,与未经脉冲强光处理的菌悬液相比,大肠杆菌数量降低了3.30 lg cfu/mL左右。当介质温度上升至35 ℃之后,杀菌效果较好且趋于平缓,与未经脉冲强光处理的菌悬液相比,35、45 ℃条件下分别降低(3.72±0.19)、(3.87±0.11) lg cfu/mL,且没有显著性差异(p>0.05)。考虑到能耗问题,选取35 ℃进行后续试验。35 ℃的温度略低于大肠杆菌的最适生长温度37 ℃,此时大肠杆菌较为敏感,容易被杀死。而在较低温度下,杀菌效果较差,一方面可能由于微生物本身对不利生存环境的抗逆性,使它对脉冲强光的作用产生抵抗,另一方面可能与脉冲强光的杀菌机理有关,光热作用在低温下并不能达到很好的效果。

图6 介质温度对脉冲强光杀菌效果的影响Fig.6 Effect of temperature on the germicidal efficacy of E. coli treated by pulsed light
2.5 脉冲强光对大肠杆菌的杀菌动力学建模
2.5.1 以时间为变量的Linear模型和Weibull模型 在大肠杆菌培养6 h,菌液pH4.0,温度35 ℃,脉冲强光距离13 cm(0.35 J/cm2/pulse),脉冲频率4 pulses/s条件下处理1 s,大肠杆菌可以降低(3.72±0.19) lg cfu/mL。为拟合脉冲强光杀菌曲线,调整脉冲强光仪器参数为:脉冲频率1 pulse/s。否则过高频率下,大肠杆菌很快就死亡,无法深入探究脉冲强光杀菌动力学。在上述条件下,用Linear模型和Weibull模型拟合不同脉冲距离下大肠杆菌的失活曲线如图7所示,并对不同距离条件下的模型参数进行计算,见表1。从图7可以看出,不同脉冲距离下脉冲强光对大肠杆菌的杀菌动力学模型一致,Weibull模型和Linear模型都能较好地拟合大肠杆菌失活曲线。随着处理时间的增加,大肠杆菌残存的活菌数逐渐减少。而且达到相同的杀菌效果时,近距离的处理方式比远距离的处理方式效率高。另外,表1列出了Linear模型和Weibull模型的参数,包括D值、尺度因子、形状因子和回归参数等,可以发现Weibull模型较Linear模型可以更好地拟合了实验数据(R2>0.997),体现了较高的精确性。
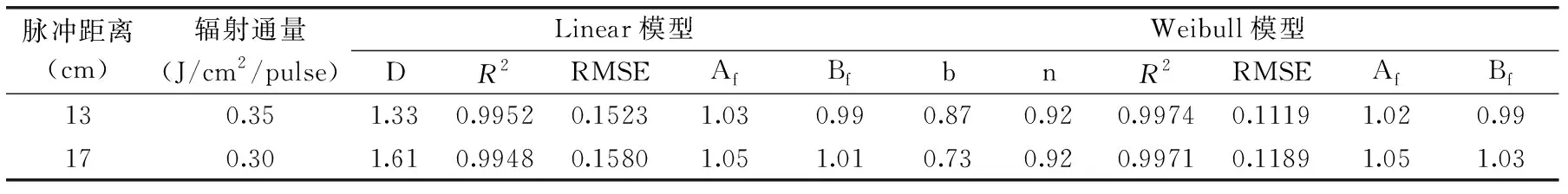
表1 不同距离下大肠杆菌的失活模型参数Table 1 Parameters of Linear and Weibull model for inactivation by PL under different distances

图7 Linear和Weibull模型拟合大肠杆菌的脉冲强光辐射失活曲线Fig.7 PL inactivation curves of E. coli applying Linear and Weibull model
2.5.2 以辐射通量为变量的Linear和Weibull模型 为了简化模型,以不同距离下处理不同时间所对应的脉冲强光辐射量作为变量,将图7中各曲线合并,把所有试验点重新作图就可以得到图8,并计算出此时的模型参数如表2所示,可得到辐射通量与大肠杆菌失活量之间的关系式:

表2 大肠杆菌的失活模型参数Table 2 Parameters of Linear and Weibull model for inactivation by PL
式(10)
式(11)
此时Linear模型和Weibull模型仍能较好地拟合脉冲强光杀菌动力学,但依旧是Weibull模型更为精确。从图8还可以看出,在脉冲距离13 cm、脉冲时间6 s条件下和脉冲距离17 cm、脉冲时间7 s条件下,大肠杆菌分别降低了(4.56±0.08) lg cfu/mL和(4.56±0.10) lg cfu/mL,脉冲强光杀菌效果没有显著性差异(p>0.05),但此时辐射通量相同,都为2.10 J/cm2。因此可以发现,在微生物因素、介质因素等相同的条件下,决定脉冲强光杀菌效果的主要是辐射通量这一因素,辐射通量相同,脉冲强光杀菌效果就没有显著性差异。脉冲强光参数(如脉冲距离、脉冲时间)的变化引起的杀菌效果的改变,追根究底其实是样品表面辐射通量的变化造成的,辐射通量可以通过脉冲强光参数进行调节。

图8 Linear和Weibull模型拟合大肠杆菌的脉冲强光辐射失活曲线Fig.8 PL inactivation curves of E. coli applying Linear and Weibull model
3 结论与讨论
脉冲强光对大肠杆菌有着明显的杀菌效果,处于不同生长期的大肠杆菌对脉冲强光的敏感性不同,在对数生长前期(培养6 h时)杀菌效果最好。菌液的pH和温度对脉冲强光杀菌效果有一定的影响,在介质温度35~45 ℃,酸性(pH4.0~6.0)或者碱性(pH8.0)条件下,脉冲强光对大肠杆菌的杀菌效果具有较强促进作用。
在大肠杆菌培养6 h,菌液pH4.0,温度35 ℃,脉冲距离为13 cm(0.35 J/cm2/pulse)和17 cm(0.30 J/cm2/pulse),脉冲频率1 pulse/s条件下,Linear模型和Weibull模型都能很好地拟合脉冲强光对大肠杆菌杀菌动力学(R2>0.99),且Weibull模型更为精确。Weibull模型灵活实用,对脉冲强光在饮用水中的应用有一定的参考作用,简单而精确的灭菌模型的建立有助于控制食品工业中微生物的安全性。
此外,本文还发现在微生物因素、介质因素条件相同时,辐射通量对杀菌效果起决定性作用。辐射通量相同时,脉冲强光杀菌效果没有显著性差异。辐射通量是由脉冲强光各种参数如脉冲距离、脉冲时间等综合作用的,在实际生产应用中,需要同时考虑杀菌效果和成本,因此可合理地调节这些参数来增强脉冲强光杀菌效应,降低工业生产成本,如为了节约处理时间,可以减少灯管到样品表面的距离,这对优化食品工业中脉冲强光杀菌工艺具有重要的指导意义。
