玉米根际土壤中镰孢菌的构成与定量分析
2018-10-16葛波王宝宝郭成孙素丽陈国康王晓鸣朱振东段灿星
葛波,王宝宝,郭成,孙素丽,陈国康,王晓鸣,朱振东,段灿星
玉米根际土壤中镰孢菌的构成与定量分析
葛波1,2,王宝宝1,郭成3,孙素丽1,陈国康2,王晓鸣1,朱振东1,段灿星1
(1中国农业科学院作物科学研究所/国家农作物基因资源与基因改良重大科学工程,北京 100081;2西南大学植物保护学院,重庆 400715;3甘肃省农业科学院植物保护研究所,兰州 730070)
【目的】了解我国玉米根际土壤镰孢菌(spp.)的种群结构及相对含量,为相关土传病害的发生提供早期预警。【方法】从全国17个省(自治区、直辖市)采集的47份玉米田间土样中,采用稀释涂布平板法共分离到58个镰孢菌分离物,通过形态学、特异性引物及基因测序等方法进行鉴定,从GenBank以及镰孢菌数据库MLST中下载标准参照菌株,利用MEGA 6.0软件以邻接法构建多基因位点系统发育树;挑选代表菌株利用玉米自交系黄早四分别进行幼苗、种子以及离体叶片的致病性测定;基于已建立的实时荧光定量PCR(RT-qPCR)检测体系,提取土壤总DNA对玉米土样中镰孢菌属以及部分种的含量进行检测,针对不同玉米产区进行划分统计。【结果】共鉴定出9种镰孢菌,其中拟轮枝镰孢()(22.41%)、木贼镰孢()(20.69%)、禾谷镰孢复合种(species complex)(18.97%)分离频率较高,其余为尖镰孢复合种(species complex)、层出镰孢()、单隔镰孢()、锐顶镰孢()、茄镰孢()和居群镰孢(),分离频率分别为12.07%、8.62%、5.17%、5.17%、3.40%和3.40%,相同镰孢菌与其参照菌株处于同一分支,不同区域的镰孢菌存在多样性;致病性测定结果显示除单隔镰孢外,其余镰孢菌均具有致病性,但致病力各不相同,同一镰孢种的不同菌株间致病性也不尽相同;其中居群镰孢为首次在玉米根际土壤中发现,并首次证实其对玉米具有致病性。RT-qPCR检测结果表明,玉米根际土壤中镰孢菌属、拟轮枝镰孢与禾谷镰孢复合种的含量分别为2.91—169.90、0.08—5.34和0.76—78.37 pg·g-1,各玉米产区的镰孢菌含量不同,其中禾谷镰孢含量均大于拟轮枝镰孢。【结论】玉米根际土壤中镰孢菌种类众多,其中拟轮枝镰孢、木贼镰孢和禾谷镰孢复合种为优势镰孢种,各地区的镰孢菌含量均不相同,其中西南山地玉米区的镰孢菌含量最多,黄淮海玉米区的禾谷镰孢含量高于其他区域。
玉米;根际土壤;镰孢菌;实时荧光定量PCR
0 引言
【研究意义】玉米是我国最主要的粮食作物之一,镰孢菌(spp.)能引起多种玉米土传病害,如苗枯病、根腐病、茎腐病和穗腐病等,其中镰孢茎腐病和穗腐病已成为我国玉米生产上的主要病害,严重影响玉米的产量和品质,制约玉米全程机械化发展;此外,镰孢菌能产生多种真菌毒素,如伏马毒素、单端孢霉烯族毒素等,直接危害人畜健康[1-5]。镰孢菌分布极广,普遍存在于土壤及动植物有机体上,能以死体营养的方式在土壤和病残体上越冬,导致玉米田土壤中积累的镰孢菌成为病害发生的重要侵染源,因此,明确土壤中致病镰孢菌的种类和含量对于玉米土传病害的有效防控具有重要指导意义。【前人研究进展】针对土壤中镰孢菌的分离报道较多,唐琳等[6]从河南西部地区的茄科作物土样中分离鉴定了5个镰孢种,分别为尖镰孢()、藤仓镰孢()、拟轮枝镰孢()、变红镰孢()和变红-木贼镰孢复合种(species complex),其中尖镰孢的分离频率高达45.83%;黎永坚等[7]对广东珠海的粉蕉种植土壤镰孢菌进行了分离鉴定,发现了茄镰孢()、尖镰孢、木贼镰孢()、层出镰孢()和拟轮枝镰孢。稀释平板法具有操作简便、快捷和易成功等优点[8-9],成为土壤微生物分离培养及衡量微生物小群体多样性的常规手段,但该方法的缺点是无法真实反映出自然条件下镰孢菌的数量。近年来,随着实时荧光定量PCR(RT-qPCR)技术在植物病原菌研究上的不断深入,大大提高了植物病原菌的检测效率和监测防治水平,利用其对土壤中植物病原菌实时定量检测的研究更是屡见报道,RT-qPCR技术在进行大量样品中镰孢菌种群密度分析及后续病原菌检测监控中具有不可替代的优势[10-13]。【本研究切入点】近年来,由于秸秆还田以及栽培管理方式变更等原因,造成玉米土壤中镰孢菌不断积累,导致土传病害发生不断加重。目前,有关玉米根际土壤镰孢菌的研究报道极少,针对玉米土传病害开展流行预警和防控措施缺乏理论依据。【拟解决的关键问题】对从全国17个省(自治区、直辖市)采集的47份土样中分离得到的58个镰孢菌分离物进行形态学及分子特征鉴定,利用已建立的荧光定量检测体系对镰孢属、拟轮枝镰孢与禾谷镰孢复合种(species complex)进行定量检测,以期明确玉米土样中的镰孢菌的种类和数量,为相关土传病害的发生提供早期预警。
1 材料与方法
1.1 材料
土壤样品:2017年在全国23个地区的玉米主产区采用五点法随机选取玉米,挖取其根部体积为25 cm×25cm×25 cm土壤,并去除0—5 cm土层的表土,采用抖根法[14]提取根际土样,共得到了47份不同地点的土壤样本,将采集的土样置于无菌封口袋中,带回实验室过筛保存。
实验仪器:Retsch MM400混合研磨仪、Sigma高速大量冷冻离心机、DYY-12型电泳仪、GeneAmp PCR Syetem 9700 基因扩增仪、ABI 9700荧光定量仪、Tanon 4100凝胶成像系统、Q5000超微量核酸蛋白测定仪、HZQ-F160全温振荡培养箱。常用试剂:dNTPs、10×PCR buffer、Taq聚合酶。SYBR Green I(Takara)、BioFast Soil Genomic DNA Extraction Kit(杭州博日科技有限公司);真菌基因组DNA快速抽提试剂盒;特异性引物(上海生工)。
PPA培养基[15]:15.0 g蛋白胨,1.0 g KH2PO4,0.5 g MgSO4·7H2O,1.0 g PCNB,20.0 g琼脂,水1.0 L。
1.2 方法
1.2.1 分离鉴定 镰孢菌分离:称取土样5.0 g放入盛45 mL无菌水并带有玻璃珠的200 mL三角瓶中,混合后置于摇床振荡15 min使土样均匀形成土壤悬液,吸取土壤悬液按照10倍梯度稀释法进行稀释,分别吸100 μL稀释液均匀涂布于PPA培养基中,26℃恒温箱培养,培养4—6 d,待形成菌落后,挑取疑似镰孢菌菌落的最外缘菌丝于新的PDA培养基上,7 d后,进行病原菌种类鉴定。
形态学鉴定:挑取纯化后的镰刀菌丝接种于PDA、SNA培养基上,28℃恒温箱,12 h黑暗交替培养,6 d后计算生长速率,记录菌落形态和色素产生情况,在显微镜下观察分生孢子等结构的生长情况,具体参考《常见镰刀菌鉴定指南》[16]、《TheLaboratory Manual》[15],采用Booth体系进行鉴定。
分子特征鉴定:将得到的单孢菌株转移到贴有灭菌玻璃纸的PDA培养皿上,25℃培养7 d,刮取菌丝风干,液氮研磨充分后按照真菌基因组DNA快速抽提试剂盒(上海生工)提取DNA。利用镰孢种的特异性引物(表1)进行PCR检测,确定菌株的具体属以及种。利用以及基因序列分析方法进行进一步鉴定。引物序列ITS1(GAAGTAAAAGTCGAAC AAG)和ITS4(CCTCCGCTTATTGATATGC);TEF-F(ATGGGTAAGGARGACAAGAC)和TEF-R(GG ARGTACCAGTSATCATGTT),PCR扩增产物进行1.0%的琼脂糖检测后送北京生工有限公司进行测序。测序结果与NCBI的镰孢菌序列进行比对鉴定,从GenBank以及镰孢菌数据库MLST中下载标准参照菌株,利用MEGA 6.0软件以邻接法构建多基因位点系统发育树。
常规PCR扩增体系:选用10.0 µL的反应体系,模板1.0 µL,引物上下游各0.5 µL(10 µmol·L-1),10×buffer 1.0 µL(2.5 mmol·L-1),dNTP 0.5 µL(2.5 mmol·L-1),Taq酶0.25 µL(5 U·µL-1),ddH2O 6.25 µL补至10.0 µL。反应程序:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸1 min,共35个循环;72℃延伸10 min。
1.2.2 致病力测定 玉米种子致病性测定:选择玉米感病自交系黄早四,进行种子表面灭菌即75%酒精漂洗4 min,无菌水漂洗2次,放在无菌滤纸上风干。将纯化后的镰孢菌分离物接种在不加琼脂的SNA培养基上,全温振荡培养箱25℃,120 r/min培养3 d,在显微镜下计算孢子浓度,并将浓度稀释至2×106个/mL。将灭菌滤纸放在平皿里,每皿放置5粒玉米种子,每个菌株设置3皿,用孢子液分别浸泡接菌黄早四玉米种子,设无菌水浸泡为空白对照,封口后置于26℃恒温培养箱内,7 d后调查种子发病情况,统计发病率。
玉米幼苗致病性测定:将灭菌后的黄早四玉米种子播种在纸杯中,适时浇水,观察生长情况。选择玉米3叶期进行蘸根接种,每个菌株对5株玉米苗进行接种,设空白对照。14 d后,调查玉米植株的发病情况,统计发病率。从发病的玉米叶片的病斑上分离出致病菌,于灭过菌的PDA培养基上培养,备用。
玉米离体叶片致病性测定:用打孔器从已培养7 d的病斑分离菌的PDA平皿上的菌落边缘打下菌饼,菌丝面朝下贴于经酒精擦拭的黄早四玉米叶片上,每个菌株两片叶片,以无菌PDA培养基菌饼为对照,26℃保湿培养5 d后观察发病情况。
从各发病部位重新分离菌株,进行形态学鉴定。
1.2.3 荧光定量检测 取土样过筛,混合均匀后,称取1 g土样按照BioFast Soil Genomic DNA Extraction Kit试剂盒提取土壤总DNA。提取不同地点的共47份带菌土样总DNA利用已有的检测体系分别进行镰孢属、禾谷镰孢以及拟轮枝镰孢RT-qPCR检测,荧光PCR扩增体系:反应混合液总体积20.0 µL,包括10.0 µL的SYBR Premix Ex TaqTM(2×),0.4 µL的ROX Reference Dye Ⅱ(50×),引物各0.8 µL(10 µmol·L-1),模板2.0 µL,ddH2O 6.8 µL。优化后的反应程序:95℃预变性30 s;95℃变性5 s,退火34 s,40个循环;95℃ 15 s ,60℃ 1 min,95℃ 15 s,60℃ 15 s,引物及曲线方程见表2,将土样检测量根据不同玉米种植区进行划分,计算各区域镰孢菌的平均含量,由于西北灌溉玉米区样本数较少,数据缺乏一定的代表性,不考虑分析。

表1 镰孢菌的特异性引物

表2 RT-qPCR的引物及曲线信息
2 结果
2.1 镰孢菌鉴定
基于形态学特征初步确定为镰孢菌的58个分离物,进行镰孢菌属特异性引物ItsF/R的PCR扩增,结果表明所有分离物均能稳定扩增出431 bp目标片段(图1-A),确定为镰孢菌。利用镰孢种的特异性引物分别对58个单孢分离物进行扩增,其中13株扩增出单一的578 bp VER1/2特异性条带(图1-B),确定为拟轮枝镰孢;9株扩增出340 bp目标片段(图1-C),为尖镰孢复合种;11株扩增出280 bp目标片段(图1-D),为禾谷镰孢复合种;其余25个未扩增出任何目标片段以及9株尖镰孢复合种,通过对其进行基因测序分析,经BLAST比对后确定为木贼镰孢、茄镰孢、锐顶镰孢()、层出镰孢、单隔镰孢()和居群镰孢()。构建发育树所用的菌株信息见表3,系统发育树将不同镰孢种明显区分开来,9个经尖镰孢特异性引物检测呈阳性的分离物,其中两株与处于同一分支(图2)。
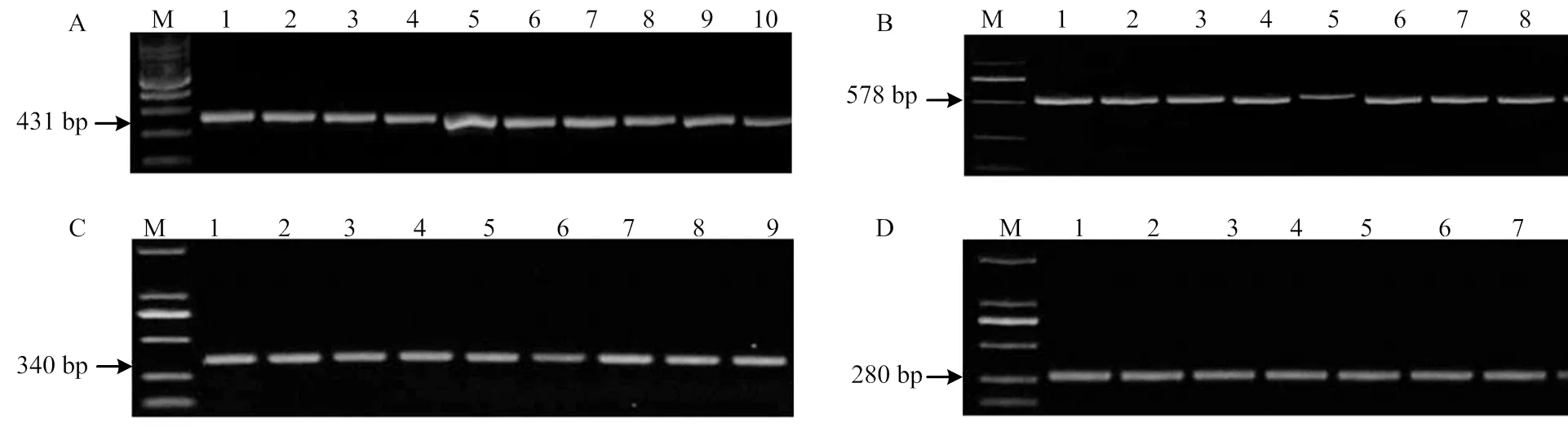
M: D2000。A:镰孢菌的PCR检测PCR amplification of Fusarium spp, 1-10: S10-3, S30-1, S40-6, S31-3, S2, S8, S19-3, S1-4, S46-1, S22-2;B:拟轮枝镰孢的PCR检测PCR amplification of F. verticillioides, 1-10: S21-2, S31-5, S44-1, S1-4, S43-1, S44-3, S11-4, S31-2, S37-6, S21;C:尖镰孢复合种的PCR检测PCR amplification of F. oxysporum species complex, 1-9: S8, S46-1, S19-3, S6-3, S30-2, S6, S2-3, S24-4, S7;D:禾谷镰孢复合种的PCR检测PCR amplification of F. graminearum species complex, 1-9: S31-1-2, S40-8, S40-6, S22-2, S22-1, S40-1, S31-1, S16-3, S15-2
2.2 镰孢菌种的分离频率与地域分布
通过对各镰孢种的分离频率进行统计发现,拟轮枝镰孢分离频率最高,为22.41%;其次是木贼镰孢、禾谷镰孢复合种、尖镰孢复合种,分别为20.69%、18.97%、12.07%;其他如层出镰孢、茄镰孢、锐顶镰孢、单隔镰孢、居群镰孢的分离频率较低,分别为8.62%、3.40%、5.17%、5.17%、3.40%。从镰孢菌种类区域性分布看(表4),拟轮枝镰孢、禾谷镰孢复合种、木贼镰孢以及尖镰孢复合种在每个玉米产区均有分离,为主要镰孢菌,且不同玉米产区的镰孢菌的分离频率不尽相同。居群镰孢只在河南新乡的土样中分离得到,在玉米根际土壤中分离出该菌尚属首次。
2.3 镰孢菌致病性测定
将9种不同的镰孢菌分别挑选2株代表菌株进行致病性测定,大部分菌株具有致病性(图3、表5),但致病力有所差别,其中单隔镰孢的致病性测定结果为均不发病,说明其并不对玉米致病。相同镰孢菌的不同菌株间致病性也不尽相同,如禾谷镰孢S40-8与S31-1-2、木贼镰孢S7-2与S40-7。离体叶片的致病性测定表明,禾谷镰孢、木贼镰孢、锐顶镰孢以及单隔镰孢对玉米叶片不致病,致病菌重新进行分离后的形态学鉴定显示为对应菌(图4)。
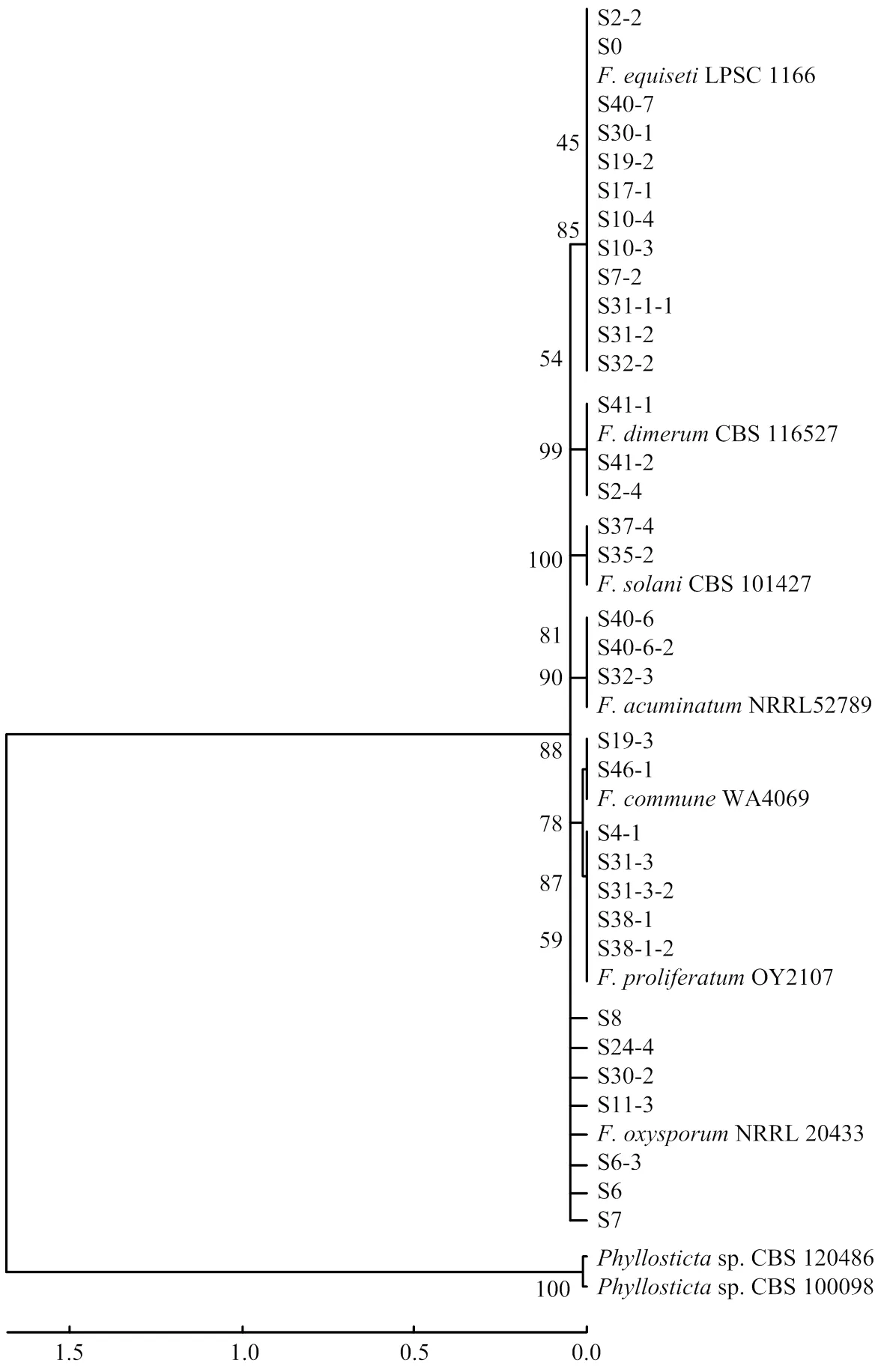
图2 基于ITS、TEF-1α序列构建的镰孢菌系统发育树

表3 构建发育树所用的菌株信息
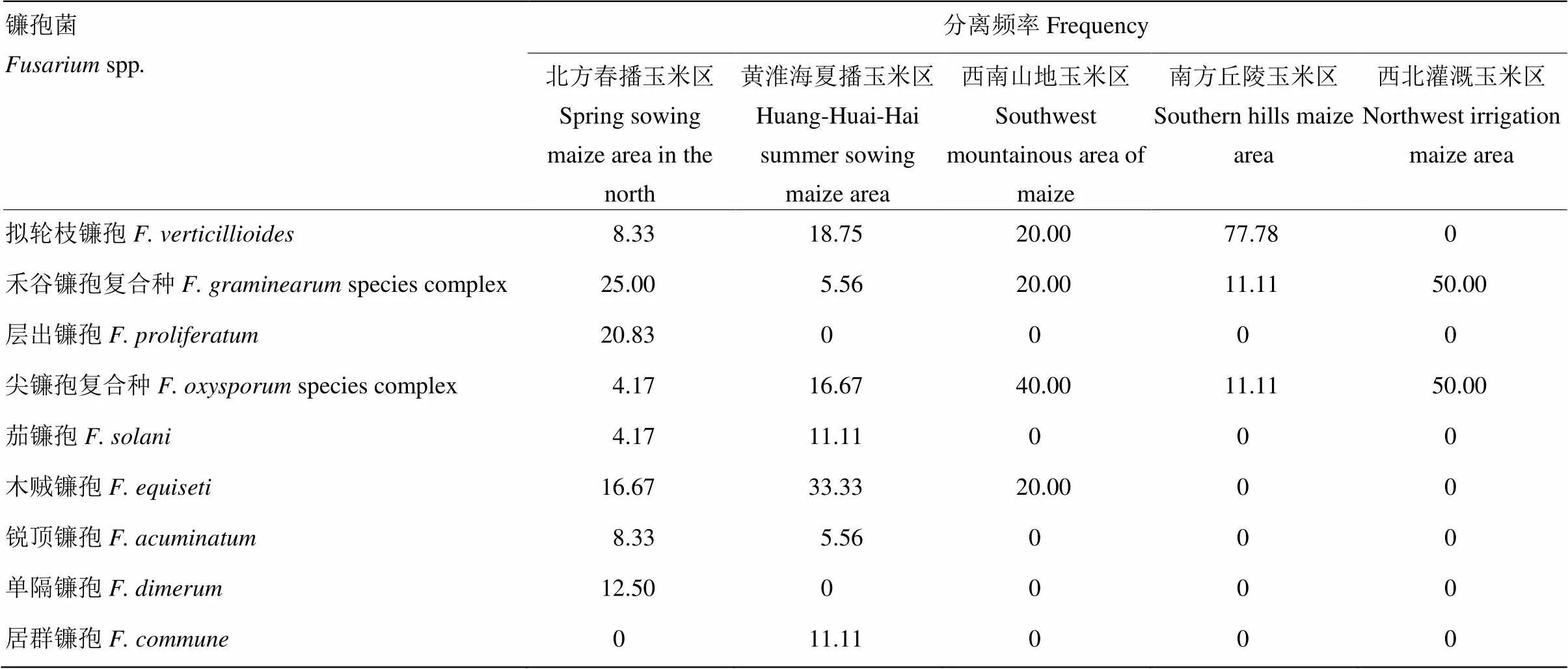
表4 玉米土样镰孢菌分离频率
2.4 土壤镰孢菌含量检测及分析
玉米根际土样中镰孢菌属(表6)的含量为2.91—169.90 pg·g-1,其中含量≤10 pg·g-1的样品7份,≤100 pg·g-1的样品36份,4份样品含量>100 pg·g-1,各样品的含量不同,且在不同时期采取的土样含量也不同。禾谷镰孢的含量最大为78.37 pg·g-1,最小仅为0.76 pg·g-1,各样品的含菌量各异,但含量在1—10pg·g-1的样品最多,共计31份,占总量的70%,其中含菌量最大的是北京昌平实验站的土样,含量为78.37 pg·g-1,拟轮枝镰孢含量检测结果显示,47份样品中的浓度各异,但含量均<10 pg·g-1,最大的为湖北恩施的土样,5.34pg·g-1。其中<1 pg·g-1的共计有35份。
如表7可见,各玉米产区的含菌量各异,其中西南山地玉米区的镰孢菌含量最高,黄淮海夏播玉米区的禾谷镰孢含量较其他种植区高。
3 讨论
本研究中,除广泛分布的拟轮枝镰孢、禾谷镰孢复合种和尖镰孢复合种外,同时也分离到其他6种致病镰孢,其中木贼镰孢分离频率相对较高,是土壤中的常见镰孢菌,这与邹庆甲等对土样的分离结果相似,其余的包括茄镰孢、层出镰孢、单隔镰孢、锐顶镰孢的分离频率较低,只能在少部分的地区可以分离得到[24]。镰孢菌分离频率的差异与每个玉米产区的气候、环境、耕作制度及种植品种都有一定关系,也不排除样本量小的原因。本文通过对全国各大玉米产区的土样进行分离鉴定,了解各玉米产区土样中镰孢菌的种类与分布,为玉米土传病害的预防提供了一定的参考依据。针对镰孢菌的分子鉴定,以及的检测均有报道,本文通过双基因构建系统发育树,进一步确认鉴定得到的镰孢菌,具有更好的准确性[4-6,24]。

发病植株Infected seedling:居群镰孢F. commune;发病种子Infected seed:禾谷镰孢F. graminearum。A:拟轮枝镰孢F. verticillioides;B:尖镰孢F. oxysporum;C:居群镰孢F. commune;D:禾谷镰孢F. graminearum;E:木贼镰孢F. equiseti;F:锐顶镰孢F. acuminatum;G:单隔镰孢F. dimerum;H:茄镰孢F. solani;I:层出镰孢F. proliferatum
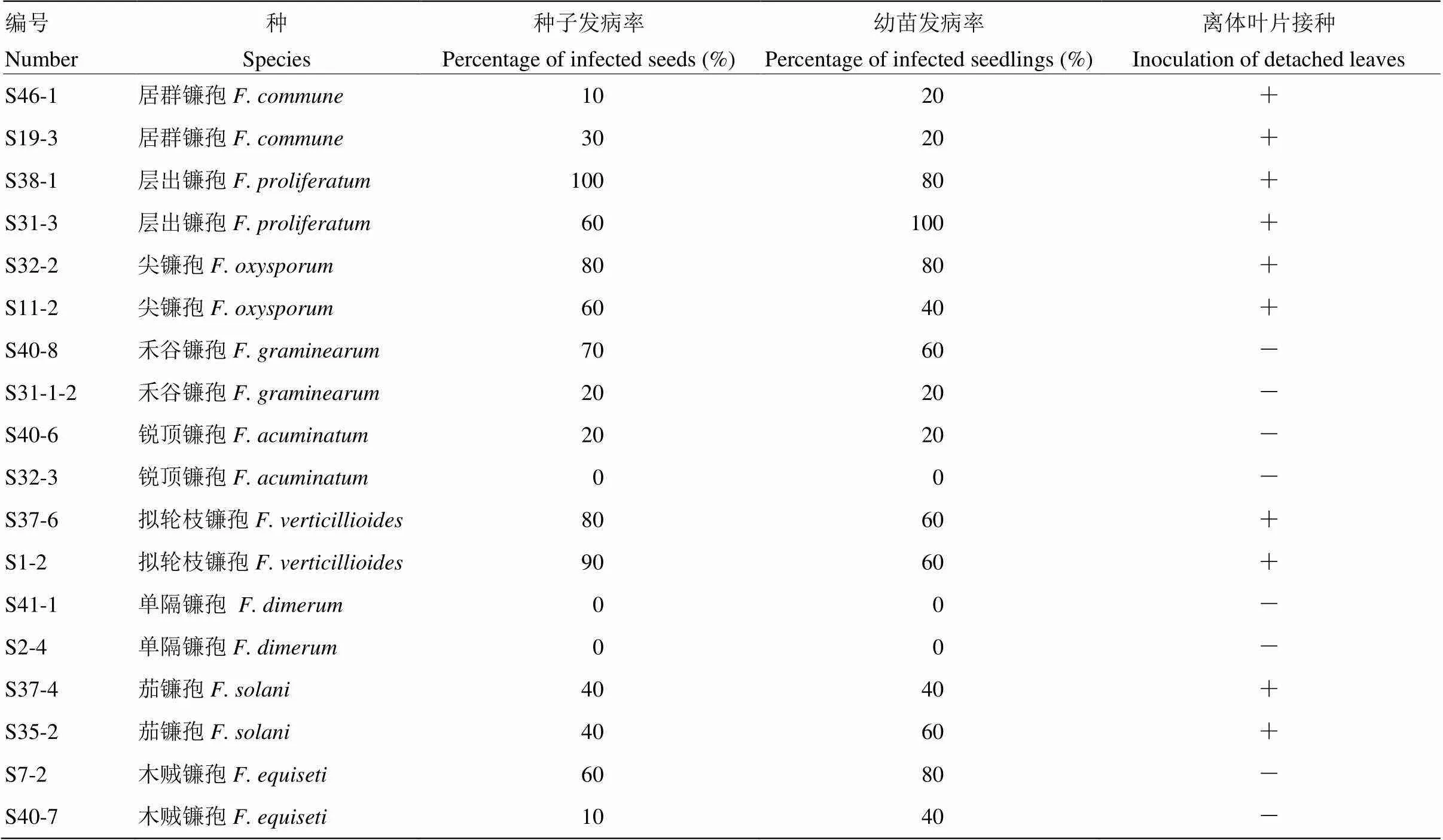
表5 镰孢菌对玉米的致病性测定
“+”:离体叶片接种发病The incidence ofleaf inoculation;“-”:离体叶片未发病No leaf lesions

表6 不同地点土样镰孢菌含量检测
表中数据为平均数±标准误 Data in the table are average±SE

A:拟轮枝镰孢F. verticillioides;B:层出镰孢F. proliferatum;C:木贼镰孢F. equiseti
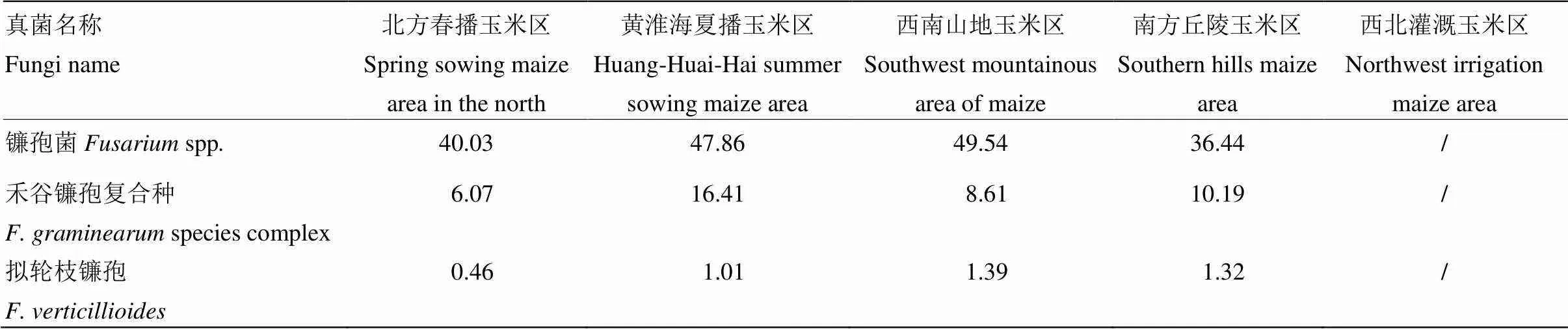
表7 不同玉米产区镰孢菌检测含量
通过3种致病力检测发现,单隔镰孢并不对玉米致病,是引起枸杞根腐病的主要致病菌[25]。致病力较弱的为锐顶镰孢和居群镰孢,其中锐顶镰孢的致病寄主广泛,包括小麦、苜蓿、玉竹等,主要引起大豆根腐病,也有引起玉米穗腐的报道[26-29]。本研究分离得到的2个居群镰孢分离物,是荷花腐败病与荸荠枯萎病的致病菌[30-31],为尖镰孢的近源种,致病性测定表明,该菌在玉米上可以致病,尚属首次。
通过对47份土样的拟轮枝镰孢、禾谷镰孢以及镰孢菌属的RT-qPCR检测,结合镰孢菌分离频率进行分析,其中分离频率最高的拟轮枝镰孢其检测含量较禾谷镰孢低,可能与拟轮枝镰孢可产生众多的小型分生孢子,更容易分离得到有关,培养基的选择同样也影响着分离频率。不同土样中的镰孢菌含量各不相同,其中北京昌平的土样中镰孢菌含量较其他地区土样的高,尤其是禾谷镰孢的含量。究其原因,可能是由于土样来自本实验室用于玉米穗腐病抗性鉴定的地块,玉米镰孢穗腐病的人工接种有助于土壤中禾谷镰孢的积累。
鉴于玉米产区是根据不同种植习惯以及坏境条件来区分的,通过统计比较每个玉米产区的镰孢菌含量,其中以黄淮海夏播玉米区的禾谷镰孢复合种的平均含量最高,了解到该区的主要种植方式是小麦玉米两茬套种,禾谷镰孢亦是小麦主要病害赤霉病的致病菌,小麦以及玉米均可为禾谷镰孢的积累提供寄主,连年积累的土样中的含量相对而言高于其他种植区域。
4 结论
从采自17个省(自治区、直辖市)的47份玉米根际土壤中分离鉴定出9种镰孢菌,其中拟轮枝镰孢、木贼镰孢和禾谷镰孢复合种为优势镰孢种,居群镰孢为首次在玉米根际土壤中分离得到,并证实其对玉米具有致病性。不同地区的土样中镰孢菌含量差异较大,西南山地玉米区的镰孢菌含量最多,黄淮海玉米土样中的禾谷镰孢含量高于其他区域。
[1] 纪莉景, 栗秋生, 王连生, 李聪聪, 孔令晓. 河北省夏玉米苗期根病发生现状及病原初探. 玉米科学, 2014, 22(6): 138-141.
JI L J, LI Q S, WANG L S, LI C C, KONG L X. Occurrence and identification of maize root rot diseases and the pathogens in Hebei Province., 2014, 22(6): 138-141. (in Chinese)
[2] Duan C X, Qin Z H, Yang Z H, Li W X, Sun S L, Zhu Z D, Wang X M. Identification of pathogenicspp. causing maize ear rot and potential mycotoxin production in China., 2016, 8(6): 186.
[3] Lal S, Singh I S. Breeding for resistance to downy mildews and stalk rots in maize., 1984, 69(2): 111-119.
[4] 秦子惠, 任旭, 江凯, 武小菲, 杨知还, 王晓鸣. 我国玉米穗腐病致病镰孢种群及禾谷镰孢复合种的鉴定. 植物保护学报, 2014, 41(5): 589-596.
QIN Z H, REN X, JIANG K, WU X F, YANG Z H, WANG X M. Identification ofspecies andspecies complex causing maize ear rot in China., 2014, 41(5): 589-596. (in Chinese)
[5] 郭成, 魏宏玉, 郭满库, 何苏琴, 金社林, 陈红梅, 王晓鸣, 郭建国. 甘肃玉米穗腐病样品中轮枝镰孢菌的分离鉴定及生物学特性. 植物病理学报, 2014, 44(1): 17-25.
GUO C, WEI H Y, GUO M K, HE S Q, JIN S L, CHEN H M, WANG X M, GUO J G. Isolation, identification and biological characteristics offrom maize ear rot samples in Gansu Province., 2014, 44(1): 17-25. (in Chinese)
[6] 唐琳, 赵辉. 豫西地区茄科作物土壤镰孢菌的种群多样性分析. 中国蔬菜, 2013(24): 65-69.
TANG L, ZHAO H. Species diversity analysis onof Solanaceae crops soil in western Henan Province., 2013(24): 65-69. (in Chinese)
[7] 黎永坚, 陈远凤, 喻国辉, 陈燕红, 戴宇光. 粉蕉种植土镰刀菌分离与鉴定. 广东农业科学, 2014(16): 74-80.
LI Y J, CHEN Y F, YU G H, CHEN Y H, DAI Y G. Separation and identification ofin banana planted soil., 2014(16): 74-80. (in Chinese)
[8] 刘金波, 许艳丽, 魏巍. 大豆根际土壤镰孢菌不同分离方法比较. 大豆科学, 2008, 27(1): 106-112.
LIU J B, XU Y L, WEI W. Comparing different methods for isolatingfrom soybean rhizosphere soil., 2008, 27(1): 106-112. (in Chinese)
[9] 孙广林, 夏永胜, 张中原. 关于大豆配方施肥的研究与应用. 土壤通报, 2007, 38(3): 527-530.
SUN G L, XIA Y S, ZHANG Z Y. Recommended fertilization for soybean and its application., 2007, 38(3): 527-530. (in Chinese)
[10] 魏巍, 许艳丽, 刘金波, 李春杰, 韩晓增, 李文滨, 李淑娴. 土壤镰孢菌real-time qPCR定量方法的建立及应用. 大豆科学, 2010, 29(4): 655-658, 662.
Wei W, Xu Y L, Liu J B, Li C J, Han X Z, Li W B, Li S X. Development and application of a real-time quantitative PCR assay for detection ofspp. in soil., 2010, 29(4): 655-658, 662. (in Chinese)
[11] SCHENA L, NIGRO F, IPPOLITO A. Real-time PCR detection and quantification of soilborne fungal pathogens: the case of,,, and., 2004, 43: 273-280.
[12] 王宏乐. 荧光定量PCR监测黄瓜根分泌物对土壤中枯萎病菌生物量的影响. 上海交通大学学报 (农业科学版), 2010, 28(1): 41-45.
WANG H L. Effects of root exudates of cucumber on population off. sp.in soil as detected by real-time PCR., 2010, 28(1): 41-45. (in Chinese)
[13] Nam H M, Srinivasan V, Gillespie B E, Murinda S E, Oliver S P. Application of SYBR green real-time PCR assay for specific detection ofspp. in dairy farm environmental samples., 2005, 102(2): 161-171.
[14] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科学技术出版社, 1999.
Lu C K.. Beijing: China Agricultural Science and Technology Press, 1999. (in Chinese)
[15] Leslie J F, Summerell B A.. Blackwell Pub Professional, 2006.
[16] 王拱辰. 常见镰刀菌鉴定指南. 北京: 中国农业科学技术出版社, 1996.
Wang G C.. Beijing: China Agricultural Science and Technology Press, 1996. (in Chinese)
[17] Bluhm B H, Flaherty J E, Cousin M A, Woloshuk C P. Multiplex polymerase chain reaction assay for the differential detection of trichothecene- and fumonisin-producing species ofin cornmeal., 2002, 65(12): 1955-1961.
[18] Nicholson P, Simpson D R, Weston G, Rezanoor H N, Lees A K, PARRY D W, JOYCE D. Detection and quantification ofandin cereals using PCR assays., 1998, 53(1): 17-37.
[19] Mishra P K, Fox R T, Culham A. Development of a PCR-based assay for rapid and reliable identification of pathogenic Fusaria., 2003, 218(2): 329-332.
[20] Mule G, Susca A, Stea G, Moretti A. A species-specific PCR assay based on the calmodulin partial gene for identification of,and., 2004, 110(5/6): 495-502.
[21] 葛波. 土壤镰孢菌检测技术的建立及其应用[D]. 重庆: 西南大学, 2018.
GE B. Establishment and application of detection technology forspp. in soil[D]. Chongqing: Southwest University, 2018. (in Chinese)
[22] 葛波, 杨洋, 张申萍, 王晓鸣, 陈国康, 段灿星. 禾谷镰孢荧光定量检测体系的建立及其在玉米苗枯病上的应用. 植物保护学报, 2018, 45(3): 409-415.
GE B, YANG Y, ZHANG S P, WANG X M, CHEN G K, DUAN C X. Development of fluorescent quantitative detection system for fungal pathogenand its application in maize seedling blight., 2018, 45(3): 409-415. (in Chinese)
[23] 周丹妮. 重庆地区玉米穗腐病致病镰孢鉴定及其产毒能力分析[D]. 重庆: 西南大学, 2017.
ZHOU D N. Identification of pathogenicspp. causing maize ear rot and analysis of their toxigenicity in Chongqing[D]. Chongqing: Southwest University, 2017. (in Chinese)
[24] 邹庆甲, 王树桐, 梁魁景, 王亚南, 胡同乐, 韩之琪, 曹克强. 河北省苹果园土壤中疑似致病镰孢菌种类. 菌物学报, 2014, 33(5): 976-983.
ZOU Q J, WANG S T, LIANG K J, WANG Y N, HU T L, HAN Z Q, CAO K Q. Suspected pathogenicspp. isolated from apple orchard soils in Hebei Province., 2014, 33(5): 976-983. (in Chinese)
[25] 李捷. 甘肃省枸杞根腐病病原及生理生化抗病机理研究[D]. 兰州: 甘肃农业大学, 2015.
LI J. The root rot pathogens ofin Gansu Province and physiological biochemical mechanism of resistance[D]. Lanzhou: Gansu Agricultural University, 2015.(in Chinese)
[26] Arias M M, Leandro L F, Munkvold G P. Aggressiveness ofspecies and impact of root infection on growth and yield of soybeans., 2013, 103(8): 822-832.
[27] 支叶, 孙菲菲, 孙素丽, 段灿星, 朱振东. 黑龙江省大豆根腐病菌锐顶镰孢鉴定. 中国油料作物学报, 2014, 36(6): 789-793.
ZHI Y, SUN F F, SUN S L, DUAN C X, ZHU Z D. Identification ofcausing soybean root rot in Heilongjiang Province., 2014, 36(6): 789-793. (in Chinese)
[28] Mesterházy, Lemmens M, Reid L M. Breeding for resistance to ear rots caused byspp. in maize-a review., 2012, 131(1): 1-19.
[29] 周阳阳, 杨洪一. 玉竹锐顶镰孢菌的生物学特性及药剂防治. 中国农学通报, 2010, 26(9): 315-318.
Zhou Y Y, Yang H Y. Biological characterization and chemical on the control ofpathogen of., 2010, 26(9): 315-318. (in Chinese)
[30] 曾莉莎, 郑芝波, 吕顺, 夏玲, 邓志平, 胡规媛, 杜彩娴, 麦进培, 周建坤. 荷花腐败病病原菌的形态学与多基因分子系统学鉴定. 植物病理学报, 2017, 47(2): 162-173.
ZENG L S, ZHENG Z B, LÜ S, XIA L, DENG Z P, HU G Y, Du C X, MAI J P, ZHOU J K. Identification of pathogen causing rhizome rot of lotus () based on morphology and multi-gene sequence analysis., 2017, 47(2): 162-173. (in Chinese)
[31] 朱志贤. 荸荠枯萎病菌病原学、分子检测及防治技术研究[D]. 武汉: 华中农业大学, 2014.
ZHU Z X. Etiology, detection and control ofFusarium wilt of Chinese water chestnut[D]. Wuhan: Huazhong Agricultural University, 2014.(in Chinese)
(责任编辑 岳梅)
Composition and quantitative analysis ofspecies in maize rhizosphere soil
GE Bo1,2, WANG BaoBao1, GUO Cheng3, SUN SuLi1, CHEN GuoKang2, WANG XiaoMing1, ZHU ZhenDong1, DUAN CanXing1
(1Institute of Crop Sciences/National Key Facility of Crop Gene Resources and Genetic Improvement, Chinese Academy of Agricultural Sciences, Beijing 100081;2College of Plant Protection, Southwest University, Chongqing 400715;3Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou 730070)
【Objective】The objective of this study is to understand the population structure and relative content ofspp. in maize rhizosphere soil in China, and to provide an early warning of the occurrence of soil-borne maize diseases.【Method】Using dilution plate method, a total of 58isolates were obtained from 47 maize soil samples of 17 provinces (autonomous region, municipality). Based on morphological characteristic, specific PCR amplification, andandgene sequences analysis, thesespp. were further determined. The reference strain sequences were downloaded from GenBank andMLST. Multi-gene loci phylogenetic tree was constructed by neighbor-joining method (NJ) using MEGA 6.0 software. Some representative strains were selected for pathogenicity test by maize seedlings, seeds andleaves infection. The content ofspp. and some species in maize rhizosphere soil samples was detected using RT-qPCR determination system. Statistical analysis was carried out for different maize producing areas.【Result】 A total of 9species were identified. Among them,(22.41%),(20.69%) andspecies complex (18.97%) were isolated more frequently. The rest of 6 species werespecies complex,,,,and, with the isolation frequency of 12.07%, 8.62%, 5.17%, 5.17%, 3.40%, and 3.40%, respectively. The results showed that the samespp. and the reference strain were in the same branch, and the diversity ofspp. existed in different regions. Allspecies were pathogenic except.was isolated from maize rhizosphere soil and confirmed to be pathogenic to maize seed, seedling, and detached leaf for the first time. The pathogenicity of different strains of the samespecies was not the same. Using RT-qPCR detection system, the total of,andspecies complex in maize soil samples were quantitatively assayed, with the content range of 2.91-169.90, 0.08-5.34 and 0.76-78.37 pg·g-1, respectively. The content ofspecies in different maize producing areas was different, and the content ofwas higher than that of【Conclusion】There are multiple species ofin maize rhizosphere soil and,, andspecies complex are dominant species. The content ofspp. differs in different areas. Among them, the content ofspp. is the highest in Southwest mountainous area of maize, and thecontent in the Huang-huai-hai summer sowing maize area is higher than that in other regions.
maize;rhizosphere soil;spp.; RT-qPCR
2018-04-11;
2018-06-12
国家重点研发计划(2016YFD0100103)、国家现代农业(玉米)产业技术体系(CARS-02)、中国农业科学院农业科技创新工程
葛波,E-mail:295024054@qq.com。 通信作者段灿星,E-mail:duancanxing@caas.cn
10.3864/j.issn.0578-1752.2018.19.006