杜仲内生细菌DZSY21诱导玉米抗小斑病的系统抗性研究
2018-10-15孙黄兵钟年孝孔令茹丁婷马元山
孙黄兵, 钟年孝, 孔令茹, 丁婷, 马元山
(1. 安徽农业大学 植物保护学院, 合肥 230036; 2. 安徽农业大学 农业园管理中心, 合肥 230036)
玉米小斑病(Bipolarismaydis)是玉米常见的重要病害之一,主要危害玉米的苞叶和叶片,严重时则会导致果穗下垂掉落,可导致玉米产量减少一半以上[1-3]。目前,对玉米小斑病的防治常采用化学防治,但化学药剂的长期使用,在导致植物病原菌产生抗药性,降低药效的同时,还存在对环境的污染,对人类健康以及生态平衡的危害。生物防治以其无毒无污染、不产生抗药性等优点在农业生产中受到了越来越多的关注。目前,用于植物病害生物防治的微生物种类主要有真菌、细菌以及放线菌。
研究表明水杨酸(Salieylicaeid,SA)、茉莉酸(jasmonic acid,JA)和乙烯(Ethylene,ET)在植物防卫中可作为内源信号,介导植物形成相应的水杨酸、茉莉酸和乙烯信号通路,继而引发植物的抗病性。植物防卫反应的机制主要有2种类型:由病原微生物等诱导的系统获得抗性(systemic acquired resistance,SAR)和由非病原性微生物介导的诱导系统抗性(induced systemic resistance,ISR)[4]。SAR主要通过内源水杨酸的合成和积累,激活SA信号通路,诱导效应基因PRS表达;而ISR的信号传导主要依赖于感应植物激素茉莉酸和乙烯[5-6]。目前,大量研究主要集中于根围促生菌对植物抗病性的诱导方面,而对拮抗内生菌引入植株,诱导其抗病性机制方面的报道相对较少。本课题组前期自杜仲植物中分离到的一株内生枯草芽孢杆菌DZSY21(BacillussubtilisDZSY21),对玉米小斑病表现出良好的抗病效果,MALDI-TOF-MS质谱显示菌株DZSY21可产生多种抑菌物质[7]。因此,本试验将杜仲拮抗内生细菌DZSY21引入玉米植株,检测玉米相关防御酶活性、抗病相关信号通路标志基因表达情况,以期进一步明确DZSY21菌株诱导玉米植株抗小斑病的作用机理,对于全面了解拮抗内生菌与植物抗病机制之间的关系具有重要意义。
1 材料与方法
1.1 菌种来源
生防菌株为前期研究中获得的一株离体条件下对玉米小斑病以及玉米纹枯病菌具有较好抑菌活性的杜仲内生细菌,编号为DZSY21 (BacillussubtilisDZSY21),NCBI登录号为KP777560,已保藏于中国微生物菌种保藏管理委员会普通微生物中心(保藏编号: CGMCC NO. 11749)。玉米小斑病菌(Bipolarismaydis)由安徽农业大学植物保护学院植物病理学教研室提供。
1.2 供试玉米品种
玉米自交系昌7-2。
1.3 供试培养基和化学药剂
培养基:马铃薯葡萄糖固体培养基(PDA)[8]和牛肉膏蛋白胨固体培养基(NA)[9]分别用于玉米小斑病菌及杜仲内生细菌DZSY21的培养及保存。
50%多菌灵可湿性粉剂(青岛瀚正益农生物科技有限公司):用无菌水配成50 μg/mL溶液,贮藏备用。
1.4 DZSY21菌悬液制备
菌株DZSY21接种于牛肉膏蛋白胨液体培养基中,摇床转速为160 r/min,于37℃培养8 ~ 10 h,调节发酵液中DZSY21的菌体浓度至1.0×106cfu/mL,获得DZSY21菌悬液。
1.5 玉米小斑孢子悬浮液制备
将培养好的玉米小斑病菌接种在玉米粒培养基上,置于27℃恒温培养箱4~5 d,取出用纱布洗去表面的营养菌丝,然后平铺在托盘上,在紫外灯下照射60 min,取出,放在室温保湿培养2~3 d,用灭过菌的水清洗带有玉米小斑病菌的玉米粒,用血球计数板测定孢子浓度。
1.6 生防菌DZSY21引入玉米植株对玉米植株酶活性的影响
将玉米种子(昌7-2) 依次用1%的次氯酸钠表面消毒10 min,用无菌水冲洗3~5遍后备用。实验田设于安徽农业大学教学实习基地农萃园(土壤为黄棕壤土)中,种植方式为垄栽种植,垄面宽 70 cm,垄距 30 cm,株距 30 cm,行距 60 cm,待玉米均长至抽雄期,选择长势相当的玉米健康植株,将浓度为1.0 ×106cfu/mL DZSY21菌悬液喷洒在玉米植株的叶片上(50 mL/株),培养24 h后,于相同部位接种含菌量为1.0×106cfu/mL的玉米小斑病菌分生孢子悬浮液(50 mL/株),实验进行如下4种处理:1)在玉米叶片上先进行枯草芽孢杆菌DZSY21菌悬液处理,再接种玉米小斑病菌分生孢子悬浮液的混合处理组(SB);2)植物病原菌玉米小斑病菌分生孢子液处理(B);3)枯草芽孢杆菌DZSY21菌悬液处理组(S);4)空白对照处理(CK)。
每种处理20株为1组重复,设3组重复,菌株DZSY21引入玉米叶片,于接种玉米小斑病菌后的第4、6、8、10和第15 天进行玉米小斑病害调查的同时,将提取上述4种处理组的玉米叶片的粗酶液。每种处理5株为1组重复,设3组重复。
1.6.1 酶活性测定 参照相关方法对PPO、POD和PAL 3种酶活进行测定[10-11]。
1.6.2 诱导效应计算公式 DZSY21在单菌体系中对玉米叶片3种酶活性的诱导效应(分别用APPO、APOD、APAL表示):A=(S处理组酶活性-CK处理组酶活性)/ CK处理组酶活性×100%。
DZSY21在双菌体系中对玉米叶片3种酶活性的诱导效应(分别用BPPO、BPOD、BPAL表示):B=(SB处理组酶活性-B处理组酶活性)/ B处理组酶活性×100%。
1.7 生防菌DZSY21诱导玉米系统抗性的研究
1.7.1 RNA提取和CDNA合成
玉米种子(昌7-2) 依次用1%的次氯酸钠表面消毒10 min,用无菌水冲洗3~5遍后进行温室(28℃~30℃)栽植。待玉米长至第9叶时期,将浓度为106cfu/mL DZSY21菌悬液喷洒在玉米植株下面的1~4片叶子上,培养12 h后,于相同部位接种玉米小斑病菌分生孢子悬浮液(含菌量为1.0×106cfu/mL)。实验设3个处理组: 1)在玉米叶片上先进行枯草芽孢杆菌DZSY21菌悬液处理,再接种玉米小斑病菌分生孢子悬浮液的混合处理组(SB);2)植物病原菌玉米小斑病菌分生孢子液处理(B);3)空白对照处理(CK)。于玉米小斑病菌接种后的第12、24、36、48和第60小时取第6~9片叶的玉米叶片,进行RNA提取。每种处理45株玉米植株,每次取样 9棵玉米(3株为1组重复,3组重复),样品为3株玉米植株第6~第9片叶的混合物。利用Invitrogen公司的试剂盒对样品进行RNA提取及cDNA合成。
1.7.2实时定量PCR
PCR反应体系如表1所示,反应程序为:95℃预变性10 min;95℃变性15 s,60℃退火1 min,共40个循环,反应结束后采用2-ΔΔCT[ΔCT=CT目标基因-CT内参基因。ΔΔCT=ΔCT处理后-ΔCT对照]计算公式计算所得的数据,每个样重复3次。所测基因以及内参基因的引物序列如表2所示。

表1 实时荧光定量PCR反应体系
2 结果与分析
2.1 生防菌DZSY21引入玉米植株对玉米植株防御酶活性的影响
2.1.1 生防菌DZSY21引入玉米植株对玉米植株PAL活性的影响
玉米在不同生长时期叶片的PAL活性如表3所示。S处理及SB处理均可诱导玉米叶片的PAL活性,其中,接种玉米小斑孢子悬浮液后第6 天时,不同处理组的PAL活性均达到最大,随着生长时间的延长,4种处理组酶活均呈现缓慢下降趋势;此外,不同生长时间段的S处理组的PAL活性增长率APAL均小于SB处理组的PAL活性增长率BPAL,说明SB处理组对玉米叶片PAL活性的诱导效应好于S处理组。
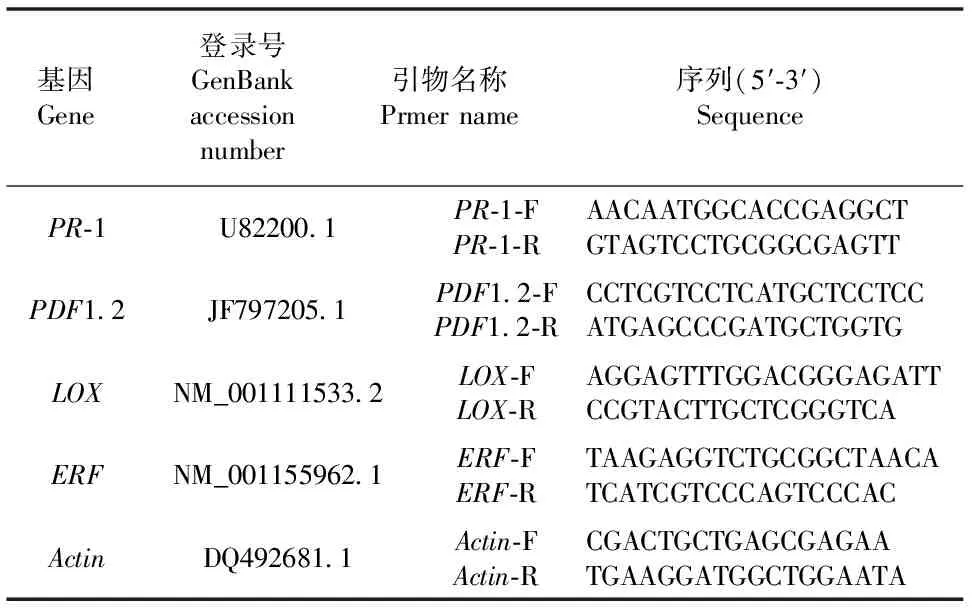
表2 实时荧光定量引物序列

表3 不同处理组的玉米叶PAL活性
注:APAL,S处理组的PAL活性增长率;BPAL,SB处理组的PAL活性增长率
2.1.2 生防菌DZSY21引入玉米植株对玉米植株P0D活性的影响
表4为不同处理组的玉米植株在不同生长时期叶片的POD活性变化情况。S处理及SB处理均对玉米叶片POD活性有一定的诱导作用,接种玉米小斑孢子悬浮液后第8天时,上述两种处理组的玉米叶片POD活性均达到最大。且SB处理对POD的诱导效应大于S处理,接种玉米小斑病菌后3、4、6、8和10 d,SB处理POD活性增长值BPOD分别是S处理酶活增长值APOD的2.1、1.8、1.7、3.1和4.5倍。

表4 不同处理组的玉米叶POD活性
注:APOD,S处理组的POD活性增长率;BPOD,SB处理组的POD活性增长率
2.1.3 生防菌DZSY21引入玉米植株对玉米植株PPO活性的影响
表5为不同处理组的玉米植株在不同生长时期叶片PPO活性的变化情况。接种玉米小斑病菌后,SB处理组相对于其他处理组,可明显提高玉米叶片PPO酶活性的变化,并在第8天酶活达到最大值。比较可知,接种玉米小斑病菌后额第4、6和第8天,S处理对PPO的诱导效应大于SB处理,S处理POD活性增长值APPO分别是SB处理酶活增长值BPPO的14.92、26.04和1.80倍。

表5 不同试验处理组的玉米叶部PPO活性
注:APPO,S处理组的PPO活性增长率;BPPO,SB处理组的PPO活性增长率
2.2 拮抗菌株DZSY21诱导玉米植株系统抗性(ISR)的研究
于接种玉米小斑病菌后的12、24、36、48和60 h对3种不同处理组中与水杨酸(SA)、茉莉酸(JA)以及乙烯(ET)信号传导途径相关的PR-1、PDF1.2、LOX、ERF4个关键基因进行实时荧光定量分析[12]。结果表明(图1)枯草芽孢杆菌DZSY21菌悬液处理玉米叶片,能明显诱导玉米植株中的PR1、LOX基因表达水平的上调,其PR-1的表达水平在接种后的第48小时,增强幅度分别约是对照处理组和B处理组的5.68倍、1.37倍,随后表达水平略微降低;其LOX的表达水平于接种后的第12~36小时呈增加趋势,并在接种后的第36小时达到最高,增强幅度分别约是对照处理组和B处理组的3.18倍、4.36倍。与此同时,经DZSY21处理的玉米植株,PDF1.2、ERF两种基因表达量上调趋势相对较弱, 接种后的第36小时,其PDF1.2的表达水平相比对照,上调1.60;此外,玉米叶片引入DZSY21菌悬液,于接种病原菌后的不同生长时期,ERF基因的表达呈现缓慢上升并逐渐下降的趋势。鉴于PR1是水杨酸途径(SA)信号通路的关键基因,而LOX及PDF1.2是茉莉酸途径(JA)信号通路的关键基因[13-14],因此可知DZSY21菌株引入玉米叶片,诱导玉米中的水杨酸(SA)和茉莉酸(JA)信号通路,激活LOX、PR1和PDF1.2基因的表达。

A:病程相关蛋白-1(PR-1);B:脂氧合酶(LOX);C:乙烯响应因子(ERF);D:拟南芥防卫基因(PDF1.2)
图1拮抗菌株DZSY21诱导玉米植株4种基因的表达变化
Fig 1 Expression of the four genes triggered by the endophytic bacterium DZSY21
3 讨论
芽孢杆菌(Bacillusspp.)是一类重要的植物生防菌,其对植物的生防机制是复杂多样的,已有研究表明主要包括直接防病和间接防病途径。直接防病主要指:芽孢杆菌自身可产生脂肽类等相关抗菌物质[15],或通过竞争等机制[16]来抑制植物病原菌的生长;芽孢杆菌的间接防病机制主要是刺激植物产生诱导抗病性[17-18],降低植物病害的发生。
芽孢杆菌的间接生防机制包括抗病信号的产生与转导、防卫反应的表达与调控等。其中苯丙氨酸解氨酶(Phenylalanine,PAL)、过氧化物酶(Peroxidase,POD)以及多酚氧化酶(Polyphenol,PPO)在植物的抗病方面起着非常重要的作用,因此,这3种酶类通常被用来作为植物抗病性的判别指标[19-20]。该试验结果表明,枯草芽孢杆菌DZSY21菌悬液处理玉米植株后,可诱导玉米叶片中PAL、POD、PPO等3种防御酶活性的变化,说明DZSY21作为外源刺激因子,能够更好地诱导玉米体内相关防御酶活性,这与其他文献报道生防菌能够诱导植物抗病相关酶活的结果一致[21-22],不仅验证了这些酶与植物抗病性密切相关,还说明了DZSY21在一定程度上对增强玉米抗病性具有良好的效果。
目前,利用根围促生细菌或外源化学因子激发植物抗病性的研究受到越来越多科学工作者的关注,如牛冬冬等[23]发现蜡质芽孢杆菌 AR156可以诱导拟南芥形成SA、JA和ET信号途径,对丁香假单孢菌形成的病害产生抗性。Tan等[24]]研究表明解淀粉芽孢杆菌T-5可以通过触发SA、JA和ET信号通路,提高番茄植株的抗病性,从而有效防止番茄青枯病的发生。而利用植物内生菌诱导植物抗病性的研究则相对较少,本研究利用杜仲拮抗内生细菌DZSY21开展诱导玉米植株抗病性的相关研究,结果表明拮抗菌株DZSY21引入玉米叶片,可诱导玉米中的水杨酸(SA)和茉莉酸(JA)信号通路,激活LOX、PR1和PDF1.2基因的表达。这一研究结果与已报道的大多数关于生防芽孢杆菌诱导植物抗病性的研究具有相似之处。然而,一些研究也表明,芽孢杆菌属微生物在一些植物上诱导形成的抗病性,并不单纯通过上述我们所熟知的SA、JA和ET信号途径,如Takahashi等人研究显示生防微生物苏云金芽孢杆菌则是通过激活SA依赖性信号通路和抑制JA依赖性信号通路,诱导对茄科植物对茄科植物的抗性[25]。由此可知,以芽孢杆菌属为代表的有益微生物诱导植物ISR信号转导途径的形成与有益微生物、寄主植物以及植物病原菌三者之间均存在着密切的关系。
