斑马鱼pkd2基因功能的初步研究❋
2018-10-12赵呈天
韩 霄, 赵呈天
(中国海洋大学海洋生物多样性与进化研究所, 山东 青岛 266003)
多囊肾(Polycystic Kidney Disease, PKD)是一种常见的人类遗传病。患者常常表现出肾囊肿,侧腹部痛,血尿等症状[1-2]。PKD有2种类型,分别是常染色体显性PKD (Autosomal Dominant Polycystic Kidney Disease, ADPKD),以及常染色体隐性PKD (Autosomal Recessive Polycystic Kidney Disease, ARPKD)。常染色体隐性PKD比较少见,由常染色体隐性基因PKHD1控制。
ADPKD相对来说更为常见,病人还会出现颅内动脉瘤,结肠憩室以及心血管疾病。人群中ADPKD的患病率大约在1/1 000~1/500[3]。控制ADPKD的基因有2个,PKD1和PKD2。PKD1编码的polycystin-1是个跨膜蛋白,在细胞信号识别中行使功能[4]。PKD2编码的polycystin-2是一个钙离子通道蛋白,具有6个跨膜区段。在C端胞内区,有EF-Hand和coiled-coil结构域,这些结构域在斑马鱼、小鼠、以及人类中高度保守[5]。事实上,在斑马鱼中,有78%~79%的pkd2序列与人和小鼠是同源的。
polycystin-1和polycystin-2在体内和体外都能通过其C端胞内区稳定结合成异源二聚体[6-7],这一复合物能够感受胞外Ca2+的浓度[8],而且对于细胞间的粘附起到重要作用。例如polycystin-2能够与细胞骨架蛋白Hax-1相互作用[9], 在体内可以与CD2-AP相互作用[10],这2种蛋白会与polycystin-2的C末端相结合。在人类的肾脏中,polycystin-1和polycystin-2都定位在肾小管上皮细胞的纤毛上,纤毛的缺陷会直接导致该信号通路的阻断,进而引起PKD[11-12]。
斑马鱼是研究纤毛缺陷的良好模式动物[13],斑马鱼pkd2基因与PKD2同源[14]。现在已经鉴定出数个pkd2突变体。目前为止,它们的突变位点大都位于跨膜区。斑马鱼pkd2突变体表现出体轴弯曲,心肌增生,左右不对称异常等缺陷[14-15], 但是纤毛的数目以及运动并没有异常[16]。
斑马鱼的库式泡(Kupffer’s Vesicle, KV)是早期发育过程中左右不对称的决定器官,其中分布着大量的纤毛。库式泡在小鼠中的同源结构是Node,Node与左右不对称的关系已经有比较清楚的阐释:囊泡侧壁的动纤毛驱动其中的液体形成一个从左向右的水流,囊泡中纤毛可通过Polycystin-2 感受周围液体的运动[17],导致此处细胞内钙离子浓度升高[18]进而引起一系列细胞命运的决定。抑制钙离子信号通路将会导致随机的器官左右分布。
本研究利用CRISPR/Cas9方法构建了斑马鱼pkd2的突变体,发现pkd2的突变可导致斑马鱼产生体轴背部弯曲,左右不对称等发育缺陷,而纤毛发育相对正常。同时,我们发现斑马鱼体轴的背部弯曲并非由胶原蛋白的异常表达所导致,这一点与之前的报导并不一致[19]。有趣的是,我们发现抑制FGF信号通路可部分缓解斑马鱼pkd2体轴的弯曲程度,表明FGF信号可能参与调控体轴的发育。鉴于所获得的pkd2突变体突变位点位于C端,编码蛋白仅仅缺失所编码蛋白的胞内区,上述实验结果表明胞内区对polycystin-2的功能至关重要。
1 材料与方法
1.1 实验材料
野生型斑马鱼为Tuebingen品系,胚胎收集后培养于E3培养液中,培养温度为28.5 ℃[20]。Cas9靶位点序列为5’-GAGCTCTATCAATGATATCC-3’,Cas9 mRNA,sgRNA合成方法均依据已报道的步骤[21]。以下引物用以扩增一段包含靶位点的序列:5’-TCTTTTGCTCACAGTTTCACG-3’, 5’-AAAAACAGCCATAACG-3’。
1.2 原位杂交实验
取野生型和突变体胚胎,培养至18 h,剥去卵膜,在含有0.15% PTU的E3中继续培养至48 h,分别在4%多聚甲醛中固定过夜。lefty2,col2a1a,col9a2基因克隆至T3载体。探针合成以及原位杂交实验均按照已报道的步骤[22]。图像采集使用徕卡(Leica)公司M165FC显微镜。
1.3 免疫组化实验
胚胎于4%多聚甲醛中固定过夜,于PBST中洗2次,每次5 min;于蒸馏水中洗2次,每次5 min。在丙酮中洗一次,置于-20℃冰箱中20 min;于蒸馏水中洗2次,每次5 min;于PBST中洗2次,每次5 min;在包含2%山羊血清的PBD(1 ×PBS,1%小牛血清,1% DMSO)中封闭1 h;弃去封闭液,在加入乙酰化微管蛋白抗体(1∶500,Sigma)的PBD孵育,置于4摄氏度冰箱过夜。弃去上清液,于PBD中清洗4次,每次30 min;在PBD中加入二抗(1∶500)以及鬼笔环肽抗体(1∶500, Invitrogen),室温孵育4 h;在PBST中洗4次,加入DAPI(1∶3 000),室温孵育20 min,于Leica TCS SP8共聚焦显微镜下观察并拍摄。
1.4 FGF信号抑制剂处理实验
将pkd2突变体胚胎于18 hpf时期剥去卵膜,置于25 μmol/L浓度SU5402的E3溶液培养至72 hpf,使用LeicaM165FC显微镜观察并拍摄。
2 实验结果
2.1 pkd2突变体的构建及鉴定
pkd2编码一个6次跨膜蛋白,N端和C端均位于胞内区,其编码基因包含14个外显子。使用CRISPR/Cas9技术得到了其突变体,靶位点位于第十个外显子上,导致C端胞内区的几个重要结构域发生移码突变(见图1A)。靶位点序列中包含有1个EcoRV酶切位点,敲除之后该酶切位点也随之缺失。因此,可以通过在靶位点上下游设计一对引物,扩增出一段563 bp长度的片段,用酶切的方法鉴定突变个体。野生型个体中,EcoRV将该片段完全消化成174和389 bp的两段,而F1代杂合子只有部分片段能够被消化(见图1B)。
胚胎发育至第二天,pkd2突变体表现出典型的体轴向背侧弯曲的表型。而且观察到,体轴的弯曲程度随着个体发育变得越来越严重,且纯合突变个体无法存活至成年。有报道称,吗啉环反义寡核苷酸干扰pkd2基因会导致肾脏囊肿的形成[14],pkd2突变体中并未发现这种表型(见图1C、D)。
2.2 纤毛观察以及左右不对称缺陷
鉴于polycystin-2主要存在于纤毛上,对pkd2突变体的纤毛进行了检测。免疫组化结果显示,发育至第二天,pkd2突变体的肾管纤毛并未出现数目以及形态的异常(见图2),同时也未在其它组织纤毛上发现明显异常(图未出示)。进一步使用lefty2这一心脏原基的标记基因作为探针,对受精后22小时的野生型和pkd2突变体胚胎分别进行原位杂交实验(见图3A)。结果表明,在野生型胚胎中,lefty2的表达几乎都在身体左侧(n=26),只有极少数在身体右侧(n=1)和中间(n=1)。发育早期尚无法区分pkd2纯合突变体,我们观察到在pkd2杂合突变体的后代中,有大约1/4出现lefty2表达在身体右侧(n=6)和中间(n=7)的情况,其余约3/4表达在身体左侧(n=35)(见图3 B)。
2.3 pkd2突变体体轴弯曲与胶原蛋白表达无关
之前报导pkd2突变体体轴弯曲可能是由于胶原蛋白的异常表达所致,因此我们检测了所获得突变体中胶原蛋白基因col2a1a,col9a2的表达状况。与之前的结果不同,col2a1a,col9a2基因的表达在pkd2突变体和野生型中并没有明显区别(见图4)。这说明,胶原蛋白基因的表达异常不是导致pkd2突变体的体轴弯曲的直接原因。
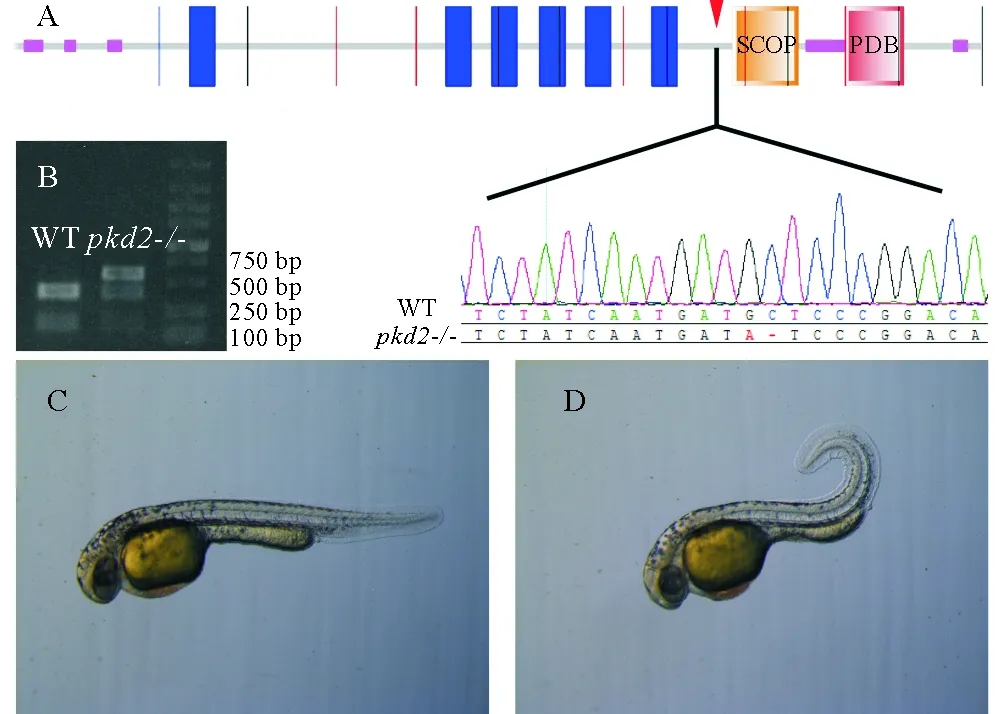
(A.polycystin-2结构域分析,使用SMART软件,敲除位点位于第十外显子;B.pkd2突变体的酶切鉴定;C. 发育至2天的野生型;D. 发育至2天的pkd2突变体斑马鱼。A. Structure and the mutant locus of polycystin-2, predicted by SMART software. Mutant has a 1-bp deletion in the tenth exon; B. Sample electrophoresis image for identification ofpkd2allele; C. External phenotype of 2dpf WT mutant embryo;D. External phenotype of 2dpfpkd2-/- mutant embryo.)
图1pkd2突变体构建
Fig.1 Generation of zebrafishpkd2mutant
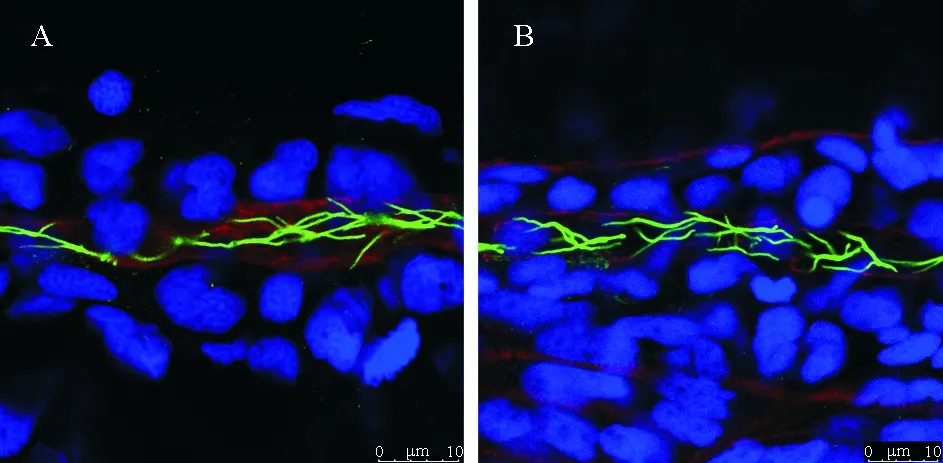
(A.野生型; B.pkd2突变体。绿色:乙酰化微管蛋白抗体标记纤毛;蓝色:DAPI;红色:鬼笔环肽。 Cilia were visualized by anti-acetylated alpha-tubulin antibody showing in green.(Blue, DAPI; Red, phalloidin.)
图2 野生型和pkd2突变体的肾管纤毛免疫组化
Fig.2 Immunostaining results of pronephric duct cilia in WT andpkd2mutantembryos

(lefty2在胚胎体轴左侧,右侧和中间位置的表达图式;B.lefty2在野生型和pkd2突变体中表达位置的数量统计,L:左侧;R:右侧;M:中间。A~A″.Sample images showing expression oflefty2 in the Left, Right and Middle parts of embryos; B. Bar graph showing statistic results oflefty2 expression in WT andpkd2 embryos.)
图3pkd2杂合子后代22 hpf胚胎lefty2原位杂交
Fig.3 Expression oflefty2 in 22 hpf WT andpkd2mutant embryos

(A~A’. 野生型(A)和pkd2突变体(A′)躯干部位col2a1a的表达图式;B~B’.野生型(B)和pkd2突变体(B′)躯干部位col9a2的表达图式。A~A’.Expression ofcol2a1ain wild type andpkd2 mutant embryos;B~B’.Expression ofcol9a2 in wild type andpkd2 mutant embryos.)
图4 胶原蛋白基因col2a1a,col9a2原位杂交结果
Fig.4 In situ hybridization ofcol9a2col2a1aandcol9a2
2.4 FGF抑制剂可使pkd2突变体体轴弯曲缺陷部分恢复
为进一步研究pkd2突变体胚胎体轴弯曲的原因,我们利用FGF受体抑制剂SU5402对突变体胚胎进行了处理。在72 h的突变体胚胎中,体轴背部弯曲程度非常严重,而FGF抑制剂处理后的胚胎,体轴背部弯曲化程度发生了部分缓解,表明FGF信号在突变体体轴背部化弯曲过程中发挥一定作用(见图5)。

(A~B.pkd2突变体3dpf胚胎,未经SU5402处理(A)和处理后(B)。)
图5 FGF信号抑制剂处理pkd2突变体胚胎
Fig.5Pkds2 mutant embryos treated with SU5402
3 讨论
本文使用CRISPR/Cas9技术构建了新的pkd2突变体,并且对其表型进行了初步的分析。不同于以往的pkd2突变体,在所获斑马鱼突变体中,pkd2编码的蛋白仅缺失其蛋白C端胞内区(160个氨基酸)。虽然免疫组化的结果表明突变体纤毛发育基本正常,但突变体存在体轴背部弯曲,左右不对称等发育缺陷,表明C端胞内区对polycystin-2功能的发挥至关重要。
此外,我们还在pkd2末端最后一个外显子上设计了一个Cas9靶位点,F0代注射显示胚胎有体轴弯曲的表型。这表明,polycystin-2末端的数个氨基酸的功能可能也是至关重要的。然而在与野生型交配后得到的F1代中,并没有检测到杂合突变体的存在。
吗啉环反义寡核苷酸敲降pkd2可以使胶原蛋白基因col2a1a、col2a2表达增强,我们在pkd2突变体中并未观察到这种现象。另外,敲降col2a1可以挽救pkd2体轴弯曲的缺陷。其原因可能是吗啉环反义寡核苷酸会对基因表达产生一些未知的影响,例如脱靶效应等。另外,CRISPR/Cas9介导的pkd2基因敲除也可能会影响其它基因的表达,其中有可能包含胶原蛋白相关的基因[23]。随着胚胎的发育,我们发现pkd2突变体的体轴弯曲程度在逐渐增大,这暗示着这一表型可能是某种因子持续表达或者作用的结果。有意思的是,我们发现使用FGF受体抑制剂处理pkd2突变体胚胎,可部分恢复突变体体轴弯曲的程度,表明FGF信号可能参与了胚胎体轴的发育调控。
总之,基因以及其表达调控是个复杂的过程,而pkd2突变体体轴弯曲等表型形成的机制还需要进一步的探索。
