智能磁力驱动自愈合水凝胶的制备及性能研究
2018-10-11陈雪鋆谈华平
陈雪鋆,吕 琛,范 茗,谈华平
(南京理工大学材料科学与工程学院,江苏南京210094)
自愈合(self-healing)的概念来源于生物学中的自愈合能力,构成生物体的材料是能随着生物体生长进化而逐步优化的系统,一个最突出的表现就是其在受到外部损伤后,能够表现出自愈合和重建的功能[1]。传统的水凝胶通常不具备自愈合功能,将自愈合概念扩展到这方面则具有十分重要的意义,因而受到越来越多的关注。智能自愈合载药支架材料作为皮肤和肌肉等软组织缺损填充替代物越来越受到重视,其中,智能磁性纳米支架材料作为一种新型药物载体,有望广泛应用于医药领域,可包载蛋白类、醇类和酮类等易反应或易失活的药物和营养物质,达到在特定区域缓慢释放药物的效果[2]。目前,组织工程支架材料正朝着纳米功能化及可控靶向释放药物的方向发展,基本思路是将磁性纳米颗粒与细胞支架材料结合。目前,传统的对抗癌症的治疗方法存在许多缺点,例如,药物的副作用会增加,在静脉注射时治疗效果会降低[2]。因此,以靶向和持续药物释放为特征的药物传递系统越来越受到重视[3-6]。磁性载药微球在抗癌药物传递技术中起着重要作用。这些磁微球由磁铁矿粒子(Fe3O4)组成,具有磁响应能力。通过外磁场的应用,磁性聚合物微球可以在一定时间内达到目标位置并保持很高的浓度,同时不会对附近的正常组织产生毒性作用[7]。
磁响应自愈合水凝胶是一种同时利用磁性粒子特性和自愈合水凝胶特性的复合材料。纳米级的磁性颗粒具有与其常规尺寸特性不同的物理和化学性质,这些特性使它们在核磁共振、热疗、药物传递、细胞分离和分析等方面有广泛的应用。在其中的一些应用中,已经开发了一些方法来提高它们的生物相容性,而自愈合水凝胶具有自主修复裂纹的能力,因而可以保持水凝胶的网络结构和力学性能,使其能长期稳定使用[6]。
本文中,笔者旨在制备一种包埋载药微球的复合水凝胶,提升自愈合水凝胶的性能,并提高抗肿瘤药物的传递效率。水凝胶由水溶性羧乙基壳聚糖(CEC)和氧化海藻酸盐(OAlg)通过席夫碱(Schiff-base)反应制成。为了显示出加入载药磁性微球的自愈合水凝胶支架优异的力学性能和持续的药物释放性,笔者开发了一种新型磁性明胶微球(MGMs),用于封装并运输5-氟尿嘧啶(5-Fu)。明胶是一种具有良好溶解性、生物相容性和生物可降解性的蛋白质衍生胶原,广泛应用于微球的制备[7]。5-氟尿嘧啶(5-Fu)是一种常见的化疗药物,它通过抑制癌细胞DNA的合成达到抗癌的效果。但是,当5-Fu在血液中达到一定浓度时会产生严重的毒性作用,因此,研究其他具有靶向性和控制释放特性的方法已成为一项研究热点。在本实验中,笔者将载有5-Fu的MGMs(5-Fu/MGMs)封装到CEC/OAlg水凝胶中,制备出一种新型复合自修复水凝胶,并研究该水凝胶一系列的性能,包括不同配比的磁性微球对水凝胶的微结构、溶胀率、降解性能、流变性能、自愈合能力和体外释药性能的影响,希望该复合水凝胶能为给药系统及组织工程材料提供新的选择。
1 材料与方法
1.1 仪器与试剂
壳聚糖(化学纯)、海藻酸钠(化学纯),上海国药集团化学试剂有限公司;明胶(分析纯),天津科密欧化学试剂有限公司;纳米Fe3O4颗粒(20 nm),南京埃普瑞纳米材料有限公司;戊二醛(分析纯)、5-氟尿嘧啶(医药级)、高碘酸钠(分析纯),上海阿拉丁生化科技股份有限公司;丙烯酸(分析纯)、无水乙醇(分析纯),成都市科龙化工试剂厂。
FD-1A-50型真空冷冻干燥机,北京博医康实验仪器有限公司;Allegra X-30型高速冷冻离心机,美国贝克曼库尔特公司;Biomate 3S型紫外分光光度计,美国赛默飞世尔科技公司;Nicolet iS 10型傅里叶红外光谱仪,美国赛默飞世尔科技公司;Bruker-AXS D8 Advance型X线衍射仪,美国Bruker公司);THZ-100型恒温培养摇床,上海一恒科学仪器有限公司;Hitachi SU8010型扫描电子显微镜(SEM),日本Hitachi公司;Lake Shore 7400型磁强计,美国LakeShore公司。
1.2 实验与制备
1.2.1 实验原理与制备
复合自修复水凝胶通过CEC上的氨基与OAlg上的醛基之间的席夫碱反应发生交联。为了得到靶向运输和缓释能力,将载有5-Fu的MGMs包埋到CEC/OAlg水凝胶中,如图1所示。为了提高药物靶向传递能力,磁性微球的制备采用乳化交联法,即基于席夫碱反应,通过明胶上的氨基与戊二醛上醛基的交联过程制备MGMs。

图1 封装5-Fu/MGMs的复合CEC-OAlg 水凝胶制备过程Fig.1 Preparation of the composite CEC-OAlg hydrogel (gel) integrated with magnetic gelatin microspheres (MGMs) loaded 5-fluorouracil (5-Fu)
由于席夫碱反应,CEC的氨基与OAlg的醛基之间的自修复行为是动态可逆的再交联过程[8]。当水凝胶被切割成两半时,通过席夫碱反应连接的键会断裂,许多单氨基或醛基会出现在水凝胶表面。然后,断裂表面相互接触后,席夫碱反应将重新进行,使得愈合的水凝胶重新成为整体,图2说明了这一过程。该自愈合过程不需要任何外部刺激,即整个过程具有自发性和无毒性。
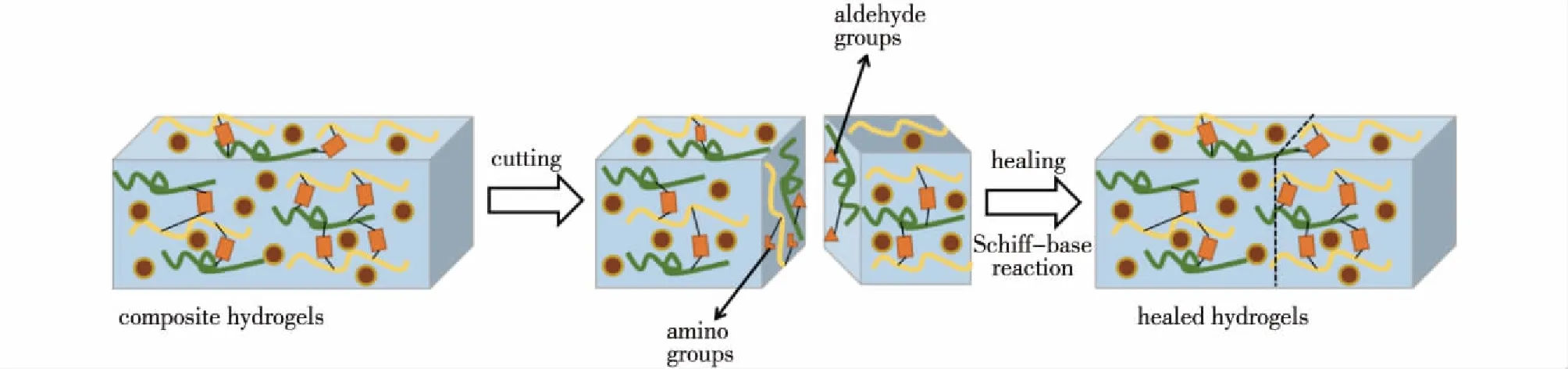
图2 复合水凝胶自愈合过程Fig.2 Schematic illustration of self-healing process of the composite hydrogels
1.2.2 羧乙基壳聚糖(CEC)的制备
根据Michael加成反应[9],将4 g壳聚糖溶解在200 mL含丙烯酸的去离子水中,在50 ℃下持续搅拌3 d 。反应完全后,逐渐加入1 mol/L NaOH,将混合溶液的pH调节至10~12。之后,将混合溶液装入透析袋(MWCO14000),在去离子水中进行纯化处理,为期3 d。将纯化后的溶液在-50 ℃下冷冻干燥,最后得到脱水干燥的CEC。
1.2.3 氧化海藻酸钠(OAlg)的制备
首先,将3 g海藻酸钠溶于150 mL去离子水中,通过磁搅拌得到20 g/L的溶液;然后,将3 g高碘酸钠加入溶液中,继续在室温黑暗条件下搅拌溶液24 h;最后将2 mL乙二醇加入到溶液中来终止反应。搅拌1 h后,将混合溶液在去离子水中进行透析(MWCO14000),为期3 d。将纯化后的溶液在-50 ℃下冷冻干燥,最终得到脱水干燥的OAlg。
1.2.4 磁性载药微球的制备
采用乳化交联法制备了载有5-Fu的磁性明胶微球(5-Fu/MGMs)。首先,将1 g明胶和0.1 g 5-Fu溶解于10 mL去离子水中;然后,将0.2 g Fe3O4加入溶液中,在超声波下振动30 min,使其充分扩散在溶液中。将混合物逐滴地加入含有1 mL Span-80的100 mL液体石蜡中,并且在60 ℃、7 000 r/min条件下进行搅拌,乳化15 min后,用冰浴将混合物冷却至5 ℃,5 min后,将1 mL戊二醛加入混合物中,并在8 000 r/min下搅拌,60 min后,加入30 mL丙酮并搅拌40 min进行脱水;再次,将产物在3 000 r/min下离心5 min,分别用异丙醇、乙醇和蒸馏水清洗2次来去除油相;最后,将产物冷冻干燥,得到纯净干燥的磁性明胶微球。利用激光粒度仪在室温条件下测定微球的平均水动力学直径。本文中,5-Fu/MGMs的载药量为(41.93±0.85) μg/mg,包封率为(54.51±1.11)%。
1.2.5 复合水凝胶的制备
首先,将CEC和OAlg分别在磷酸盐缓冲液(PBS)中溶解,质量分数分别是4%和10%,通过早期实验确定的CEC与OAlg的体积比为4∶ 1;然后,将5-Fu/MGMs磁性微球加入CEC溶液中并充分分散,使其能被封装到水凝胶中;最后,将5-Fu/MGMs/CEC混合物与OAlg溶液混合,通过席夫碱反应得到交联的复合水凝胶。
1.3 测试与表征
1.3.1 微球及水凝胶形貌观察
采用扫描电子显微镜(SEM)对MGMs、水凝胶和MGMs/水凝胶的形貌进行表征。对MGMs、水凝胶及MGMs/水凝胶冷冻干燥,水凝胶进行切片,将样品进行喷金处理,用SEM对它们的微观形貌进行观察,加速电压3 kV。
1.3.2 红外光谱分析
使用傅里叶红外光谱仪对CEC、OAlg和复合水凝胶进行红外光谱测试,检验其是否成功发生席夫碱反应进行交联。测试前先采集背景,然后将冻干水凝胶样品放入样品台上进行测量。收集数据后与反应原料的红外光谱图进行对比,观察吸收峰的变化。
1.3.3 磁性能表征
在300 K下测量5-Fu/MGMs和含有30 mg/mL 5-Fu/MGMs的复合水凝胶的磁滞曲线,磁场矫顽力范围为-60~60 kOe。
1.3.4 流变性能表征
将复合水凝胶(高度1 mm)置于底板的中心。在37 ℃、频率范围0.1~100 rad/s、恒定振幅y=1%下,记录不同的角频率下储能模量(G′)和损耗模量(G″)。然后,再次测试愈合2 h后的水凝胶,并将储能模量与原始水凝胶进行比较。
1.3.5 溶胀性能表征
将复合水凝胶浸泡在PBS中,置于37 ℃、70 r/min的恒温培养摇床里。然后,在不同的时间间隔内,将水凝胶取出,用滤纸吸去表面水分后称质量(ms)。实验结束后将水凝胶在-50 ℃下冻干,称质量得到干态凝胶质量(md)。溶胀率(SR)的计算见式(1)。
溶胀率SR=(ms-md)/md
(1)
1.3.6 体外降解表征
通过监测水凝胶的质量损失情况,可以清楚地描述其降解行为。将初始水凝胶(质量记为m0)浸泡在PBS中,并置于恒温振动台(37 ℃、70 r/min)中。在不同的时间下,从PBS中取出样品并称质量(mT)。降解率及质量剩余率的计算见式(2)和(3)。
降解率=(m0-mT)/m0×100%
(2)
质量剩余率=mT/m0×100%
(3)
1.3.7 自愈合性能实验
为了测试复合水凝胶的自愈合能力,制备空白水凝胶和30 mg/mL MGMs/水凝胶样品。将两块相同的水凝胶放置在一起,2 h后,观察水凝胶是否重新变为整体。多次重复试验并记录自愈合情况,为了更好地观察,将其中一块水凝胶用罗丹明B染色,然后拉伸愈合的水凝胶,以观察其是否有良好的自愈合表现。
1.3.8 5-Fu体外释药实验
在药物释放实验中,分别对5-Fu/MGMs、5-Fu/水凝胶和5-Fu/MGMs/水凝胶进行分析。将10 mg磁性载药微球加入8 mL PBS的试管中单独测定5-Fu/MGMs组。将装载相同量药物的水凝胶置于10 mL PBS溶液中测试另外两组。所有3组样本均置于振动台(37 ℃、70 r/min)中。在不同的时间点,从试管中吸取2 mL溶液,同时加入2 mL PBS溶液以维持恒定体积。用分光光度计在266 nm处测定PBS中5-Fu的吸光度。根据5-Fu标准曲线回归方程确定5-Fu的释药量,绘制出各组的累积释药-时间曲线。累积释药率计算见式(4)。
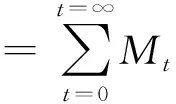
(4)
式中:Mt为系统在缓冲液中时间为t时的5-Fu的释放量;M0为系统初始5-Fu的含量。
2 结果与讨论
2.1 X线衍射(XRD)和傅里叶红外光谱(FT-IR)分析
通过XRD分析来确保磁性纳米颗粒(Fe3O4)被成功封装到MGMs中,结果如图3所示。由3图可知:明胶的衍射峰几乎消失了,而Fe3O4的衍射峰仍然存在。这表明,明胶作为一种基材已经通过席夫碱反应与戊二醛交联,没有产生其他的共沉淀物,且Fe3O4已经成功地嵌入到微球中。

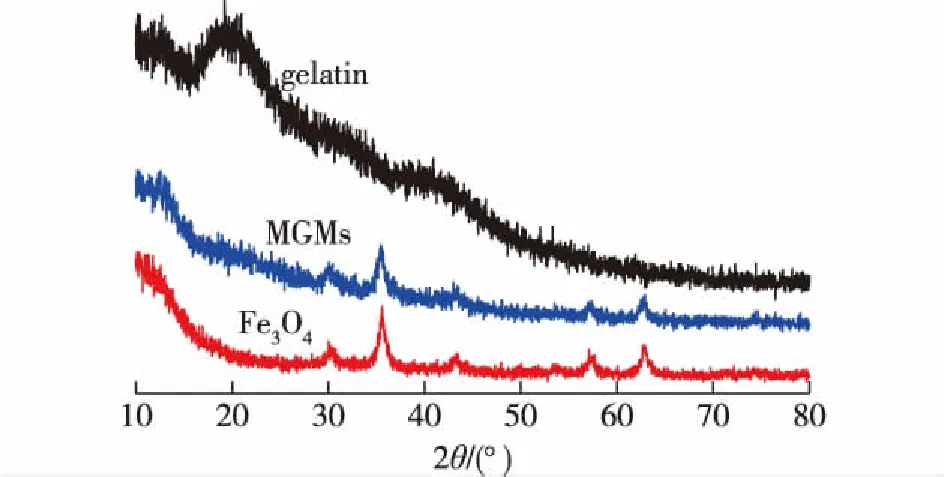
图3 明胶、Fe3O4和MGMs的XRD图谱Fig.3 XRD patterns of gelatin,Fe3O4 and MGMs
图4 CEC、OAlg和CEC/OAlg水凝胶的FT-IR图谱Fig.4 FTIR spectra of CEC, OAlg, and CEC/OAlg gel
2.2 SEM形貌观察结果
用SEM对冻干5-Fu/MGMs的形态进行观察,结果如图5所示。由图5可以清楚地看到微球呈现球状,形态完整且分散性良好,表面没有裂纹或皱纹。由于5-Fu负载到MGMs中,微球呈现出一点不规则且粗糙的表面,意味着可能有很少的药物被吸附在表面上而不是被封装在微球中,这将导致药物释放初期的突发释放。对5-Fu/MGMs的形态进行TEM分析,结果见图5(c)。由图5(c)可以发现,磁性Fe3O4纳米粒子被封装进明胶微球GMs,在球体中间的黑色阴影部分,这进一步证明了Fe3O4纳米颗粒成功被封装进(GMs)。

图5 5-Fu/MGMs的SEM表面形貌(a,b)和 5-Fu/MGMs的TEM图像(c)Fig.5 SEM images of surface morphologies of 5-Fu/MGMs (a), (b), and TEM photograph of the 5-Fu/MGMs(c)
2.3 磁力性能检测结果
在封装5-Fu/MGMs后,复合水凝胶将产生磁性行为,其可被外部磁场刺激产生响应,可应用在生物医学领域[10]。超顺磁性指存在外部磁场时材料具有良好磁性、当外加磁场消失后材料磁性消失的性质。对封装5-Fu/MGMs后的复合水凝胶进行检测,分析其磁性行为,结果如图6所示。由图6可知:磁滞曲线呈现对称的S形,5-Fu/MGMs和30 mg/mL 5-Fu/MGMs/水凝胶的饱和磁化强度分别为4.95和2.1 A/m,均表现出优异的超顺磁性行为。这表明,复合水凝胶在封装5-Fu/MGMs后,由于水凝胶部分为非磁性物质而导致磁化强度出现下降,但仍然拥有良好的超顺磁性,没有磁滞现象。
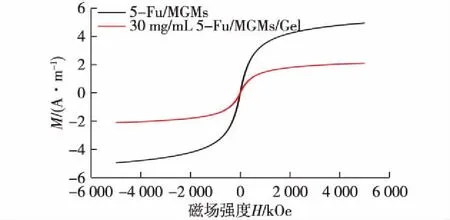
图6 5-Fu/MGMs和30 mg/mL 的5-Fu/MGMs 复合水凝胶的磁滞曲线Fig.6 Magnetic hysteresis curves of 5-Fu/MGMs and composite hydrogel contained 30 mg/mL 5-Fu/MGMs
2.4 溶胀性能和体外降解速率的检测结果
在组织工程应用中,溶胀性是表征水凝胶物质交换的基本特征[11],对于水凝胶植入体内后的力学性能、细胞生长和药物释放速率等都会造成影响。溶胀度过大会降低水凝胶的强度,同时可能会对周围组织造成压迫,溶胀度过小又会降低物质交换能力,也不利于细胞生长。
图7显示了不同MGMs浓度的水凝胶在37 ℃PBS溶液中经历12 h的溶胀动力学。由图7可知:当处于PBS溶液后,水凝胶的溶胀比在一定程度上增加了,这是CEC和OAlg上一些亲水基团导致的。一般来说,高浓度的MGMs会导致较低的溶胀率。由此推测,固体MGMs可能占据水凝胶空间结构的一部分,这将限制水凝胶在水相条件下的吸水能力。同时可以看出,与0~10和40 mg/mL的MGMs/水凝胶相比,20~30 mg/mL的MGMs/水凝胶的溶胀过程更稳定,溶胀度也较为适中。
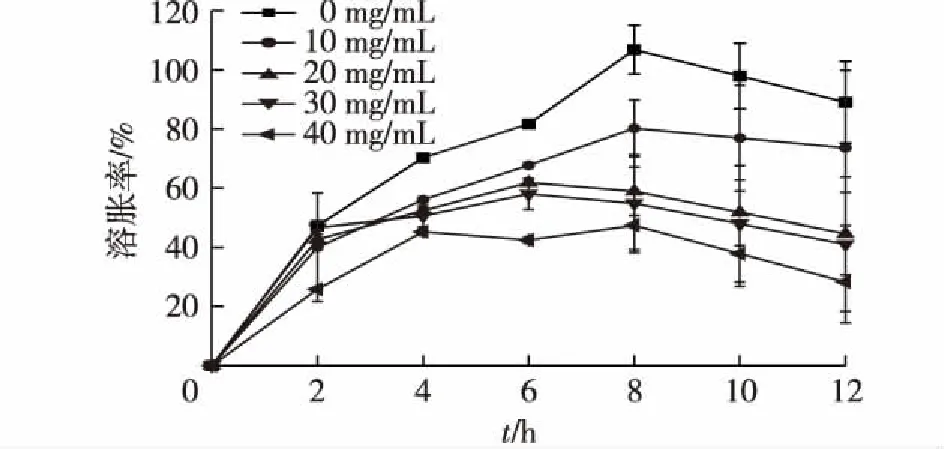
图7 浓度对MGMs/水凝胶溶胀率 的影响(37 ℃ PBS)Fig.7 Effects of MGMs concentration on swelling rate of gel in PBS at 37 ℃
在PBS溶液中,37 ℃环境下,监测水凝胶的降解率随时间的变化,时间为2周,结果如图8所示。由图8可知:不同含量的MGMs/水凝胶在降解过程中出现显著的变化,含有较多MGMs的复合水凝胶更稳定,更不易降解。在第1天,由于溶胀过程,各组水凝胶的质量都增加了。之后溶胀慢慢达到平衡,这时候随培养时间的延长,水凝胶开始显现出降解行为,这是由于水凝胶体系中的交联键开始断裂,导致三维结构开始崩塌分解,从而使得水凝胶质量逐渐减少。与0~20 mg/mL的 MGMs/水凝胶相比,30~40 mg/mL的MGMs/水凝胶的质量减少速度更慢更稳定;在PBS中放置14 d后,30~40 mg/mL的 MGMs/水凝胶的质量分数分别为81.3%和89.4%。这些结果表明,制备的水凝胶具有较好的稳定性、较低的溶胀率和降解速率。
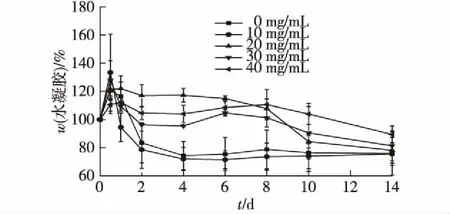
图8 浓度对MGMs水凝胶降解率的影响 (37 ℃ PBS)Fig.8 Effects of MGMs concentration on degradation rate of gel in PBS at 37 ℃
图9为冻干水凝胶和30 mg/mL 5-Fu/MGMs/水凝胶在降解前后的形貌。由图9(a)~9(d)可知:水凝胶和5-Fu/MGMs/水凝胶的形貌均呈现出连通多孔状结构,这些孔隙可能是冻干过程后冰晶形成的产物[12]。与水凝胶(图9(a)和9(b))相比,30 mg/mL的 5-Fu/MGMs/水凝胶(图9(c)和9(d))的复合凝胶的内部结构表面略粗糙,这说明MGMs在水凝胶中均匀分布,未出现团聚现象。在PBS溶液中降解后的第7天和第14天,水凝胶(图9(e)和9(f))和5-Fu/MGMs/水凝胶(图9(g)和9(h))维持了多孔状结构。与复合水凝胶相比,随着降解的进行,水凝胶(图9(e)和9(f))的一些碎片和裂纹已经消失,降解更加迅速。相比较而言,复合水凝胶具有更稳定的结构,与体外降解实验的结果一致。

a和b为冻干的水凝胶;c和d为含30 mg/mL的5-Fu/MGMs/水凝胶;e和f为在PBS 溶液中降解后第7天和第14天的水凝胶;g和h为在PBS 溶液中降解后第7天和第14天的含30 mg/mL的5-Fu/MGMs/水凝胶图9 不同条件的水凝胶SEM照片Fig.9 SEM images of different hydrogels
2.5 流变性能
在37 ℃条件下,通过测量材料的存储模量(G′)和损耗模量(G″)与角频率的函数关系,来表示复合水凝胶的流变特性,从而研究水凝胶三维网状结构在循环剪切力下的稳定性,结果如图10所示。

图10 不同浓度的MGMs/水凝胶的G′和G″ 与角频率的函数关系Fig.10 Frequency dependence of storage modulus (G′) and loss modulus (G″) of gels with different concentrations of MGMs at 37 ℃
由图10可知:随着频率的变化,复合水凝胶的G′几乎保持不变,并且比G″大得多,这表明水凝胶的弹性行为起主导作用,而非黏性行为,这表明复合水凝胶具有稳定的结构[13-15]。另外,随着MGMs浓度的增加,G′和G″均明显增加,且G′和G″随角频率变化表现出良好的稳定性,说明复合水凝胶具有一定维持自身形态的能力。与40 mg/mL的 MGMs/水凝胶相比,30 mg/mL的MGMs/水凝胶有更高一点的G′,这一般与其压缩性能相关。另外,G′ 数值远大于G",表明了这种复合水凝胶有更好的弹性,更加显示出一种固体的属性,笔者认为,该复合水凝胶在高性能和超弹性的药物运输应用中能表现出良好的外表形状。
为了评价水凝胶的自愈能力,将不同浓度MGMs的复合水凝胶切割成两半,然后将其各自放在一起进行自愈合2 h,图11显示了原始水凝胶与愈合后的水凝胶的存储模量。由图11可知:与0~10 mg/mL的MGMs/水凝胶相比,20~40 mg/mL的MGMs/水凝胶的一致性更好,其G′几乎没有差异。通过比较愈合前后的存储模量,20~40 mg/mL的 MGMs/水凝胶的自愈合效率分别为96.27%、96.7%和95.94%,表明其在生物医学操作中造成损伤后具有良好的自愈性。综上各项因素,30 mg/mL的MGMs/水凝胶具有最优的性能,可用作进一步研究。

图11 不同浓度的原始水凝胶与愈合2 h后的 水凝胶的存储模量比较Fig.11 Comparison of storage modulus between the original and the healed after cutting for 2 h composite hydrogels
2.6 自愈合性能
为了检验基于动态席夫碱反应的水凝胶的自愈合能力,首先对无MGMs的空白水凝胶进行了实验,准备两个相同的水凝胶,用罗丹明B来染色其中的一个,然后把它们放在一起,在室温下愈合,结果如图12所示。由图12可知:自愈合2 h后,水凝胶愈合成为一个整体。此外,愈合后的水凝胶能够克服外部的拉伸力,同时保持自身完整无损,表现出良好的自愈性。

图12 无MGMs的空白水凝胶自愈过程 Fig.12 The self-healing process of the blank hydrogel with no MGMs
同样,准备了两个相同形状与大小的水凝胶,一个是空白水凝胶,另一个是30 mg/mL的MGMs/水凝胶,重复上述方法,结果如图13所示。由图13可知:已愈合的水凝胶可以支撑自身的质量和外界的拉伸。基于席夫碱反应的动态可逆共价键,特别是在水凝胶表面上,使裂开的水凝胶能够轻易重新连接。这些结果表明制备的水凝胶显示了良好的自愈能力。
当应用到临床实践中时,期望复合水凝胶能被注射到靶组织处[16]。因此,测试了30 mg/mL的MGMs/水凝胶的注射性能、自愈合性和磁性,结果如图14所示。由图14可知:注射后,水凝胶片段在室温下30 min后,不需任何外部刺激,通过动态席夫碱连接变为一个整体并可被磁体吸引。基于这些优异的性能,当用作药物载体时,复合水凝胶能够在外部磁场引导下快速准确地到达靶向处。
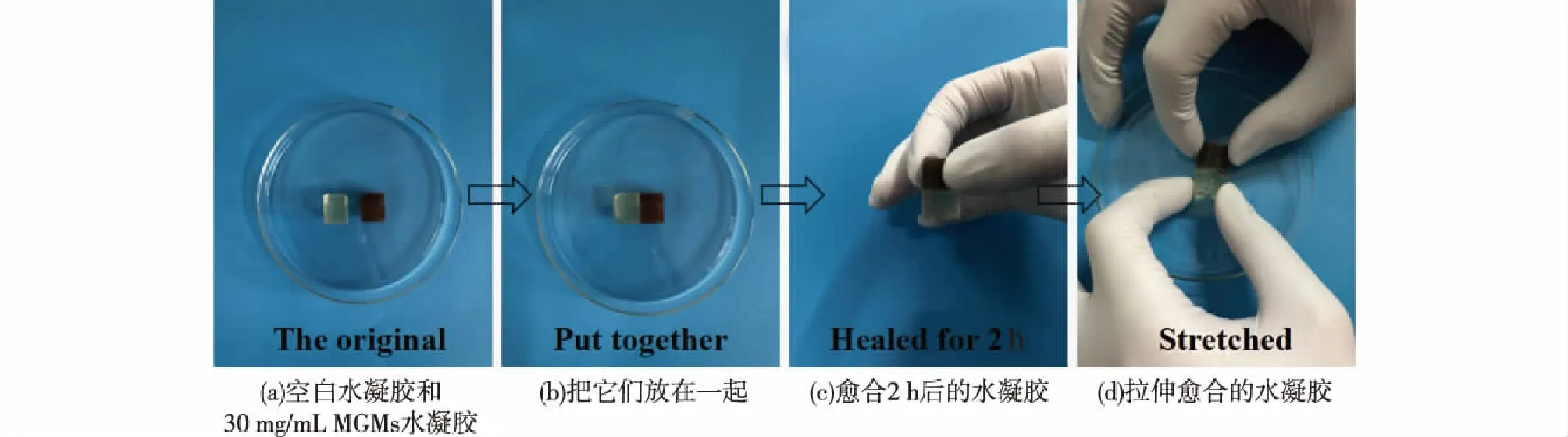
图13 复合水凝胶的自愈过程Fig.13 The self-healing process of the composite hydrogels

图14 30 mg/mL的MGMs水凝胶的性能Fig.14 Some performance of the 30 mg/mL MGMs/Gel
2.7 释药性能
图15为在体外模拟生理环境(PBS,37 ℃)下,5-Fu/MGMs、5-Fu/水凝胶和30 mg/mL的5-Fu/MGMS/水凝胶的5-Fu累积释放率试验结果。由图15可知:5-Fu在MGMs中的累积释放率在前两周内保持连续稳定,达到60.05%,随后的2周,药物释放变得更加缓慢稳定,最终释放率达到76.60%。而在最初的4 d内,5-Fu/水凝胶的初始释放表现出明显的突发释放,累积释放率为50.08%,这几乎是同一时间5-Fu/MGMS释放量的3倍,2周后当释放率达到60.69%时,系统的药物浓度几乎达到平衡,不再有明显变化。与这两组相比,5-Fu/MGMS/水凝胶的释放曲线更加稳定,不会出现初期突释现象,也不会导致过高的药物浓度,表现出了更好的药物缓释性和稳定性。36 d后,MGMs/水凝胶的累积释放量逐渐增加至56.13%,略低于水凝胶。由此可见,含有微球和三维网络结构的复合水凝胶作为药物载体可以使5-Fu可控且持续地释放。这种良好的性质可以保证5-Fu在到达肿瘤细胞之前不会大量释放,从而有效避免对其他健康组织的毒副作用。

图15 MGMs、水凝胶和30 mg/mL MGMs/水凝胶的 5-Fu的累积释放曲线Fig.15 Cumulative release profiles of 5-Fu from MGMs, Gel and MGMs/Gel
3 结论
笔者基于动态席夫碱交联技术成功制备了包埋5-Fu/MGMs的可注射和自愈合的CEC/OAlg水凝胶。主要结论如下:
1)5-Fu/MGMs复合水凝胶与单独的水凝胶相比,具有较短的凝胶时间、较低的溶胀率和较慢的体外降解过程。同时,加入磁性微球是调节复合水凝胶支架一些性能的重要因素。
2)磁滞曲线表明,该复合水凝胶具有良好的超顺磁性,能对外加磁场产生磁响应。
3)流变试验表明,复合水凝胶具有较高的稳定性,因此在承受外界压力的情况下,可以保持自身结构的稳定。将复合水凝胶切成两半,然后愈合2 h,从流变试验中得到的恢复率来看,复合水凝胶具有良好的自愈性和稳定的结构。综合各因素,当MGMs的质量浓度为30 mg/mL时,复合水凝胶达到最好的性能。
4)在自愈合行为试验中,证明了基于动态的席夫碱重交联过程,水凝胶具有优秀的自愈合性能。同时在愈合形成整体后,水凝胶系统可以克服一些拉伸并保持坚固的结构。
5)MGMs、水凝胶和MGMs/水凝胶进行的5-Fu体外释药实验表明,具有微球/水凝胶结构的复合水凝胶更有利于药物的稳定持续释放。
综上所述,5-Fu/MGMs/水凝胶具有良好的生物相容性和生物降解性、优秀的力学性能、良好的磁响应性能和稳定的药物缓释性等,在抗肿瘤治疗、药物传递及组织工程等方面的应用前景十分广阔。
