脂质体共递药系统用于肿瘤联合治疗的新进展
2018-10-11王梦玥蒋曙光
王梦玥,李 腾,蒋曙光,莫 然
(中国药科大学高端药物制剂与材料研究中心,江苏南京210009)
恶性肿瘤是对人类健康造成严重威胁的头号杀手[1]。目前,临床上治疗恶性肿瘤的主要方法包括手术治疗、化疗和放疗。但是,手术治疗无法针对已发生转移的肿瘤患者,只能对早期肿瘤患者进行手术,而化疗和放疗有很强的毒副作用,会对患者的免疫系统和造血系统造成损伤[2-4]。临床上多采用联合用药的方式治疗恶性肿瘤,基于两种或多种药物联用的肿瘤联合治疗已经成为临床肿瘤治疗的常用方案,不同药物联合用药,取长补短,发挥协同作用,增强抗肿瘤活性,降低毒副作用[5]。但是,不同药物由于物理化学性质的不同,在体内具有不同的药物动力学特性,导致在肿瘤组织的药物分布比例不同,从而使药物联用达不到预期疗效。近年来,随着纳米技术的飞速发展,脂质体作为药物递送系统能够改善药物的体内分布,提高药物在肿瘤部位的富集量,降低毒副作用[6-7]。已有多个抗肿瘤药物的脂质体制剂上市并用于肿瘤的临床治疗。基于脂质体的共递药系统能够输送多种药物至肿瘤部位,增强药物的协同作用,具有很大的开发潜力和市场前景[6,8-9]。
因此,本文中,笔者主要介绍脂质体的发展以及脂质体共载体系用于肿瘤联合治疗的研究进展,以期为相关研究者提供参考。
1 脂质体概述
1.1 脂质体的发展历程
1961年,脂质体概念的首位提出者Bangham[10]发现磷脂分子可在水中分散,自发形成闭合的双分子囊泡,这种具有球形囊泡结构的脂质颗粒被称为脂质体,这一发现为脂质体的发展奠定了基础[11-12]。1972年,Gregoriadis等[13]制备了包载淀粉葡萄糖苷酶和碘-131标记的白蛋白的脂质体,首次将脂质体应用于生物大分子的输送。1995年,盐酸阿霉素脂质体(Doxil®)作为第一个抗肿瘤药物的脂质体制剂被美国食品药品监督管理局(FDA)批准上市,用于乳腺癌、卵巢癌以及艾滋病相关的卡波氏肉瘤、多发性骨髓瘤等癌症的化疗。这是纳米医药领域发展的一个里程碑。目前为止,已有多个脂质体制剂上市并在临床上得到了应用,如柔红霉素脂质体(DaunoXome®)、紫杉醇脂质体(Lipusu®)和长春新碱脂质体(Marqibo®)[14-16]。
1.2 脂质体的组成
脂质体的主要组成成分是磷脂和胆固醇。常用的磷脂材料有磷脂酰胆碱、磷脂酰甘油、磷脂酰肌醇和磷脂酸等。细胞膜脂质双分子层主要由磷脂组成,因此磷脂具有低毒性和良好的生物相容性。胆固醇是一种中性脂质,约占所有动物细胞膜成分的30%,是生物膜的重要成分之一。胆固醇可通过与磷脂的脂肪酸链相互作用维持膜稳定性,在生理温度下增加膜包装以调节膜流动性[17-19]。磷脂和胆固醇是制备脂质体的基本材料,其他功能化脂质体可在基本材料的基础上根据研究目的或治疗作用作多重修饰。
阳离子脂质体是近年来研究较广的用于基因递送的纳米载体[20-21]。阳离子脂质体一般由阳离子脂质和中性辅助脂质组成,阳离子脂质包括2,3-二油酰氧丙基-1-溴化三甲胺(DOTMA)、(2,3-二油酰基-丙基)-三甲胺(DOTAP)和溴化二甲基双十八烷基铵(DDAB)等。1987年,Felgner等[22]首次采用阳离子脂质体装载基因药物。之后,研究人员又合成了大量阳离子脂质,可作为细胞转染素(cytofectins)或转染试剂(lipofection reagents),制备基因递送载体用于基因治疗。阳离子脂质体具有更好的穿膜能力,可有效提高基因转染效率。与病毒类载体相比,阳离子脂质体的合成工艺快速简单,并且毒性较低。目前,有许多阳离子脂质体处于Ⅰ、Ⅱ期临床试验阶段[23]。其中,可将囊性纤维化基因(pGT21)转运至靶细胞的阳离子脂质体正处于Ⅰ期临床研究阶段[24]。
阳离子脂质体主要用于包载DNA和RNA等基因,并可用来与化疗药物共同递送,如阿霉素(DOX)、紫杉醇(PTX)、5-氟尿嘧啶(5-FU)、顺铂(CDDP)及长春新碱等。基因与抗肿瘤药物脂质体共递送系统在肿瘤联合治疗中也表现出巨大的应用潜力。
1.3 脂质体的应用优势
脂质体药物与游离药物相比,可提高药物的稳定性,延长体内半衰期,提高药物对肿瘤组织的靶向性和渗透性。与其他纳米递送系统相比,脂质体不仅可以荷载亲水性和疏水性药物,即将亲水性分子装载在脂质体的内腔,而将疏水性分子包埋于脂质双分子层中,还具有材料来源广泛、生物相容性好、生物可降解、免疫原性低和毒性低等优势[25]。因此,脂质体在药物递送领域具有良好的应用前景。
将化疗药物、生物药物等共载于脂质体中组成脂质体共递送系统也具有许多优势。首先,在脂质体表面可进行多种修饰(如,靶头、细胞穿膜肽、肿瘤微环境响应性多肽),利用实体瘤的“增强渗透与滞留”效应,使共载药脂质体携带的药物富集于肿瘤组织;其次,脂质体中药物的释放速度具有可控性,可使药物间的比例长时间维持在脂质体共递送系统中的比例,从而更好地发挥协同作用。
1.4 脂质体共递送系统的临床应用
目前,脂质体共递送系统在临床方面的应用也很有发展前景,研究较多的公司是Celator公司。该公司正在进行临床研究的共载脂质体主要有2种,分别为CPX-1和CPX-351。表1总结了近几年这2种共载两药脂质体制剂的临床试验情况。CPX-1[26]是共载伊立替康和氟尿苷(摩尔比为1∶ 1)的脂质体注射液,用于治疗晚期结直肠癌,目前已完成Ⅱ期临床试验。Ⅰ期临床试验结果表明,患者对CPX-1的耐受性良好,且摩尔比为1∶ 1的药物比例可在体内维持8~12 h。CPX-351[27-29]是共载阿糖胞苷和柔红霉素(摩尔比为5∶ 1)的脂质体注射液,用于治疗急性髓细胞白血病(AML)、急性淋巴细胞白血病(ALL)和骨髓增生异常综合征(MDS)。Ⅰ期临床试验中药物代谢动力学结果表明,当CPX-351给药量为24 units/m2时,CPX-351中阿糖胞苷(半衰期(t1/2)为43 h,药时曲线下面积(AUC∞)为600 μg·h/mL)和柔红霉素(t1/2为19 h,AUC∞为600 μg·h/mL)的t1/2较阿糖胞苷游离药物的(t1/2为10 min)得到显著延长,并且可在体内稳定维持两药比例5∶ 1(摩尔比)超过24 h。
此外,很多脂质体共递药系统正进行临床前研究。如,共载长春新碱与拓扑替康的脂质体的药物代谢动力学实验结果表明,与同比例的长春新碱游离药物(t1/2为1 h)、拓扑替康游离药物(t1/2为2 h)、长春新碱单药脂质体(t1/2为7 h)相比,共载长春新碱和拓扑替康的脂质体(t1/2超过24 h)的体内半衰期可得到显著延长[30]。体内药效实验结果证明了共递药脂质体显著延长了荷瘤小鼠的生存期。
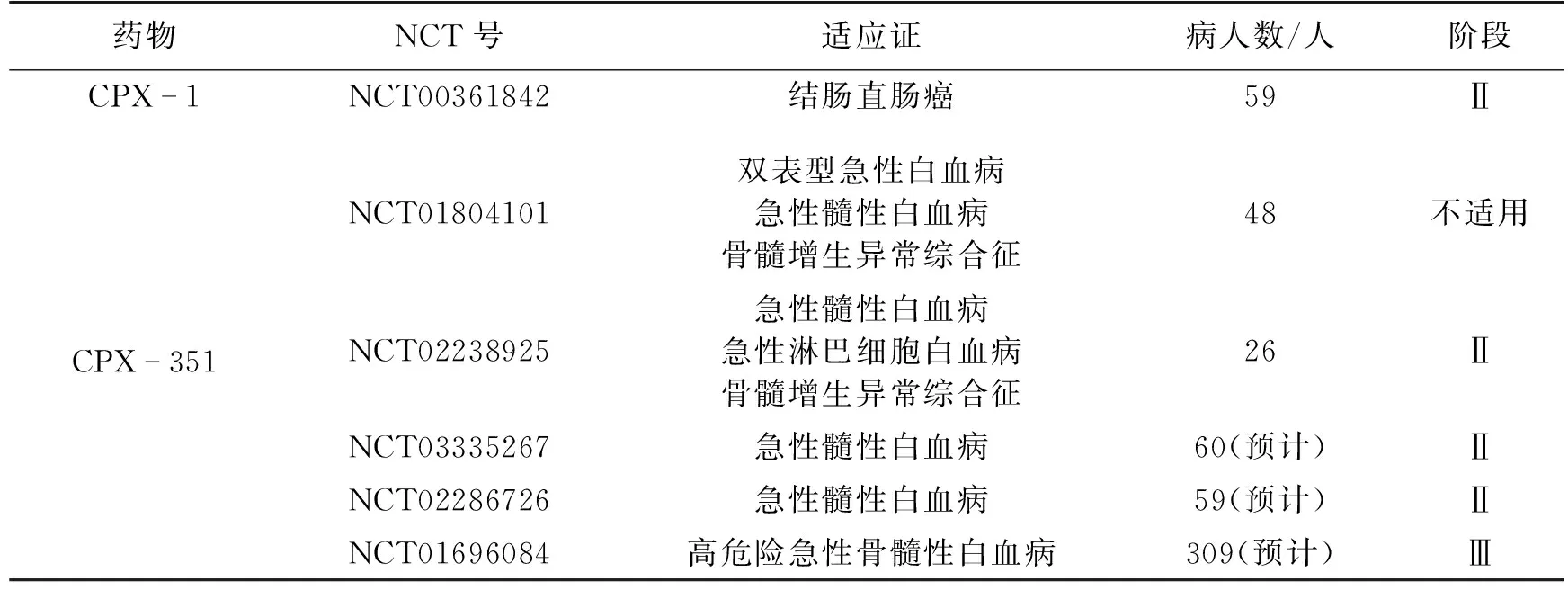
表1 共载药脂质体制剂的临床研究
2 脂质体共递药系统用于增强药物协同作用
多种抗肿瘤化疗药物联合使用可提高药物抗癌效力。脂质体可用于荷载作用于相同靶点的化疗药物,优化药物比例,从而增强疗效。DOX是一种蒽环类抗生素,平面芳香环部分可以插入DNA碱基对之间,抑制DNA复制和转录,并可以稳定DNA-拓扑异构酶Ⅱ(TOP Ⅱ)复合物,从而抑制TOP Ⅱ,最终导致细胞死亡[31]。CDDP是一种典型的烷化剂,通过干扰DNA的复制而发挥药效。CDDP作为一种很强的亲电试剂,由于其有两个易被水分子取代的氯原子(Cl),可与DNA上的N-杂环碱基反应,阻止DNA合成或转录,造成DNA损伤,阻止细胞分裂,诱导细胞凋亡[32]。因此,利用脂质体共同递送DOX和CDDP可增强药物对癌细胞的细胞毒性。Ruttala等[33]报道了转铁蛋白配体修饰的脂质体(TL-DDAC),能够将DOX和CDDP释放到细胞质中,结果证明,因DOX和CDDP对DNA的双重作用,共载DOX与CDDP的脂质体在所有制剂中表现出最佳治疗效果。人源乳腺癌MCF-7细胞经TL-DDAC处理后,54.10%发生凋亡,而相同浓度的DOX和CDDP则分别导致40.65%和27.04%的细胞凋亡。共载脂质体比游离药物在人源乳腺癌MDA-MB-231细胞显示出更强的癌细胞杀伤能力。
脂质体荷载不同作用机制的化疗药物也可增强抗肿瘤作用。PTX是一种以纺锤体微管为作用靶点的小分子化疗药物,在不同浓度时可发挥不同作用:PTX在高浓度(0.450 μmol/L)时,会促进微管蛋白组装成微管,并抑制微管解聚,阻碍细胞的正常分裂;在低浓度(0.001 μmo/L)时,主要抑制纺锤体的运动和解聚,使分裂的细胞停滞于G2/M期,抑制细胞增殖[34]。Liu等[35]将PTX和DOX 2种不同作用机制的药物包封于交联脂质体中(cMLVs),体内药效实验结果表明,荷瘤小鼠经药摩尔比为1∶ 1 的cMLVs治疗后的生存期比相同比例的游离药物治疗的显著延长。DOX还可与蛋白共同包载于脂质体中用于增强抗癌效果。Jiang等[36]构建一种以脂质体为核心,外层交联了透明质酸聚合物外壳的纳米胶脂质体(Gelipo),用于逐级递送肿瘤坏死因子相关凋亡诱导配体(TRAIL)和DOX(图1)。该纳米胶脂质体能够将TRAIL和DOX分别递送至各自靶部位——细胞膜和细胞核。细胞凋亡检测结果显示,共载药纳米胶脂质体经透明质酸酶处理后的凋亡率高达80.63%;细胞毒性实验结果证明,共载药纳米胶脂质体比单载药纳米胶脂质体具有更强的细胞毒性;荷瘤小鼠经共载药纳米胶脂质体治疗后,肿瘤生长得到了显著抑制,肿瘤组织中大量肿瘤细胞发生凋亡,表明共载药纳米胶脂质体具有较强的体内抗肿瘤活性。Cheng等[37]制备了共载CDDP和姜黄素的脂质体用于肝癌治疗,姜黄素可通过刺激活性氧水平升高和调控多种信号通路以增强肝癌对DDP的敏感性[38]。对人肝癌HepG2细胞的细胞毒性实验证实,当DDP和姜黄素的摩尔比为1∶ 8时,两者的协同效应最为显著;以该比例载入脂质体后,共载脂质体对HepG2细胞的半数抑制浓度(IC50)可降低至0.62 μmol/L,而游离药物联用的IC50为1.18 μmol/L。该共载药脂质体在荷鼠源肝癌H22细胞或HepG2细胞的2种裸鼠模型中显示出较好的疗效,显著抑制了肿瘤的生长,并延长了小鼠的生存时间。
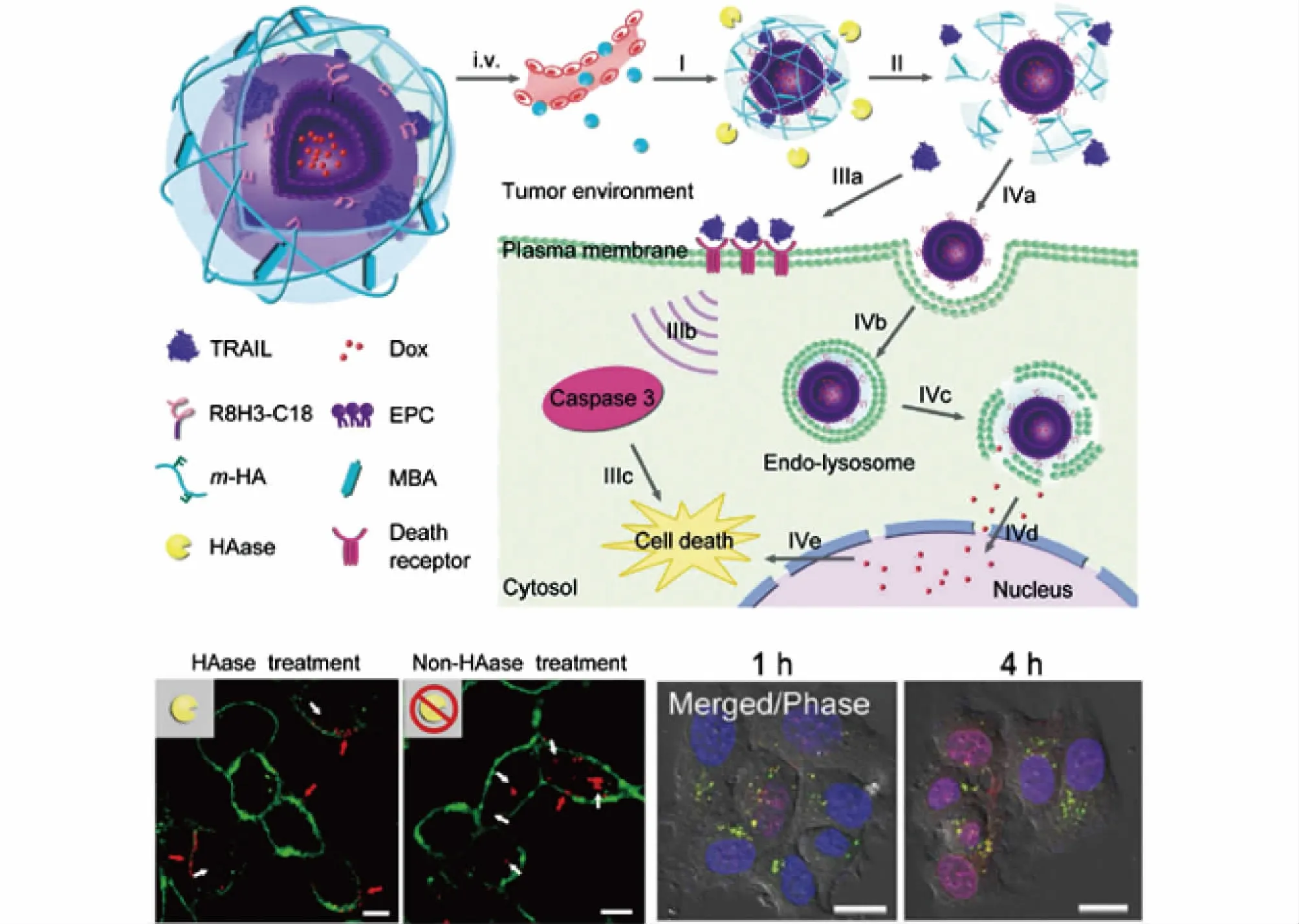
图1 纳米胶脂质体用于逐级递送TRAIL和DOX以增强协同疗效Fig.1 Schematic illustration of sequential co-delivery of TRAIL and DOX by Gelipo for enhanced synergistic effects
3 脂质体共递药系统用于克服多药耐药以增强化疗药物疗效
临床化疗失败的主要原因之一是肿瘤多药耐药(MDR),同时,MDR也是肿瘤治疗中的一大难题。MDR是指肿瘤细胞对一种化疗药物产生抗药性时,对与其作用机制和结构不同的其他化疗药物产生交叉耐药性。MDR的发生与多种因素有关,如白细胞介素6(IL-6)、肺耐药蛋白(LRP)和多药耐药相关蛋白(MRP)的表达增加,多药耐药基因(MDR-1)及ATP结合盒式转运蛋白(ABC transporters)介导的耐药、脂质成分的改变、靶分子(β微管蛋白)的突变等。目前公认的一种主要耐药机制是MDR-1编码的P-糖蛋白(P-gp)过度表达。将MDR的抑制剂和化疗药物包封入脂质体中,在一定程度上可克服肿瘤的多药耐药[39-41],将能够沉默外排蛋白表达的小干扰RNA(siRNA)或外排蛋白的抑制剂和小分子药物合用,可以增加癌细胞对化疗药物的敏感性,降低耐药性,达到协同效应。
Chen等[42]构建了叶酸修饰的pH响应性伊马替尼(IM)和DOX共载脂质体。该脂质体可实现对叶酸受体高表达的肿瘤组织的靶向,并在弱酸性的肿瘤微环境作用下释放药物;IM可结合ATP结合盒家族蛋白的ATP结合部位,导致其外排作用减弱,以此降低耐药性[43]。该制剂在荷载DOX耐药型MCF-7 细胞的裸鼠模型中对肿瘤生长的抑制率可达90%以上。
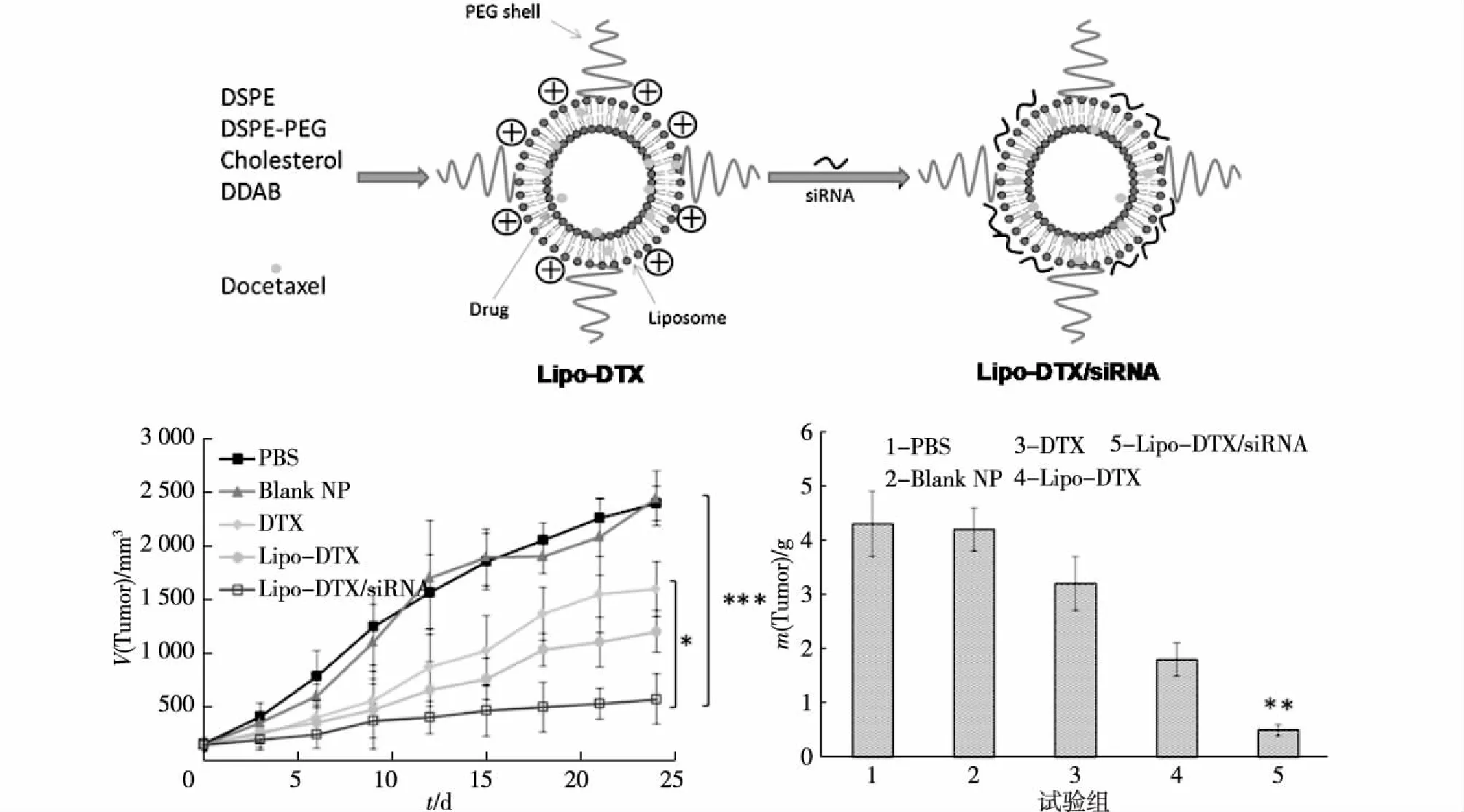
图2 Lipo-DTX/siRNA用于克服肿瘤多药耐药以增强化疗疗效Fig.2 Schematic illustration of Lipo-DTX/siRNA to overcome the MDR for enhanced cancer chemotherapy
P-gp,又称多药耐药蛋白1(MDR1),ATP结合盒亚家族B成员1(ABCB1)或分化簇(CD243),是一种依赖ATP的跨膜转运蛋白,主要将疏水性化合物泵出细胞。Deng等[44]报道了在DOX脂质体表面层层堆积siRNA的纳米共递药系统。在人源乳腺癌MDA-MB-468细胞毒性实验中,与共载乱序siRNA/DOX脂质体相比,共载P-gp siRNA/DOX脂质体处理细胞后,IC50降低了4.5倍。共载P-gp siRNA/DOX脂质体在异位荷MDA-MB-468肿瘤的小鼠模型中展现出更高的抗肿瘤活性,与生理盐水组相比,肿瘤体积减少了8倍。对P-gp免疫组化染色结果显示,P-gp在肿瘤组织中的表达降低,表明下调P-gp的表达显著增强了肿瘤细胞对DOX的敏感性,也进一步表明:采用干扰外排蛋白功能或沉默外排蛋白表达等手段与化疗联用是一种有效克服肿瘤耐药性、从而增强疗效的策略。
抑制肿瘤细胞中抗凋亡蛋白的表达也可克服肿瘤的MDR。例如,采用Bcl-2 siRNA可降低抗凋亡基因Bcl-2及蛋白的表达。Qu等[45]在PEG化阳离子脂质体中共载多烯紫杉醇(DTX)和Bcl-2 siRNA(Lipo-DTX/siRNA)(图2)。Lipo-DTX/siRNA处理人源非小细胞肺癌A549细胞和人源肺鳞癌H226细胞的IC50分别为0.18和1.32 mg/mL,而单载DTX脂质体对这2种肿瘤细胞的IC50分别为1.10 和5.94 mg/mL,证明了共载脂质体相比于单载脂质体对肿瘤细胞的毒性大幅增强。Reddy等[46]构建了一种共递送PTX和Bcl-2 siRNA的pH敏感型脂质体。采用该脂质体共递送PTX与Bcl-2 siRNA显著抑制了裸鼠模型中肿瘤的生长,经治疗后,肿瘤体积仅为生理盐水组的1/9,为单载PTX脂质体或单载siRNA脂质体治疗组荷瘤小鼠肿瘤体积的1/4,说明在抗凋亡蛋白Bcl-2下调情况下,PTX的化疗效果会得到明显增强。RT-PCR和Western blot实验结果证明,Bcl-2 siRNA不仅降低了Bcl-2的表达,而且还增加了促凋亡蛋白Bax的表达。因此,靶向抗凋亡蛋白与化疗药物合用可通过多种途径克服肿瘤的多药耐药。
4 脂质体共递药系统在调控肿瘤微环境中的应用
随着对肿瘤生理特性的不断深入研究,研究者们逐渐发现肿瘤微环境在肿瘤的发生、发展、转移和复发过程中扮演着重要角色[47-50]。许多研究致力于调控肿瘤微环境以增强药物的疗效。Ji等[51]设计了环糊精修饰的脂质体共递药系统(LRC-GEM-PFD),两者之间通过基质金属蛋白酶-2(MMP-2)响应性肽段连接,抗纤维化药物吡非尼酮(PFD)荷载于环糊精疏水空腔中,抗肿瘤药物吉西他滨(GEM)荷载于脂质体中。当纳米药物到达肿瘤组织后,MMP-2剪切连接肽段,环糊精与脂质体分离。同时,吡非尼酮逐渐释放,作用于胰腺星状细胞(PSCs),减少肿瘤组织纤维化,消除肿瘤物理屏障;修饰“Arg-Gly-Asp”(RGD肽)的GEM载药脂质体被肿瘤细胞吞噬,发挥抗肿瘤作用。在荷载PSCs/人源胰腺癌PANC-1细胞的裸鼠皮下瘤模型种,LRC-GEM-PFD(GEM 20 mg/kg,PFD 10 mg/kg)对肿瘤生长的抑制率可达75%以上。Lv等[52]制备了PTX前药(HA-PTX)与载马马司他(MATT)的温敏性脂质体自组装形成的纳米递药系统(HA-PTX/MATT-LTSK HNPs)(图3),MATT与基质金属蛋白酶(MMPs)底物的结构类似,可竞争性地抑制MMPs活性,从而抑制肿瘤转移。但是MATT自身并不能杀死肿瘤细胞,因此通过联用MATT与PTX,同时靶向肿瘤微环境与肿瘤细胞,发挥协同作用。在荷人源乳腺癌4T1细胞的转移裸鼠模型中,该给药系统降低了肿瘤组织中MMPs的活性,减少了新生血管的生成,并完全消除了肿瘤的肺转移。
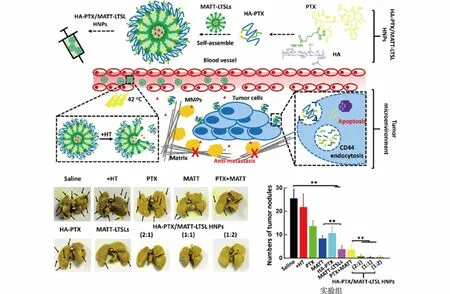
图3 HA-PTX/MATT-LTSK HNPs通过抑制肿瘤组织中MMP活性增强化疗疗效Fig.3 Schematic illustration ofHA-PTX/MATT-LTSK HNPs to inhibit the activity of MMPs in the tumor stroma for enhanced cancer chemotherapy
5 脂质体共递药系统在免疫疗法中的应用
近年来,肿瘤免疫疗法引起了极大的关注。当肿瘤发生后,其细胞膜表面的抗原容易被免疫细胞识别,从而引起免疫系统对肿瘤组织的攻击。但肿瘤组织可以通过多种方式逃脱免疫监控,例如,肿瘤细胞过量表达程序性死亡配体-1(PD-L1)和PD-L2,与T细胞表面的程序性死亡受体-1(PD-1)结合后,将关闭T细胞免疫应答,逃避免疫系统的杀灭[53]。免疫检查点阻滞剂疗法是当前的研究热点,在肿瘤临床治疗中表现出强大的抗癌能力,被认为是癌症的“终结者”[54-56]。其中,PD-1抗体(atezolimumab)和PD-L1抗体(pembrolizumab和nivolumab)已被用于包括慢性淋巴细胞白血病、晚期黑色素瘤及非小细胞肺癌等多种肿瘤的治疗[57]。脂质体共递送系统可用于抗原呈递,在肿瘤的免疫治疗中发挥着重要作用。
Liang等[58]提出了多功能纳米抗体的概念,由脂质体包裹的金纳米笼(Lipos-AuNCs)组成(图4),旨在激活和催熟树突状细胞(DCs)等抗原呈递细胞(APCs)。修饰DCs特异性抗体aCD11c以增强纳米粒对DCs的靶向能力,还同时包载了免疫佐剂单磷酰脂质A(MPLA)和黑素瘤抗原肽TRP2(Lipos-AuNC-MPLA-aCD11c-TRP2)。动物实验结果显示,经Lipos-AuNCs脂质体金纳米笼治疗的小鼠肿瘤生长受到抑制,并在另一个肿瘤转移动物模型中减少了黑色素瘤的肺转移。该纳米粒发挥药效的机制在于增加了肿瘤组织中CD8+T淋巴细胞的比例,增强了细胞毒性T淋巴细胞免疫应答,杀伤肿瘤细胞。因此,脂质体共递送系统为肿瘤免疫治疗提供了有效的解决方案。
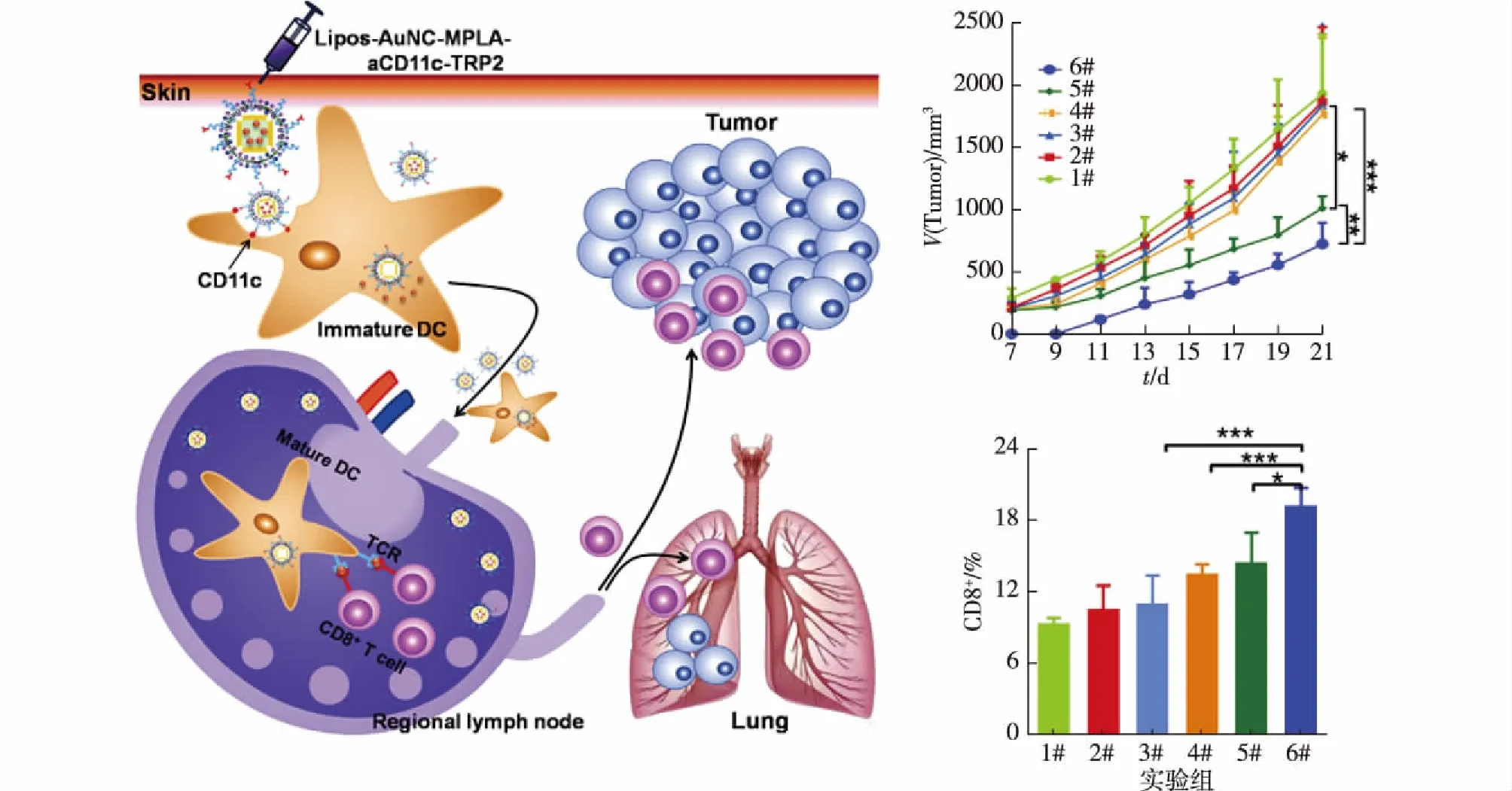
图4 用于增强免疫疗法的脂质体共递送系统Fig.4 Enhancement of immunetherapy by liposomal co-delivery systems
6 总结与展望
经过50余年的研究,脂质体从最初的经典构成开始,先后发展出靶向脂质体、长循环脂质体和siRNA脂质体等,并由研究者进行有机的组合获得了更适应临床应用潜力的共载脂质体。尽管脂质体共递送系统显示出强大的优越性,既可增强毒性、克服多药耐药,也可应用于肿瘤免疫治疗中,但是不能对脂质体共递送系统的某些问题有所忽视:①如何在处方筛选时确定所载药物的比例,并且保证药物比例在体内实验过程中也不会发生改变;②如何保证所载药物的作用效果一定是协同作用而不是拮抗作用,或者是简单的叠加作用;③如何提高脂质体负载基因或蛋白等生物药物的效率。
