基于聚酰胺胺树状大分子的纳米诊疗试剂的制备及其肿瘤成像和治疗应用进展
2018-10-11朱静怡缪文俊
朱静怡,缪文俊,黄 和
(南京工业大学药学院,江苏南京211800)
癌症作为影响人类健康的头号杀手,在临床医学、药学、生物及化学等领域受到普遍关注,基于肿瘤的局部浸润性及远端转移特性,致使癌症的治愈概率和治疗费用与癌症的诊断阶段密切相关[1-2]。因此,及早发现、及早治疗是治愈癌症的有效方法。传统治疗癌症的方法存在一定的局限性,例如:手术治疗会引起相关组织脏器病变,具有一定的负面影响;放射性治疗必然会附带有一定的毒副作用,放射治疗射野的宽广决定了毒副作用的面积[3-4]。目前,纳米科学技术作为一门新兴的技术,其在生物医药、生命科学等相关领域的应用引起了研究者的极大关注,尤其在癌症的早期诊断与治疗方面[5]。
树状大分子作为一种新型的高度支化的合成大分子[6-7],在生物医学领域尤其受到广泛关注,其分子量及尺寸随着代数的增加而增加(图1(a)),且拥有极为精确的内核、各个分支伸展所形成的内部空腔和表面众多功能基团(图1(b))[8-9],由于其分子结构呈现树状,因此称之为树状大分子。因其精确可控的结构和表面众多的可修饰基团,使其拥有良好的理化性质,可作为良好的纳米平台用于构建纳米成像试剂、药物及基因递送系统[8-11]。当树状大分子研究至第四代时,其结构犹如球形,良好的两亲性质使其易于进行多功能修饰,良好的生物相容性使其能够经肾脏排出,不在体内沉积,从而更具有在体内应用的优势。
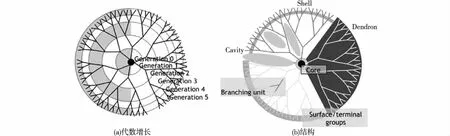
图1 典型的聚酰胺胺树状大分子的模型示意图[8]Fig.1 Schematic illustration of model of typical poly(amidoamine) (PAMAM) dendrimers[8]
目前,许多生物医学研究者通过将成像试剂、靶向试剂和药物分子修饰在树状大分子表面,金属纳米颗粒及分子药物包裹在其内部,构建纳米复合材料,进行独特的生物医学研究和应用[12-14]。其中,聚酰胺胺(poly(amidoamine),PAMAM)树状大分子作为一种阳离子型树状大分子,是使用最为普遍的树状大分子材料。目前,PAMAM树状大分子的主要制备方法包括:发散法[15]、收敛法[16]、发散收敛共用法[17]和固相合成法[18]。其中,以丙烯酸酯单体为起点,发散法合成树状大分子已广泛应用于商业化生产,可实现从第一代到第十三代树状大分子的高产量合成[17]。但仍停留在实验室中作为基础研究中最典型的方法是发散法和收敛法。
目前,针对肿瘤成像及治疗,传统的造影剂及治疗试剂均存在各自缺陷。在肿瘤诊断方面,X线断层成像(X-ray computed tomography imaging,CT)利用体内不同组织脏器对X线具有不同的透过率进而对人体进行扫描成像[14]。在临床医学中常用的CT造影剂是基于碘的小分子造影剂,如,欧乃派克和泛影酸等。这类基于碘的小分子造影剂具有较短的体内成像时间、较短的血液循环时间及一定的肾脏毒性[19],这些缺陷阻碍了其在体内良好的生物医学应用。
磁共振成像(magnetic resonance imaging,MRI)则是利用射频波及磁场引起氢原子核的共振,收集电磁信号以获取目标观察部位图片的成像技术[20-22]。常见的MRI造影剂包括阳性造影剂及阴性造影剂。阳性造影剂的成像元素主要有钆(Gd)及锰(Mn)[23-26],阴性造影剂主要有氧化铁纳米粒子[27-28]。小分子钆基造影剂由于较小的分子量而具有较短的血液循环时间,无组织特异性。而未经修饰的锰基及氧化铁纳米造影剂具有较差的稳定性,不易长期保存。这些缺陷影响了其在体内实现高效的MRI成像。
正电子发射计算机断层成像(positron emission computed tomography,PET)和单光子发射计算机断层成像(single photon emission computed tomography,SPECT)则是收集、显示放射性核素在体内的分布情况,以获取各组织器官的生命活动信息。其作为重要的功能成像技术,能即时显示组织器官的功能变化[27,29]。常见的成像核素有镓-67(67Ga)、碘-131(131I)、锝-99m(99mTc)及铊-201(201Tl)等[30]。由于核素自身的放射性,因此,在进行病灶部位病理成像的同时,对正常组织器官也具有一定的辐射作用,往往游离的小分子核素易于非特异性黏附于正常组织脏器中,对正常组织脏器具有一定的辐射伤害,限制了其在体内的核医学成像。
在肿瘤治疗方面,化学治疗和核医学治疗是其中重要的手段,化学药物和放射性药物虽具有较强的抗肿瘤效果,但其无特异性,在抑制癌细胞生长的同时,对正常组织及细胞也具有一定的损伤,经体内循环传输至病灶部位的药物浓度不高的情况下,往往具有较低的治疗效率[31]。
因此,为弥补传统的造影剂及治疗试剂的缺陷,目前已有研究者以PAMAM树状大分子为载体构建纳米诊疗体系,并经研究证实其可对肿瘤进行精确诊断和高效治疗。诊疗类型涵盖CT成像和化学治疗构成的诊疗体系、MRI成像和化学治疗构成的诊疗体系、SPECT成像和放射性治疗构成的诊疗体系及其他新型的纳米诊疗体系,同时,它们也分别具有不同的成像特性及治疗效果。
因此,本综述以PAMAM树状大分子为载体,归纳不同类型的基于PAMAM树状大分子的纳米诊疗试剂的制备方法及其成像和治疗应用,以期为相关研究提供参考。
1 基于PAMAM树状大分子的CT成像及化学治疗诊疗试剂的研究进展
PAMAM树状大分子由于具有良好的理化性质,在构建有机-无机纳米复合材料方面被普遍使用。已经有研究将其作为成像试剂的载体,用于构建纳米造影剂,与众多金属纳米颗粒进行结合[14,23,28]。与此同时,它也作为良好的药物载体,用于构建纳米载药体系[12-13]。目前已有相关研究者将成像试剂与小分子化学药物同时负载在PAMAM树状大分子上以构建纳米诊疗试剂。
Zhu等[32]利用第5代PAMAM树状大分子(G5.NH2)为载体,首先,将抗癌药物a-维生素E琥珀酸酯(a-TOS)的羧基端通过1-(3-二甲氨基丙基)-3-乙基-碳二亚胺盐酸盐(EDC)活化,并与聚乙二醇的端位氨基反应生成TOS-PEG-COOH,并以同样的EDC偶联反应的方式将叶酸(FA)与聚乙二醇反应生成FA-PEG-COOH;然后,将树状大分子表面修饰荧光示踪分子异硫氰酸荧光素(FI),接着用EDC偶联反应将TOS-PEG-COOH和FA-PEG-COOH修饰在树状大分子表面构建功能化树状大分子模板;最后,通过硼氢化钠(NaBH4)还原氯金酸的方法将该功能化树状大分子内部包裹纳米金颗粒(Au DENPs),形成纳米诊疗试剂用于肿瘤CT成像及化学治疗(图2(a))。构建的金纳米材料(Au NPs)平均粒径约为3.3 nm,每个树状大分子表面修饰有9.8个抗癌药物a-维生素E琥珀酸酯,且构建的纳米诊疗材料在不同pH、温度及溶剂条件下具有良好的稳定性。基于叶酸的修饰,使形成的纳米诊疗试剂能够与高叶酸受体表达的癌细胞特异性结合。金纳米颗粒由于具有较高的X线衰减系数,因此可作为良好的CT成像试剂。a-维生素E琥珀酸酯的修饰,使构建的纳米诊疗试剂具有较高的体内体外肿瘤治疗功效。这样以树状大分子作为载体,同时负载CT成像试剂与化学治疗试剂,能够实现有效的靶向肿瘤CT成像及靶向肿瘤化学治疗作用(图2(b))。为了深入研究a-维生素E琥珀酸酯共价键合的功能化树状大分子包裹纳米金颗粒的抗癌机制,Zhu等[33]又建立了多肽精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)靶向的a-维生素E琥珀酸酯共价键合的Au DENPs体系,研究发现:RGD靶向的a-维生素E琥珀酸酯共价键合的Au DENPs能诱导癌细胞产生出比纯a-维生素E琥珀酸酯更高水平的活性氧,从而诱导癌细胞凋亡。与此同时,经过Annexin V-FITC/碘化丙啶双染实验,可知RGD靶向的a-维生素E琥珀酸酯共价键合的Au DENPs能诱导产生比纯a-维生素E琥珀酸酯更多的凋亡细胞、早期凋亡细胞及死细胞。该研究解释了a-维生素E琥珀酸酯共价键合的Au DENPs具有较高的体内体外抗癌活性的原因。
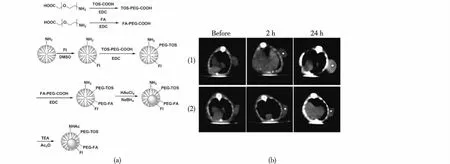
图2 (a)Au-TOS-FA DENPs的合成示意图;(b)U87MG异种移植瘤在处理前及经过Au-TOS-FA DENPs(1)和 Au-TOS DENPs(2)处理后不同时间点下的横断面CT成像图[32]Fig.2 Schematic illustration of the synthesis of Au-TOS-FA DENPs (a).Representative transverse CT images of the U87MG tumor xenografts in nude mice before and after intravenous injection of Au-TOS-FA (1) and Au-TOS (2) DENPs at different time points,respectively (b)[32]
Zheng等[34]将叶酸和甲氨蝶呤(MTX)功能化的第5代PAMAM树状大分子作为模板,利用NaBH4还原氯金酸的方法将该功能化的树状大分子内部包裹纳米金颗粒构建纳米诊疗体系(Au DENPs),基于叶酸的靶向特异性,使该纳米诊疗试剂特异性地与高叶酸受体表达的癌细胞结合,从而提高高叶酸受体表达的癌细胞的材料内吞量,再加上甲氨蝶呤的药物作用,使其能够特异性抑制癌细胞的增长(图3(a))。与此同时,金纳米颗粒起到CT成像的功能和检测作用(图3(b))。
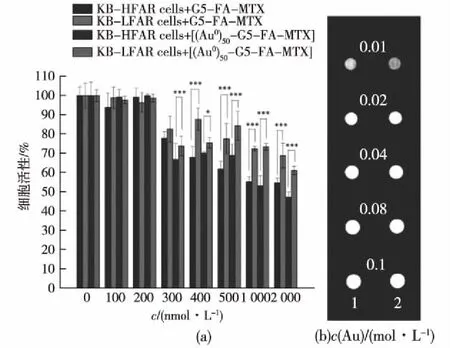
图3 (a)MTT法测试高叶酸受体表达的KB细胞 (KB-HFAR)和低叶酸受体表达的KB细胞 (KB-LFAR)分别经G5-FA-MTX树状 大分子和[(Au0)50-G5-FA-MTX]DENPs 处理后的细胞活性图;(b)[(Au0)50-G5- FA-MTX]DENPs和欧乃派克的横断面CT 成像图[34]Fig.3 MTT assay of the viability of KB-HFAR and KB-LFAR cells treated with G5-FA-MTX dendrimers and [(Au0)50-G5-FA-MTX] DENPs(a),transverse CT images (b) of [(Au0)50-G5-FA-MTX]DENPs[34]
时至今日,构建的基于PAMAM树状大分子的集肿瘤CT成像和化学治疗为一体的纳米诊疗材料,主要围绕以树状大分子为模板包裹金纳米颗粒,并在此基础上利用其氨端基团共价键合抗癌化学药物来实现。构建的该种纳米复合诊疗材料具有良好的稳定性,且基于树状大分子的模板作用可以调控金纳米颗粒的大小。以树状大分子为载体,通过功能化修饰,使其具有肿瘤精准CT成像及高效治疗的功效,可在监控癌症病情的同时实现其前期的治疗。
但目前基于PAMAM树状大分子的CT成像及化学治疗诊疗试剂仍然存在些许不足,为了实现较高的肿瘤化学治疗效率,往往需要在PAMAM树状大分子上载入大量的化学药物,但疏水性化学药物的载入会影响树状大分子包裹的金纳米颗粒的稳定性及水溶性,长时间保存后较易沉淀。因此,构建功能化PAMAM树状大分子,使其在兼具高化学治疗效率的同时具有良好的稳定性及水溶性仍是目前亟待解决的问题,这也为基于PAMAM树状大分子的CT成像及化学治疗诊疗试剂的进一步完善指明了方向。
2 基于PAMAM树状大分子的MRI成像及化学治疗诊疗试剂的研究进展
Zhu等[35]利用第5代PAMAM树状大分子(G5.NH2)优良的理化性质,内部空腔结构可包裹金属纳米颗粒或配位化合抗癌药物,表面丰富的氨基可进行多功能化修饰,构建了钆离子负载的功能化树状大分子/阿霉素配位化合物用于癌细胞的靶向诊疗。首先,将钆离子螯合剂2,2′,2″-(10-(2-(2,5-二氧代吡咯烷-1-氧基)-2-氧乙基)-1,4,7,10-四氮杂环十二烷-1,4,7-三)三乙酸(DOTA-NHS)端位的琥珀酰亚胺酯与树状大分子表面氨基反应生成G5.NH2-DOTA,再将聚乙二醇化的叶酸(PEG-FA)通过EDC偶联作用修饰在树状大分子表面;然后,利用DOTA螯合钆离子;最后,再通过功能化树状大分子内部空腔配位化合阿霉素(DOX)构建该纳米诊疗体系G5.NHAc-DOTA(Gd)-PEG-FA/DOX。每个树状大分子内部配位化合8.5个DOX分子,且构建的纳米诊疗材料在不同pH条件下稳定,能够实现DOX的缓释。
叶酸的修饰使形成的纳米材料能够与高叶酸受体表达的癌细胞特异性结合,高叶酸受体表达的KB细胞(KB-HFAR)和低叶酸受体表达的KB细胞(KB-LFAR)分别经不同钆离子浓度的G5.NHAc-DOTA(Gd)-PEG-FA/DOX孵化3 h后,能实现靶向癌细胞MRI成像(图4(a))。由于DOX的配位化合,形成的纳米诊疗材料具有一定的体外抗癌活性,KB-HFAR细胞和KB-LFAR细胞分别经DOX浓度为1 μmol/L的G5.NHAc-DOTA(Gd)-PEG-FA/DOX和G5.NHAc-DOTA(Gd)-mPEG/DOX孵化3 h后,基于FA的靶向作用,形成的纳米诊疗试剂G5.NHAc-DOTA(Gd)-PEG-FA/DOX能够实现靶向癌细胞MRI成像及治疗的效果(图4(b))。
Chang等[36]利用mPEG-NH2与表面经过甲酸酯功能化的第2.5代PAMAM树状大分子(G2.5 PAMAM)反应制备得到的mPEG-G2.5 PAMAM作为载体,并将mPEG-G2.5 PAMAM表面剩余甲酸酯与肼反应得到酰胺肼功能化的第2.5代PAMAM树状大分子,再以酰胺肼作为反应基团与DOX非芳香环上的羰基反应,形成腙键,构建DOX共价键合的功能化第2.5代PAMAM树状大分子(mPEG-G2.5-DOX)。然后,通过水热合成法将乙酰丙酮铁溶解于二苄醚和油胺的混合液中,快速升温至300 ℃反应1 h,通过离心获得超顺磁性氧化铁(IONPs)纳米材料。最后,通过配体交换反应将制备得到的mPEG-G2.5-DOX修饰在IONPs表面,构建mPEG-G2.5-DOX@IONPs(图5)。由于DOX通过腙键共价键合在IONPs表面,因此,该纳米诊疗体系具有pH响应药物缓释作用。基于肿瘤的高渗透长滞留效应(enhanced permeability and retention effect,EPR),构建的纳米诊疗体系能将DOX较多地输送至肿瘤处,且IONPs具有MRI成像的功能,可在进行肿瘤治疗的同时进行MRI成像。
Chang等[37]又以FA作为靶向分子,利用PEG将FA修饰到第3.5代PAMAM树状大分子(G3.5.NH2)表面,将抗癌药物紫杉醇(PTX)上的羟基与琥珀酸反应合成羧基化的PTX(PTX-COOH),之后通过EDC偶联反应活化PTX-COOH上的羧基,使其与G3.5.NH2上剩余的氨基反应制备得到FA-PEG-G3.5-PTX,进一步再修饰荧光示踪分子Cy5.5,通过配体交换反应将FA-PEG-G3.5-PTX-Cy5.5稳定IONPs形成FA-PEG-G3.5-PTX-Cy5.5@IONPs复合材料。构建的纳米诊疗材料对酸敏感,可在肿瘤部位弱酸性环境下实现药物缓释,且在体内具有良好的靶向肿瘤MRI成像的效果。
而Luong等[38]以第4代PAMAM树状大分子为载体,通过与超顺磁性氧化铁纳米颗粒(SPIONs)和化学抗癌药物3,4-二氟苯亚甲基姜黄素(CDF)结合构建纳米诊疗体系。首先,通过共沉淀法制备SPIONs,即将氯化铁及氯化亚铁溶解于0.4 mol/L的盐酸中,并置于圆底烧瓶中加热至80 ℃反应1 h,将形成的SPIONs通过磁分离获得,将SPIONs表面修饰3-氨丙基三甲氧基硅烷后,再与琥珀酰酐反应,使SPIONs表面羧基化形成SPIONs-COOH;之后,将叶酸修饰的PAMAM树状大分子(FA-PAMAM)与SPIONs-COOH通过碳二亚胺(DCC)偶联反应结合形成SPIONs@FA-PAMAM;最后,利用树状大分子内部疏水空腔包裹抗癌药物分子CDF构建靶向纳米诊疗材料SPIONs@FA-PAMAM-CDF,其能够与高叶酸受体表达的卵巢癌SKOV3细胞和宫颈癌HeLa细胞特异性结合。
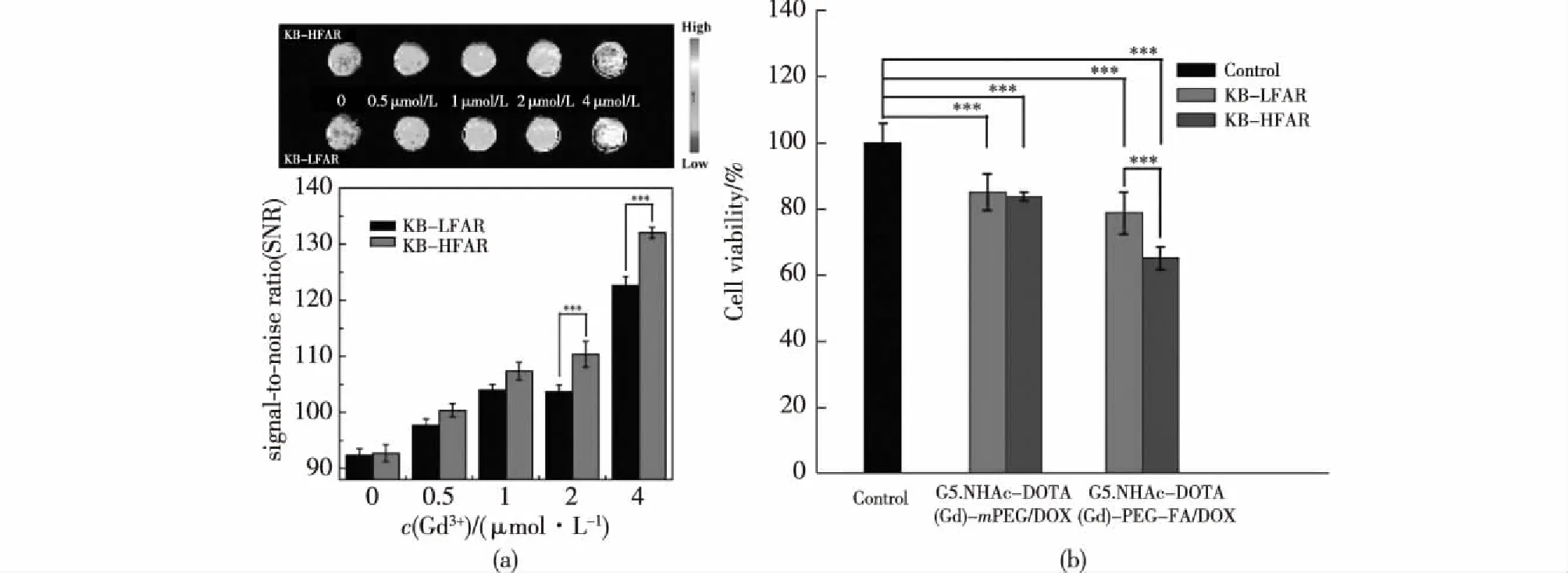
图4 (a)高叶酸受体表达的KB细胞(KB-HFAR)和低叶酸受体表达的KB细胞(KB-LFAR)经G5.NHAc-DOTA (Gd)-PEG-FA/DOX孵化后的T1 MR成像图(上)和对应的MR信号值(下);(b)KB-HFAR细胞和 KB-LFAR细胞分别G5.NHAc-DOTA(Gd)-PEG-FA/DOX和G5.NHAc-DOTA(Gd)-mPEG/DOX 孵化后的靶向癌细胞活性图[35]Fig.4 T1-weighted MR images (up) and MR SNRs (down) of KB-HFAR and KB-LFAR cells incubated with the G5.NHAc-DOTA(Gd)-PEG-FA/DOX (a).The targeted cancer cells viability ofKB-HFAR and KB-LFAR cells after treatment with the G5.NHAc-DOTA(Gd)-PEG-FA/DOX and G5.NHAc-DOTA(Gd)- mPEG/DOX complexes,respectively (b)[35]
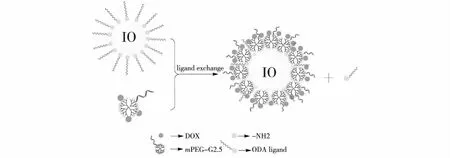
图5 单价覆盖配体ODA与mPEG-G2.5-DOX之间的直接交换反应示意[36]Fig.5 Schematic diagram showing direct exchange reactions between the monovalent capping ligand ODA and the mPEG-G2.5-DOX ligand[36]
根据在MRI成像领域常用的金属元素钆及超顺磁性氧化铁纳米颗粒,研究者们通过设计将PAMAM树状大分子与该种MRI成像元素相结合,并通过内部物理包裹或共价键合的形式负载化学抗癌药物,实现肿瘤MRI成像及化学治疗的目的。其中,PAMAM树状大分子不仅仅作为载体负载MRI成像试剂,也是作为稳定剂增强纳米材料水溶性、稳定性及生物相容性,实现其在体内的生物医学应用。但往往由于形成的Fe3O4纳米颗粒尺寸较大,在长期储存过程中仍然易于沉淀,这就使得通过树状大分子介导的氧化铁纳米诊疗材料在功能化修饰方面仍需提高,为发展生物相容性更为良好的功能分子提供了思路。
3 基于PAMAM树状大分子的SPECT成像及放射性治疗诊疗试剂的研究进展
核医学成像及治疗均是基于放射性核素自身的特性,能够发射出特定的射线进行功能成像及治疗。许多研究工作者将放射性核素的特性与树状大分子结合,实现体内特定部位的核医学成像及治疗。
Zhu等[39]利用放射性核素碘-131(131I)的特性,可同时发射出γ线用于SPECT成像和β线用于放射性治疗。以第5代PAMAM树状大分子为载体,首先,通过EDC将FA上的羧基活化,再与聚乙二醇上的氨基反应生成PEG-FA;然后,将3-(4-羟基苯基)丙酸N-羟基琥珀酰亚胺酯(HPAO)通过琥珀酰亚胺酯与树状大分子表面氨基共价键合,与此同时,将得到的PEG-FA通过EDC偶联法修饰在树状大分子表面,构建G5.NH2-HPAO-PEG-FA;最后,将树状大分子表面氨基乙酰化并由HPAO标记131I,构建具有核医学成像和放射性治疗功能的纳米诊疗试剂(图6(a))。制备得到的G5.NHAc-HPAO-PEG-FA功能化树状大分子,平均每个树状大分子表面修饰有9.4个HPAO,且G5.NHAc-HPAO-PEG-FA功能化树状大分子在0~20 μmol/L范围内对细胞无毒害作用,具有良好的生物相容性,能够与高叶酸受体表达的癌细胞特异性结合。标记131I之后具有良好的放射性稳定性,标记后27 h,该放射性纳米诊疗材料的放射性化学纯度仍然高于97%,具有靶向肿瘤SPECT成像及放射性治疗的效果(图6(b))。这种利用简单的树状大分子纳米技术可以延伸开发出更多的放射性纳米诊疗材料,用于放射性诊断及治疗不同类型的肿瘤。
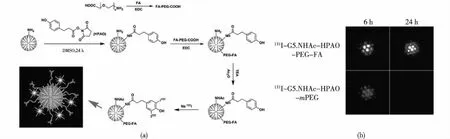
图6 (a)131I-G5.NHAc-HPAO-PEG-FA树状大分子的合成示意图;(b)C6异种移植瘤在经过尾静脉注射 131I-G5.NHAc-HPAO-PEG-FA和131I-G5.NHAc-HPAO-mPEG后不同时间点下的离体肿瘤的 SPECT成像图[39]Fig.6 Schematic illustration of the synthesis of the131I-G5.NHAc-HPAO-PEG-FA dendrimers (a), SPECT images of ex vivo tumors of nude mice bearing C6 xenografted tumors at different time points post intravenous injection of the 131I-G5.NHAc-HPAO-PEG-FA and 131I-G5.NHAc-HPAO-mPEG dendrimers (b)[39]
Zhao等[29]进一步将靶向分子氯毒素(CTX)修饰在功能化第5代PAMAM树状大分子表面。首先,以第5代PAMAM树状大分子为载体,将一端修饰甲氧基另一端修饰羧基的聚乙二醇(mPEG-COOH)通过EDC偶联法修饰在树状大分子表面;然后,将一端修饰马来酰亚胺另一端修饰琥珀酰亚胺的聚乙二醇(MAL-PEG-SVA)共价键合在树状大分子表面,再利用CTX上的巯基与MAL-PEG-SVA上的马来酰亚胺反应制备得到CTX靶向的功能化树状大分子;最后,通过修饰HPAO标记131I构建CTX靶向纳米诊疗试剂。形成的该放射性纳米诊疗体系能够与基质金属蛋白酶-2(MMP-2)过表达的癌细胞特异性结合,实现神经胶质瘤的靶向SPECT成像及放射性治疗(图7)。
He等[40]以第5代PAMAM树状大分子为载体,首先将马来酰亚胺甘氨酸酰氯通过酰氯基团与树状大分子表面氨基反应制备得到马来酰亚胺甘氨酸酰氯功能化的树状大分子,然后将血管靶向肽通过与马来酰亚胺甘氨酸酰氯上的马来酰亚胺反应,制备得到血管靶向肽修饰的树状大分子,最后利用血管靶向肽分子上的苯酚结构标记131I(标记效率为93%±1%)以构建针对甲状腺髓样癌的诊疗纳米传感器,其能够实现多种类型细胞的快速内吞。
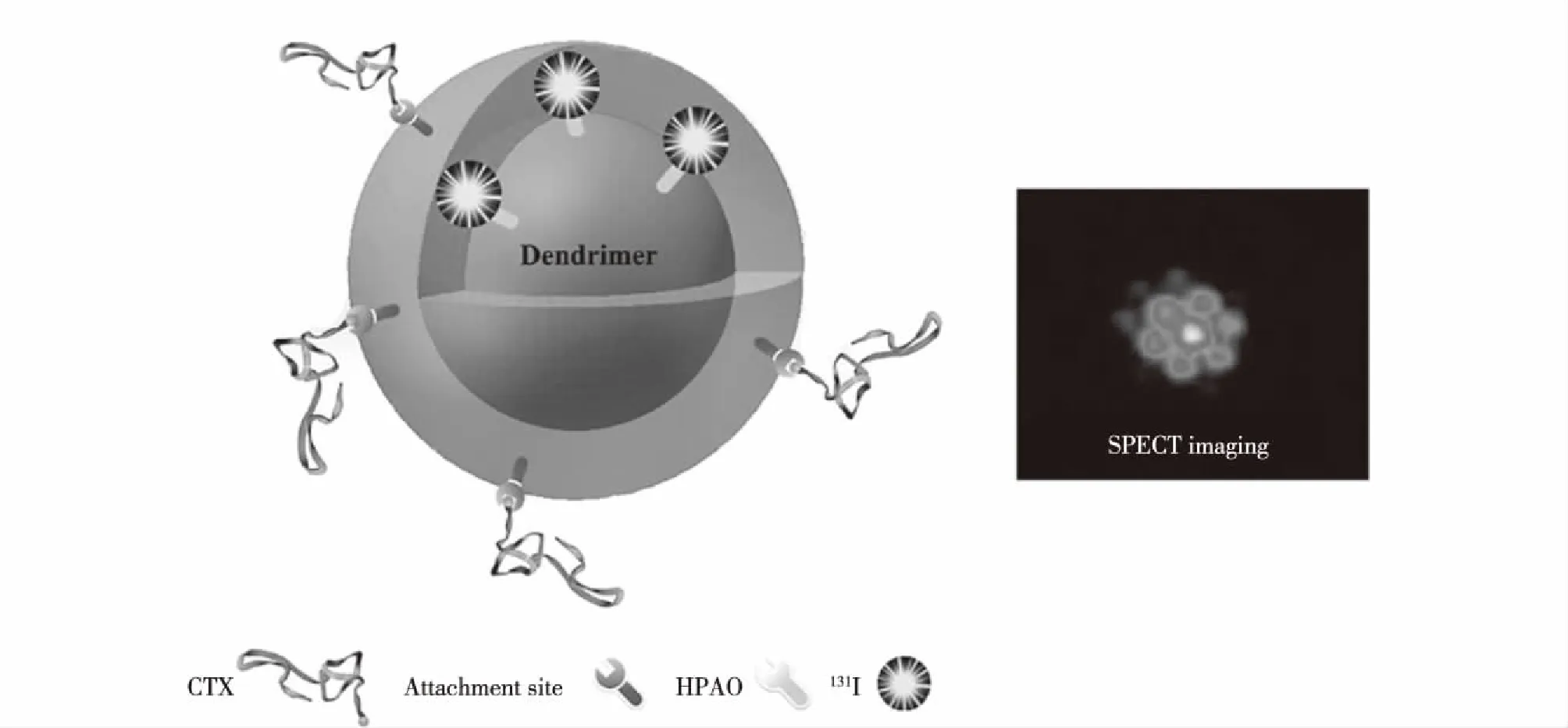
图7 131I-G5.NHAc-HPAO-(PEG-CTX)-(mPEG)的示意图;C6异种移植瘤在经尾静脉注射 131I-G5.NHAc-HPAO-(PEG-CTX)-(mPEG)15 h后的离体肿瘤SPECT成像图[29]Fig.7 Schematic illustration of 131I-G5.NHAc-HPAO-(PEG-CTX)-(mPEG) dendrimers, SPECT images of ex vivo tumors of nude mice bearing C6 xenografted tumors at 15 h post intravenous injection of the 131I-G5.NHAc-HPAO-(PEG-CTX)-(mPEG) dendrimers[29]
Mendoza-Nava等[41]以第4代PAMAM树状大分子(PAMAM-G4)为载体,首先,将放射性核素螯合剂2-[(4-异硫氰基苯基)甲基]-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)通过异硫氰基与PAMAM-G4上氨基反应制备得到PAMAM-G4-DOTA;然后,用二异丙基乙胺和2-(7-偶氮苯并三氮唑)-N,N,N′,N′-四甲基脲六氟磷酸酯的混合溶液活化FA和蛙皮素(bom)上的羧基,并将其修饰在PAMAM-G4-DOTA上得到PAMAM-G4-DOTA-FA-bom;最后,通过螯合剂DOTA将放射性核素镥-177(177Lu)标记在PAMAM-G4-DOTA-FA-bom上,以NaBH4还原氯金酸的方法使树状大分子内部包裹纳米金颗粒,合成具有较高放射性化学纯度(>95%)的纳米诊疗试剂,可用于乳腺癌的光学/核医学成像及放射性治疗。
根据部分放射性核素可同时进行核医学成像及放射性治疗的性质,结合PAMAM树状大分子优异的模板特性,近年来发展的基于PAMAM树状大分子的放射性诊疗体系实现了良好的生物医学应用。以树状大分子为介导不仅仅提高了小分子核素在体内的血液循环时间,更重要的是通过树状大分子进行功能化修饰提高了材料的放射稳定性及在肿瘤部位的富集量,能实现肿瘤部位较长时间的监控并有效地治疗肿瘤。
4 其他新型的基于PAMAM树状大分子的诊疗试剂的研究进展
除了以上所描述的基于PAMAM树状大分子的CT成像及化学治疗诊疗试剂、基于PAMAM树状大分子的MRI成像及化学治疗诊疗试剂、基于PAMAM树状大分子的SPECT成像及放射性治疗诊疗试剂之外,仍有许多新型的基于PAMAM树状大分子的纳米诊疗材料的相关报道。
Wei等[42]以第3代PAMAM树状大分子为载体构建纳米诊疗体系,用于肿瘤的CT成像/热成像、光热治疗/基因治疗。首先,将第3代PAMAM树状大分子与巯基乙酸甲酯反应得到巯基化的树状大分子(G3-SH);通过金种子合成法制备纳米金星(Au NSs)材料后,将G3-SH通过Au-S键修饰在Au NSs表面形成Au DSNSs;然后,将RGD靶向肽与聚乙二醇(NH2-PEG-COOH)共价键合制备得到的RGD-PEG-COOH通过EDC偶联法修饰在G3-SH表面构建RGD靶向的功能化金纳米星(RGD-Au DSNSs);最后,将构建的载体RGD-Au DSNSs用来配位化合小干扰RNA(siRNA),应用于肿瘤的CT成像/热成像、光热治疗/基因治疗方面。在近红外激光照射下,经RGD-Au DSNS/siRNA孵化的癌细胞的细胞活性只有20.2%,低于经单独的光热治疗或基因治疗的癌细胞活性,具有较高的治疗效率。体内实验也证明构建的新型纳米材料能实现肿瘤的CT成像/热成像、光热治疗/基因治疗。
Wong等[43]以第5代PAMAM树状大分子为载体,将其功能化与上转换纳米材料结合构建纳米诊疗体系。首先,将上转换纳米晶体氟钇化钠(NaYF4)掺杂镧系元素镱/铒(Yb/Er)制备得到NaYF4:Yb/Er,即通过热分解法将三氟乙酸钠、三氟乙酸钇、三氟乙酸镱和三氟乙酸铒混合,将油酸/油酸钠作为混合配体加入,在热分解过程中通过调控油酸钠的加入量以改变上转换纳米晶体的尺寸。然后,将邻-硝基苄基化的DOX和FA共价键合在表面羧基化的树状大分子上;最后,将功能化的树状大分子通过其表面羧基与表面氨基化的上转换纳米晶反应构建纳米诊疗体系。形成的该纳米诊疗材料能被KB细胞特异性吞噬。结果表明:在特定光源照射下,构建的纳米诊疗试剂能抑制癌细胞生长,实现不同类型癌细胞的近红外(NIR)成像及光控制药物缓释。
新型的基于PAMAM树状大分子纳米诊疗试剂的构建也是基于新型纳米光热材料及上转换纳米材料的兴起,结合不同成像试剂及治疗试剂的特性,相互辅助以实现优势互补。其中,树状大分子即可作为良好的生物相容性分子改善纳米诊疗体系的生物相容性,还可作为介导分子引入治疗试剂或其他功能分子,以构建出更贴近临床医学应用的纳米材料。新型成像方式及治疗手段的结合提高了肿瘤诊疗的多样性,也提高了肿瘤诊疗的精确性及高效性。
5 总结与展望
笔者系统总结了基于PAMAM树状大分子的纳米诊疗试剂的制备及其肿瘤成像和治疗应用,综述了几种基于PAMAM树状大分子的纳米诊疗试剂,涵盖基于PAMAM树状大分子的CT成像及化学治疗诊疗试剂,基于PAMAM树状大分子的MRI成像及化学治疗诊疗试剂,基于PAMAM树状大分子的SPECT成像及放射性治疗诊疗试剂,其他新型的基于PAMAM树状大分子的诊疗试剂,发现这种类型的纳米诊疗试剂可利用温和的PAMAM树状大分子纳米技术制备,与此同时,利用功能化树状大分子的优良性质弥补小分子药物在体内较短的血液循环时间、无特异性造成的毒副作用等。将成像试剂和治疗试剂同时负载在PAMAM树状大分子上,可进行肿瘤的早期精确诊断和有效治疗,定期观察可实现肿瘤的有效监控。
此类纳米诊疗材料的制备具有一定的灵活性,也是基于PAMAM树状大分子精确可控的尺寸和结构以及表面可功能化修饰的特点,这是PAMAM树状大分子生物医用纳米材料未来发展的基础,但是PAMAM树状大分子包裹的金属纳米材料所构建的纳米诊疗试剂仍具有一定的缺陷,需选择合适的反应条件才能制备出胶体稳定性良好的纳米颗粒,这就需要从构建性质更为良好的功能化树状大分子入手,提高功能化树状大分子的理化性能。随着更多更为新奇的分子成像试剂及治疗药物的出现,可与PAMAM树状大分子结合,从而制备出更为新型的基于PAMAM树状大分子的复合纳米材料。相信随着科技进步和纳米技术的不断提升,在不久的将来,基于PAMAM树状大分子的纳米诊疗试剂能从基础研究逐渐转向临床医学应用,成为临床医用产品,真正诊断与治愈癌症病患。
