星形胶质细胞-小胶质细胞的交互作用及其介导的神经炎症反应研究进展❋
2018-10-11吴春云
韩 宏 吴春云 袁 云
(昆明医科大学基础医学院人体解剖学与组织学胚胎学系, 昆明 650500)
中枢神经系统(central nervous system, CNS)损伤后,小胶质细胞和星形胶质细胞均被激活,共同参与神经炎症反应的调节。近年越来越多的研究表明脑内各种细胞的相互作用对脑的生理和病理过程非常重要,特别是神经胶质细胞之间的“交叉对话”在调节脑内炎症中起着核心作用[1-2]。CNS损伤后,小胶质细胞的激活更为迅速,表现为“分支状”的静息态转变为“阿米巴样”的激活态,从损伤周边区快速向中央区迁移,吞噬细胞碎片等,而激活的星形胶质细胞主要位于损伤的周边区,快速形成机械及分子屏障,将损伤局限化,积极发挥神经保护作用[3-4]。体外研究显示,用脂多糖(lipopolysaccharide, LPS)刺激BV-2小胶质细胞的培养液培养星形胶质细胞,结果显示星形胶质细胞的神经胶质纤维酸性蛋白(glail fibrillary acidic protein, GFAP)、白介素-1β(interleukin-1β, IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)表达量显著增加,说明激活的小胶质细胞通过释放某些细胞因子促使星形胶质细胞的活化并高表达某些炎性因子[5-6]。Chen等[7]研究表明在LPS刺激的高浓度星形胶质细胞中增加0.5%~1%的小胶质细胞,使TNF-α、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)释放也明显增多,提示小胶质细胞和星形胶质细胞间的相互作用参与LPS刺激星形胶质细胞释放炎症因子及胶质源性神经营养因子的调节。所以,现将星形胶质细胞和小胶质细胞在神经炎症反应中的作用,以及两者之间的交互作用进行综述,为CNS损伤后的神经炎症反应提供新的治疗策略和视角。
1 神经炎症反应
CNS损伤后,常伴随神经炎症反应的发生。神经炎症反应是一个渐进发展的复杂级联过程,主要表现为神经胶质细胞的活化、增生,外周炎症细胞浸润及相关炎性细胞因子的表达。神经炎症反应是一把“双刃剑”,主要取决于炎症反应的类型、持续时间及周围环境。一般在CNS损伤的早期,神经胶质细胞迅速活化、增殖,释放炎性介质诱导炎症反应,及时将病灶区局限化,并通过分泌胶质源性神经营养因子,促使神经元修复,如果损伤刺激未能适当控制或持续存在,将进一步加重炎症反应,或转为难以控制的慢性持续神经炎症反应,导致神经元持续性损伤,或诱发多种神经退行性疾病。在以急性神经炎症反应为主要表现的脑缺血损伤等疾病中,星形胶质细胞可通过分泌抗炎因子,抑制小胶质细胞的激活,抑制神经炎症反应[8],而在以慢性神经炎症反应为主要表现的神经退行性疾病中,如阿尔茨海默症(Alzheimer’s disease, AD)等,星形胶质细胞可通过表达促炎因子,如白细胞介素IL-1和IL-6、TNF-α、转化生长因子-β(transforming growth factor, TGF-β)、干扰素-γ(interferon-γ, IFN-γ)等诱导小胶质细胞激活,引起持续性的神经炎症反应[9]。
2 星形胶质细胞在神经炎症反应中的作用
星形胶质细胞作为CNS中数量最多的细胞群,并不是孤立存在的,广泛分布于众多细胞之间,可能与其他细胞之间存在着复杂的相互调节机制。研究表明星形胶质细胞与神经元存在复杂的相互作用,通过影响葡萄糖的释放和基础代谢酶的表达来调节脑内营养物质代谢,共同参与CNS的信息处理[10],并与小胶质细胞和少突胶质细胞共同参与髓鞘的损伤和修复[11]。在某些病理条件下,星形胶质细胞活化增生,通过直接或间接的方式,从不同的方面介导CNS内的免疫反应[12]。星形胶质细胞可直接释放神经营养因子维持神经细胞存活,或释放某些炎性介质促进神经细胞的坏死,也可间接调节小胶质细胞的功能,通过抑制小胶质细胞介导的炎症反应,限制外周炎症细胞浸润及某些细菌通过血脑屏障,修复受损的血脑屏障,并抑制中性粒细胞的凋亡、脱颗粒等,增强中性粒细胞的吞噬能力,抑制炎症反应[13]。如脑缺血损伤后,星形胶质细胞由静息状态转变为活化状态,并分布于损伤区的周边,一方面通过抗氧化、摄取过剩谷氨酸、调节神经细胞外钾离子以及偶联神经元代谢等发挥神经保护作用;另一方面又可通过释放细胞因子促进炎性反应、产生神经毒性活性氧、释放兴奋性氨基酸等损伤神经元[14]。所以,进一步探索星形胶质细胞在神经炎症反应中的作用,为研究神经保护方面提供新的治疗靶点。
3 小胶质细胞在神经炎症反应中的作用
小胶质细胞作为CNS中的固有免疫监视细胞,正常情况下处于静息状态,通过其分枝不停地快速舞动,监视脑内环境中的危险信号[15]。在病理条件下,小胶质细胞迅速转变为激活状态的“阿米巴样”,分泌大量促炎性细胞因子,募集星形胶质细胞及其他免疫细胞,向病灶区迁移,发挥积极的免疫功能。小胶质细胞对不同程度的刺激有不同的表型,主要分为M1和M2两型。M1型是经典激活状态,具有重要防御保护作用,如在TFN-γ和LPS刺激下,通过分泌促炎因子IL-12、IL-23、IL-1β及TNF-α,增强其吞噬和抗原呈递作用;M2型是选择性激活状态,如在IL-4或IL-13的作用下,可以促进血管生成、基质重塑和MHCII分子的表达,通过抑制NO和促炎因子IL-12、IL-23、IL-1β及TNF-α等释放,抑制炎症反应[16]。激活的小胶质细胞分泌的抗炎因子和神经营养因子对神经元的存活具有重要意义。最近的研究表明过度激活的小胶质细胞,通过高表达促炎因子,进一步加重神经元损伤。所以,抑制小胶质细胞的过度激活及其介导的炎症反应,越来越受到人们的重视。本课题组的研究显示,应用灯盏花素治疗大鼠大脑中动脉闭塞引起的局灶性脑梗死,脑梗死区域减小,激活小胶质细胞的数量及其促炎性介质IL-1β、iNOS、TNF-α的表达减少,并证实可能通过抑制和NF-KB信号通路抑制小胶质细胞的激活及介导的神经炎症反应[17]。同样在神经退行性疾病中如AD, Dhib-jalbut等[18]研究显示IL-33也可抑制小胶质细胞的过度激活,减少促炎因子的表达,促进Aβ的清除,从而发挥积极的治疗作用。小胶质细胞在脑缺血中发挥脑保护和神经毒性双重作用,一方面,活化后小胶质细胞吞噬细胞碎片和有害物质、释放抗炎因子,从而削弱炎症的不利影响和促进组织恢复;另一方面,活化的小胶质细胞也可产生活性氧和炎性细胞因子等发挥细胞毒性作用。所以,充分发挥小胶质细胞的神经保护作用,抑制小胶质细胞的神经损害作用将提高脑缺血的治疗效果和改善预后。
4 神经炎症反应中小胶质细胞对星形胶质细胞的调节作用
小胶质细胞作为CNS的重要免疫细胞,在神经组织损伤前,能对危险信号做出快速的反应,几分钟内活化,并释放促炎因子,积极参与免疫反应。研究表明激活的小胶质细胞可诱导星形胶质细胞的激活,具体机制可能是激活的小胶质细胞通过直接或旁分泌某些细胞因子,通过作用于星形胶质细胞的某些特异性受体,使星形胶质细胞更具有活性,或通过调节星形胶质细胞某些信号通路,参与介导星形胶质细胞存活和凋亡及其对髓鞘磷脂的清除、抗氧化防御及促炎因子的产生等。在CNS损伤的急性期,活化的小胶质细胞可释放IL-1、IL-2、IL-6、TNF-α等炎性因子,作用于星形胶质细胞上的相关受体,作为最初的触发因子,使星形胶质细胞激活。Balasingam 等[19]用IL-1、IL-2、IL-6、TNF-α等炎性因子,向新生小鼠脑内注射,结果显示星形胶质细胞的GFAP的表达明显增加。体外研究显示小胶质细胞是通过旁分泌的方式释放TNF-α,并诱导周围星形胶质细胞的增生,释放胶质源性神经营养因子,发挥神经保护作用[8],而Iizumi等[20]研究显示激活的小胶质细胞释放的一氧化氮(nitric oxide, NO)通过Keap1/Nrf2系统,激活星形胶质细胞的磷酸戊糖途径 (pentose-phosphate pathway, PPP),产生谷胱甘肽过氧化物酶降低氧化应激反应,发挥神经保护作用。但Liddelow等[21]报道,在神经退行性疾病中,如AD、帕金森病(Parkinson’s disease, PD)等,激活的小胶质细胞通过分泌IL-1α、TNF-α和补体蛋白C1q(complement proteins C1q, C1q)调节反应性星形胶质细胞的功能改变,使其丧失维持神经元存活、生长及突触形成等功能,并诱导神经元和少突胶质细胞的死亡,加重病程的进展。Molet等[22]报道小胶质细胞通过JAK/STAT3通路,作用于邻近的细胞,主要激活星形胶质细胞的c-Jun、STAT3和NF-κB通路,促进星形胶质细胞增殖,参与周围多种细胞功能的改变及中枢神经组织损伤后的重塑。脊髓损伤后,激活的小胶质细胞/巨噬细胞即M1型,部分通过TLR/MyD88信号途径,诱导反应性星形胶质细胞的凋亡,抑制继发性脊髓损伤[23]。所以,当中枢神经损伤后,小胶质细胞以旁分泌的方式释放炎性介质,作用于周围的星形胶质细胞,诱导星形胶质细胞活化、增生,或改变反应性星形胶质细胞的功能,对维持神经元的存活和凋亡有重要意义。总之,激活的小胶质细胞和其产生的细胞因子通过控制星形胶质细胞的数量和功能来调节炎症反应。
5 神经炎症反应中星形胶质细胞对小胶质细胞的调节作用
星形胶质细胞,作为大脑中最丰富的细胞,可以分泌细胞因子,调节小胶质细胞活化。CNS损伤后,与小胶质细胞的快速反应相比,星形胶质细胞的反应相对滞后,但在慢性神经炎症反应的维持中,反应性星形胶质细胞起关键作用,通过释放IL-1、IL-6、TNF-α、TGF-β、IFN-γ等激活小胶质细胞,引起持续神经炎症反应[24]。Tanuma 等[25]研究显示在继发进展型多发性硬化病变的边缘,星形胶质细胞产生的CCL2和CXCL10,通过作用小胶质细胞的 CCR2和CXCR3受体,诱导其激活,引起持续的脱髓鞘病变。有报道称星形胶质细胞同样以旁分泌的方式释放ATP、谷氨酸、活性氧(ROS)、NO等,调节邻近的神经元、少突胶质细胞、小胶质细胞的存活和再生。脑损伤后,反应性星形胶质细胞释放的ATP,作用于小胶质细胞的嘌呤受体,使其快速向损伤区域迁移,发挥免疫功能[26]。另有研究表明在炎性因子IFN-γ刺激下反应性星形胶质细胞释放ATP,反复作用于小胶质细胞的嘌呤受体P2X7,导致小胶质细胞内钙浓度改变,引起膜通透性改变,诱导小胶质细胞凋亡,这种机制可能参与控制CNS的病理生理条件(如急性多发性硬化、实验性自身免疫性脑脊髓炎大鼠)下的小胶质细胞的数目[27]。Min等[28]研究表明用星形胶质细胞的条件培养液处理小胶质细胞,小胶质细胞增加血红素氧化酶-1(Heme oxygenase-1, HO-1)表达水平及活性,通过诱导核因子E2相关因子2转录因子的核转位,增加抗氧化反应元件的结合活性,增强HO-1的启动子活性,并抑制IFN-γ诱导的ROS的产生,导致iNOS的表达减少和NO的释放,以上表明星形胶质细胞通过调节小胶质细胞对血红素氧化酶HO-1的表达和ROS产生,抑制小胶质细胞介导的过度炎症反应。Hung等[29]研究显示激活的星形胶质细胞可通过TLR4/NF-κB/STAT3信号通路,释放生长相关蛋白43(growth associated protein 43),抑制小胶质细胞的激活及其介导的神经毒性,发挥积极保护作用。在神经退行性疾病中,星形胶质细胞释放的神经营养因子,抑制小胶质细胞的过度激活,抑制神经炎症反应,发挥保护作用[30]。星形胶质细胞通过释放趋化因子CCL2,作用位于小胶质细胞的CCR2,诱导小胶质细胞转化为M1型及增强其迁移能力[31]。因此,星形胶质细胞和其产生的细胞因子通过调节小胶质细胞的数量和功能来调节炎症反应。
6 神经炎症反应中星形胶质细胞和小胶质细胞的交互作用
CNS受到创伤、缺血缺氧、感染等损伤刺激时,小胶质细胞激活早于星形胶质细胞,并促进星形胶质细胞活化,同时活化的星形胶质细胞反过来作用于小胶质细胞,也可促进远距离小胶质细胞的活化,或抑制小胶质细胞的过度激活。由于小胶质细胞自身表达一些细胞因子的受体,而星形胶质细胞在相同细胞因子刺激下,也表达一些细胞因子,促进其增生,所以小胶质细胞和星形胶质细胞是通过细胞因子进行交流,形成胶质细胞旁分泌的调节模式。有人报道称小胶质细胞和星形胶质细胞通过IL-1、ATP、TGF-β等细胞因子进行相互调节[32]。体外研究证实小胶质细胞通过旁分泌的方式释放TNF-α,诱导周围星形胶质细胞的增生,且星形胶质细胞培养基能够显著降低小胶质细胞对氧化应激的反应,其机制是星形胶质细胞培养基通过活化小胶质细胞内的转录因子Nrf2,促进抗氧化应激基因的表达,从而降低氧化自由基的产生。这个调节途径作为一个负反馈调节方式,抑制小胶质细胞产生过多氧化自由基,从而减少对神经元的非特异损伤[21-22]。Norden 等[33]的研究显示激活小胶质细胞释放的IL-10作用星形胶质细胞的IL-10受体,诱导星形胶质细胞对TGF-β的释放,并抑制小胶质细胞激活,抑制神经炎症反应。当中枢神经性炎症反应时,尿嘧啶核苷酸向细胞外基质释放,激活神经胶质细胞嘧啶受体,促进其反应性表型的发展。例如共培养的小胶质细胞和星形胶质细胞给予LPS和尿嘧啶核苷酸培养48 h,显示激活小胶质细胞的P2Y6受体,可以促进NO释放和星形胶质细胞凋亡,控制其增殖的速度,阻止过度的胶质化,说明小胶质细胞-星形胶质细胞之间通过嘧啶受体通路影响神经慢性炎症和反应性胶质化[34]。当外周神经或组织损伤后,IL-18介导小胶质细胞和星形胶质细胞的相互作用,导致脊髓背角敏感化,引起神经性疼痛[36]。Abudara 等[36]研究表明小胶质细胞源性的IL-1β和TNF-α刺激星形胶质细胞Cx43半通道蛋白激活,导致星形胶质细胞的半通道开放,增加其细胞膜的通透性,引起钙离子内流,谷氨酸释放增加,突触间信息传递障碍。在慢性神经炎症为主的退行性神经病变,如AD,Aβ作为激活星形胶质细胞中NF-κB信号通路的上游分子,导致补体C3的释放,当作用于神经元的补体C3受体上时,可影响树突的形态改变和认知障碍;作用于小胶质细胞C3a受体上时,调节神经炎症反应和Aβ病理作用[37]。本课题组用LPS直接刺激培养的TNC1星形胶质细胞,应用免疫荧光双标和RT-PCR技术检测TNF-α和iNOS的mRNA的表达水平及GFAP、TNF-α的表达变化,与正常对照组无明显变化,而应用BV-2小胶质细胞的培养基培养TNCI星形胶质细胞,同样应用LPS刺激,显示与正常对照组相比,星形胶质细胞对TNF-α和iNOS的mRNA的表达水平及GFAP、TNF-α的表达显著增高,结果说明LPS可能通过BV-2小胶质细胞分泌的某些细胞因子的介导下,间接激活星形胶质细胞。经过体内外研究证明,灯盏乙素治疗大鼠脑缺血损伤,不仅是通过抑制小胶质细胞的过渡激活介导的炎症反应,还通过调节星形胶质细胞的活化、增殖,促进修复。进一步研究表明,灯盏乙素不能直接促进星形胶质细胞的活化,而是通过小胶质细胞的介导,间接促进星形胶质细胞的活化、增殖,可能是灯盏乙素等药物通过促进小胶质细胞和星形胶质细胞之间的相互通信,介导神经炎症反应,发挥积极的治疗作用[5]。由于各种类型的细胞空间位置需要严格按照其结构和功能进行排列,其空间位置关系必定与其功能紧密相关。梁亚杰等[38]应用激光共聚焦图像三维重建技术,显示在静息状态下,小胶质细胞与神经元、髓鞘和星形胶质细胞有紧密的、直接的接触,小胶质细胞有多级分支,环绕星形胶质细胞的胞体;在某些病理条件下,如本课题组通过激光共聚焦显微镜观察到大鼠脑梗死的“半暗区”内,增生、肥大的星形胶质细胞伸出的突起和激活的小胶质细胞相互交错,关系密切。星形胶质细胞活化后不仅接受小胶质细胞的突起,还发出突起到小胶质细胞的胞体,说明星形胶质细胞和小胶质细胞在面对外界和内环境中的刺激时,是以协同的方式来处理。也有研究报道,在神经退行性疾病中,神经炎症并不一定是始发因素,但是持续的炎症反应会导致疾病的进行性加重,使神经炎症与神经元病变之间构成恶性循环,最终导致更多的神经元死亡。星形胶质细胞和小胶质细胞及其两者的交互作用对神经炎症反应的发生、发展非常重要。研究表明神经胶质细胞之间的交互作用,参与慢性神经性疼痛的形成,主要表现为小胶质细胞参与神经性疼痛,而星形胶质细胞参与炎性疼痛,且星形胶质细胞CXCL12和小胶质细胞表达CXCR4之间的相互作用,可以诱发神经性疼痛[39-40]。
综上所述,小胶质细胞和星形胶质细胞在神经炎症反应中都具有双重调节作用,导致两者之间的“交叉对话”机制比较复杂(图1)。激活的小胶质细胞既可促进星形胶质细胞活化,也可抑制星形胶质细胞的活化;同样,活化的星形胶质细胞既可促进小胶质细胞激活,也可抑制小胶质细胞活性。总体来说,调节小胶质细胞和星形胶质细胞的功能及两者的交互作用,通过限制致炎因子和氧化应激分子等的过度产生,通过促进胶质性神经营养因子等分泌,减轻神经炎症反应,保护神经组织。所以,如何调节两者之间的平衡关系,将为神经炎症反应介导的疾病提供新的治疗策略研究方向。
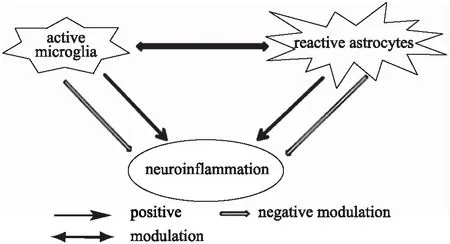
图1 星形胶质细胞和小胶质细胞在神经炎症反应中的
