稳定表达hOAT1的HEK293细胞系的建立及鉴定
2018-10-11傅晓钟
李 静,杨 洋,肖 涛,李 韬,欧 瑜,傅晓钟,刘 亭
(贵州医科大学 1. 贵州省药物制剂重点实验室/药用植物功效与利用国家重点实验室、2.药学院、3. 民族药与中药开发应用教育部工程研究中心,贵州 贵阳 550004;4. 贵阳市妇幼保健院药剂科,贵州 贵阳 550002)
人有机阴离子转运体1(human organic anion transporter 1, hOAT1)(SLC22A6)属于可溶性载体家族SLC22。hOAT1于1997年在大鼠、小鼠和冬季牙鲆体内首次发现,并在爪蟾卵母细胞中表达后,介导对氨基马尿酸(p-aminohippuric acid,PAH)、环状核苷酸和其他小有机阴离子的摄取,表明其具有广泛的底物特异性[1],其 cDNA的CDS区编码556个氨基酸残基,有12个跨膜区域。hOAT1 在肾近端小管基底外侧膜高表达,脑、胎盘亦有微弱的表达。该转运蛋白的底物非常广泛,包括内源性和外源性物质[2]。内源性底物包括叶酸、前列腺素、环核苷酸等,外源性底物包括抗生素(先锋霉素II、青霉素)、多种抗病毒药物(阿德福韦酯、西多福韦、阿昔洛韦)、多种利尿剂(利尿磺胺、布美他尼),以及非甾体类抗炎药、甲氨蝶呤、赫曲霉素A等。同时,研究表明,核苷(核酸)类抗病毒药物进入体内后,代谢形成的磷酸(膦酸)双负离子能被存在于肾小管基底膜上的hOAT1跨膜转运而沉积于肾脏近曲小管内,后者通过抑制近曲小管上皮细胞线粒体DNA(mitochondrial DNA, mtDNA)的复制,从而使mtDNA耗碣,并最终降低由mtDNA编码的细胞色素C氧化酶(cytochrome C oxidase, COX)水平。破坏上皮细胞氧化呼吸过程是药物产生肾毒性的根本原因[3-4]。
为获得稳定表达hOAT1的细胞模型,用于对抗病毒核苷(核酸)类药物的肾毒性机制进行评价,本实验拟构建稳定高表达 hOAT1的细胞模型,不仅为抗病毒核苷与核酸类药物引起的临床剂量依赖性肾毒性的机制研究奠定模型基础,也为体外研究 hOAT1 底物或抑制剂的筛选提供一个便利的工具。
1 材料
1.1试剂质粒hOAT1 DNA购于北京博迈德基因技术有限公司;胎牛血清(FBS,批号1227694)、DMEM高糖培养基(批号8117288),均购于Gibco公司;TOP10感受态大肠杆菌、真核表达载体pEGFP-N1和HEK293细胞株由本实验室保存;丙磺舒(批号R09O8X45213)、兔抗β-actin单抗(批号20170310)、G418(批号712O031)、质粒提取试剂盒(批号10217KA1)、ECL发光液(批号20170215),均购于索莱宝公司;对氨基马尿酸(批号wkq17041705)购于四川省维克奇生物科技有限公司;限制性内切酶EcoRⅠ(批号00324407)、NheI(批号00307817)购于Thermo公司;FuGENE® 6 Transfection Reagent(批号0000285054)购于Promega公司; TRIzol® Reagent(批号152104)购于Ambion公司;PrimeScriptTMRT Reagent Kit(批号AK5402)、SYBR® Premix Ex TaqTMⅡ(批号AK7802)、TransScriptTMOne-Step RT-PCR SuperMix、逆转录试剂盒,均购于TaKaRa公司;鼠抗EGFP单克隆抗体(批号GR191827-3)、兔抗hOAT1多克隆抗体(批号GR176005-10)购于美国Abcam公司。
1.2仪器超净工作台(北京东联哈尔仪器制造有限公司);CO2细胞培养箱(Thermo Scientific公司);荧光倒置显微镜(日本尼康公司);Modle 680酶标仪、Allegra 64R冷冻高速离心机(美国Beckman公司);Acugity-TQD型UPLC-MS/MS (Waters公司);垂直电泳槽、PowerPac Basic电泳仪、ChemiDoc XRS+凝胶成像仪(美国Bio-Rad公司)。
2 方法
2.1真核表达载体的构建用限制性内切酶EcoRΙ与NheI将hOAT1基因片段与pEGFP-N1载体分别双酶切后,1%琼脂糖凝胶电泳分离,回收纯化后,将酶切产物用T4连接酶进行连接。连接产物加入至TOP10感受态细胞悬液中,轻轻涡旋离心管混匀,冰浴放置30 min。置于42℃水浴1 min,然后快速置于冰浴中3 min。加入LB培养基,180 r·min-1、37℃培养1 h。
将转化的产物涂布于含卡拉霉素(质量分数为0.1%)的LB琼脂平板上进行筛选培养,挑选单克隆,并进行扩增培养。提取质粒,用限制性内切酶EcoRΙ与NheI将质粒双酶切后,挑取阳性克隆进行测序。最终获得重组质粒命名为pEGFP-hOAT1。
2.2细胞培养及转染HEK293细胞在含10%胎牛血清的DMEM培养基中, 于37℃和5% CO2饱和湿度的培养箱中培养。待细胞生长至80%~90%汇合度, 用0.25%的胰蛋白酶消化传代。细胞以每孔1.5×105个的密度接种于6孔板, 待细胞长至85%汇合度时,为最佳转染状态。将FuGENE® 6 Transfection Reagent加入到无血清培养基中,混合后孵育5 min,分别加入重组质粒pEGFP-hOAT1和空白质粒pEGFP-N1,混合后孵育15 min。分别转染HEK293细胞,继续培养细胞24 h后,荧光显微镜下观察绿色荧光信号在细胞的表达与分布。
2.3筛选稳定表达[5]pEGFP-hOAT1的HEK293细胞 配制合适比例的pEGFP-hOAT1质粒DNA与FuGENE® 6 Transfection Reagent的转染液,转染液经比例优化,确定最佳比例为1 ∶3(μg ∶μL),将转染液加入至HEK293细胞中,于37℃和5% CO2饱和湿度的培养箱中培养36 h。通过荧光倒置显微镜观察,将转染效率达到95%的细胞原培养液更换为浓度800 mg·L-1的G418选择性培养液,间隔1 d更换1次含相同浓度的G418培养液,进行抗性筛选14 d,挑选单克隆细胞扩大培养,更换维持浓度的G418培养液进行培养。
2.4hOAT1mRNA的表达检测
2.4.1RT-PCR检测hOAT1 mRNA水平 以稳定转染pEGFP-hOAT1的HEK293细胞为实验组,野生型HEK293细胞为对照组,收集细胞。利用TRIzol® Reagent提取RNA,测定其浓度,逆转录成cDNA,并以其为模板,利用hOAT1引物进行PCR扩增,PCR扩增程序为:95℃预变性5 min,94℃变性30 s,55℃退火1 min,40个循环,72℃延伸10 min。以GAPDH作为内参基因,采用1%琼脂糖凝胶电泳鉴定。GAPDH上游引物5′-GGTCCTGGTTCTCATTCCT-3′,下游引物5′-TTTGAGGGTGCAGCGAACTT-3′;hOAT1上游引物5′-CTTGAAC TACCTGCAGACAG-3′,下游引物5′-GACATAGCCAATCAAGGTGC-3′,由北京博迈德基因技术有限公司合成。
2.4.2qRT-PCR检测hOAT1 mRNA水平 以mRNA逆转录后的cDNA为模板,进行荧光定量PCR反应。PCR扩增程序同“2.4.1”。以GAPDH作为内参基因,通过2-△△Ct方法分析数据。
2.5Westernblot检测蛋白表达水平分别收集稳定转染pEGFP-hOAT1、瞬时转染pEGFP-N1空质粒的HEK293细胞,及野生型HEK293细胞,PBS洗涤2次,利用膜蛋白提取试剂盒分别提取膜蛋白,用BCA法测定蛋白含量。取等量膜蛋白进行SDS-PAGE凝胶电泳,转膜,转膜后用1×TBST洗膜3次(每次5 min)。将膜在5%的BSA中封闭2 h,分别加入兔抗β-actin单抗(1 ∶1 000)、兔抗hOAT1多克隆抗体(1 ∶2 500)和鼠抗EGFP单克隆抗体(1 ∶2 500),4℃孵育过夜,用1×TBST洗膜3次(每次5 min)。加入对应二抗室温孵育2 h后,用1×TBST洗膜3次(每次5 min)。现配发光液,进行曝光拍照。
2.6pEGFP-hOAT1稳定转染HEK293细胞系的功能鉴定
2.6.1考察PAH细胞安全浓度范围 分别将生长至对数期的野生型HEK293细胞与稳定转染pEGFP-hOAT1的HEK293细胞用0.25%的消化后,以密度为1.5×108·L-1铺96孔板。取100 μL细胞悬浮液于每孔,每个浓度设5个复孔,并设置空白对照组,即加入等体积培养液。培养24 h,分别在稳定转染pEGFP-hOAT1的HEK293细胞及其野生型细胞中,设置浓度为25、50、100、200、400 μmol·L-1的PAH组。孵育1 h,弃药液,每孔加入100 μL无血清培养基及5 μL MTS,置于37℃、5% CO2细胞培养箱中孵育3 h,利用酶标仪检测吸光度值,计算细胞存活率,考察PAH安全浓度范围。细胞存活率=OD样品组/OD对照组×100%。
2.6.2考察丙磺舒细胞安全浓度范围[6]细胞分组同“2.6.1”。培养24 h,分别给药在稳定转染pEGFP-hOAT1的HEK293细胞及其野生型细胞中,设置给药浓度为25、50、100、200、400 μmol·L-1的丙磺舒。孵育1 h,弃药液,每孔加入100 μL无血清培养基及5 μL MTS,置于37℃、5% CO2细胞培养箱中孵育3 h,利用酶标仪检测吸光度值,按“2.6.1”公式计算细胞存活率,考察丙磺舒安全浓度范围。
2.6.3野生型HEK293细胞及稳定转染pEGFP-hOAT1的HEK293细胞对PAH的摄取 将野生型HEK293细胞与稳定转染pEGFP-hOAT1的HEK293细胞,以每孔3×105个细胞接种于6孔板,培养24 h 后进行PAH摄取实验。弃去旧培养基,用HBSS缓冲液冲洗1次,随后加入PAH,其稀释质量浓度为10、25、50、100、200 μmol·L-1,空白对照孔加入等体积HBSS缓冲液,将细胞放入37℃、5% CO2的培养箱中孵育1 h。迅速吸弃药液,加入冰冷PBS反复洗2次。随后使用超声波细胞粉碎仪破碎细胞,12 000×g离心20 min。吸取上清液20 μL,BCA法测定蛋白浓度,另取500 μL上清液氮气吹干,加入300 μL甲醇混匀,12 000×g离心20 min,沉淀蛋白,重复2次。最后取上清200 μL,UPLC-MS/MS分析受试化合物的摄取量。
2.6.4丙磺舒对野生型HEK293细胞及稳定转染pEGFP-hOAT1的HEK293细胞的抑制作用 将野生型HEK293细胞与稳定转染pEGFP-hOAT1的HEK293细胞,以每孔3×105个细胞接种于6孔板,培养24 h后进行丙磺舒对hOAT1抑制实验。弃去旧培养基,用HBSS缓冲液冲洗1次,随后加入丙磺舒,其稀释质量浓度为100 μmol·L-1,空白对照孔加入等体积HBSS缓冲液,置于37℃、5% CO2的培养箱中预孵育10 min。迅速吸弃药液,加入PAH。细胞分组与操作同“2.6.3”。
2.7色谱与质谱条件色谱柱 Waters Van Guard BEH C l8 (2.1 mm×50 mm, 1.7 μm)柱,柱温:45℃,流速:0.25 mL·min-1,进样体积:2.0 μL,流动相:A:含0.1%甲酸的乙腈,B:含0.1%甲酸的水,梯度洗脱:(0~1.5 min,5% A;1.5~4 min,5%~100% A ;4~6 min,100%~ 5% A )。锥孔电压为:45 V,质谱采用选择离子监测(SIR),正离子模式,以葛根素为内标。

3 结果
3.1真核表达载体pEGFP-hOAT1鉴定Fig 1琼脂糖凝胶电泳结果显示,pEGFP-hOAT1质粒的主带在6.4 kb左右,与理想大小相符合。EcoRΙ与BamHI双酶切pEGFP-hOAT1质粒的产物亦符合理论大小(Fig 2)。将阳性克隆测序,结果与GenBank(AB009697.1)报道的hOAT1序列相符,说明质粒pEGFP-hOAT1构建成功。
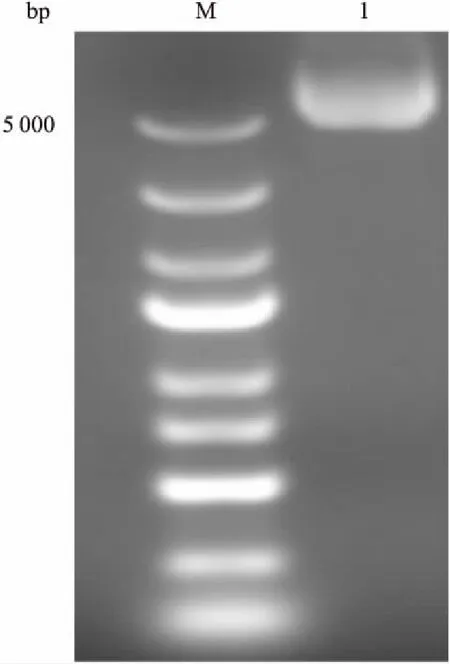
Fig 1 Gel electrophoresis of pEGFP-hOAT1recombinant plasmid
M: Marker; 1: pEGFP-hOAT1 recombinant plasmid.
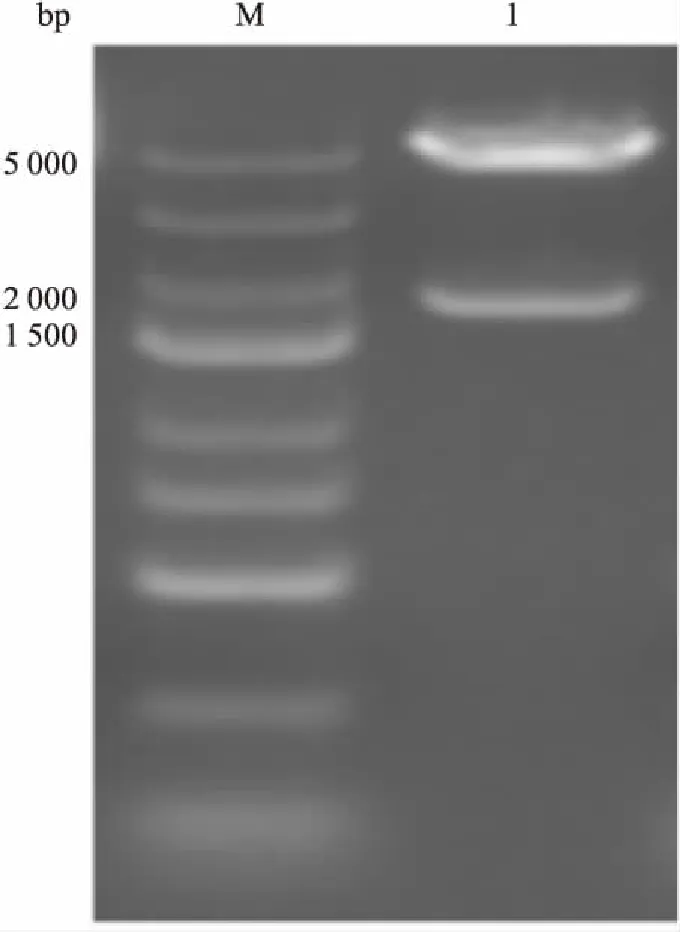
Fig 2 Identification of the recombinant plasmiddigested by EcoR Ι and Nhe I
M: Marker; 1: pEGFP-hOAT1 recombinant plasmid.
3.2稳定表达pEGFP-hOAT1细胞株的建立与鉴定FuGENE® 6 Transfection Reagent介导 pEGFP-hOAT1 质粒转染 HEK293 细胞36 h后,在含有G418(800 mg·L-1)的选择培养基中筛选14 d,4 d后会有大量的明显死亡(Fig 3)。获得稳定表达hOAT1的HEK293细胞。
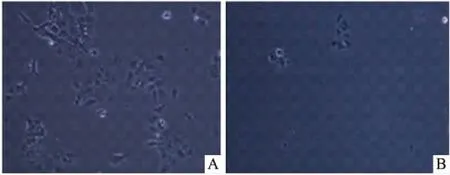
Fig 3 Cell morphology(×100)
A: Culture aton the third 3rd day; B: Culture aton the fourteenth 14th day.
3.2.1绿色荧光鉴定 FuGENE® 6 Transfection Reagent介导pEGFP-hOAT1质粒转染HEK293细胞36 h 后,荧光显微镜下观察瞬时转染后绿色荧光信号分布。如Fig 4所示,细胞融合至80%时,绿色荧光阳性率高达100% 。结果表明,构建的重组质粒可有效表达带绿色荧光的pEGFP-hOAT1融合蛋白。

Fig 4 Cell morphology under fluorescence microscope(×100).
3.2.2hOAT1 mRNA在HEK293细胞中的表达 Fig 5琼脂糖凝胶电泳结果显示,在GAPDH表达量相同时,pEGFP-hOAT1稳定转染HEK293细胞可扩增出190 bp的目的片段,而HEK293细胞组扩增不出目的条带。qRT-PCR结果显示,与对照组相比,实验组细胞中hOAT1 mRNA表达明显升高,表达量为HEK293细胞的5 600倍,差异具有显著性(P<0.01)。结果表明,pEGFP-hOAT1稳定转染HEK293细胞能转录出相应的mRNA,外源基因已整合到HEK293细胞基因组。

Fig 5 Analysis of hOAT1 mRNA
3.2.3Western blot鉴定hOAT1、EGFP特异性蛋白的表达 Fig 6的Western blot结果表明,pEGFP-hOAT1融合蛋白在稳转HEK293细胞株高表达,且分子量大小正确,与RT-PCR结果一致。说明pEGFP-hOAT1稳定转染HEK293细胞系构建成功。

Fig 6 hOAT1 and EGFP protein were analyzed
1: Stable transfected HEK293 cells; 2: HEK293 cells.
3.3pEGFP-hOAT1稳定转染HEK293细胞功能鉴定
3.3.1PAH的细胞安全浓度范围 如Tab 1所示,PAH浓度在400 μmol·L-1以下,对稳定转染pEGFP-hOAT1的HEK293细胞及其野生型细胞均没有毒性作用(P>0.05)。因此,选择给药时间1 h以内、给药浓度400 μmol·L-1以下,考察稳定转染pEGFP-hOAT1的HEK293细胞及其野生型细胞对PAH的摄取能力。

Tab 1 Toxic effects of PAH on cells after 1
3.3.2丙磺舒的细胞安全浓度范围 如Tab 2所示,丙磺舒浓度在400 μmol·L-1以下对稳定转染pEGFP-hOAT1的HEK293细胞及其野生型细胞均没有毒性作用(P>0.05)。因此,选择给药时间1 h以内、给药浓度400 μmol·L-1以下,考察丙磺舒对hOAT1的抑制作用。
3.3.3HEK293细胞及稳定转染pEGFP-hOAT1的HEK293细胞对PAH的摄取 分别给予PAH(10、25、50、100、200 μmol·L-1)至稳定转染pEGFP-hOAT1的HEK293细胞及野生型HEK293细胞中,并测定PAH的摄取量。Fig 7结果表明,与HEK293细胞相比,稳定转染pEGFP-hOAT1的HEK293细胞对PAH的摄取量明显较高(P<0.01),且在100 μmol·L-1时,pEGFP-hOAT1稳定转染HEK293细胞对PAH的摄取量趋于饱和。说明稳定转染pEGFP-hOAT1的HEK293细胞系模型构建成功。
Tab2Toxiceffectsofprobenecidoncells

GroupConcentration/μmol·L-1Cell activity/%HEK293 cellsStable transfected HEK293 cellsControl-100.00±8.25100.00±7.62Probene-cid25102.42±8.00103.76±1.6950 108.25±5.07105.53±1.04100 105.21±7.45107.81±7.10200 104.64±9.92101.74±4.27400107.49±6.98102.32±3.70

Fig 7 Concentration dependence of PAH uptake
**P<0.01vsHEK293 group
3.3.4丙磺舒对hOAT1的抑制作用 对稳定转染pEGFP-hOAT1的HEK293细胞进行预孵育,给予浓度为100 μmol·L-1的丙磺舒后,吸弃药液,分别给予PAH(10、25、50、100、200 μmol·L-1),测定PAH的摄取量。Fig 8结果表明,加入丙磺舒后,pEGFP-hOAT1稳定转染HEK293细胞对PAH的摄取量明显下降(P<0.01),丙磺舒对转染pEGFP-hOAT1的HEK293细胞系有明显抑制作用。丙磺舒为hOAT1的抑制剂,说明稳定转染pEGFP-hOAT1的HEK293细胞系模型构建成功。

Fig 8 Probenecid suppressesd concentration
**P<0.01vsstable transfected HEK293 cells with inhibitors
4 讨论
外源基因是否表达,以及目的蛋白是否具有活性,是鉴定稳定转染细胞系是否构建成功的重要标志。构建 hOAT1转染细胞模型的意义不仅在于基因水平要有变化,蛋白水平也要有变化,本方法目的是从蛋白水平对药物进行评价研究。本文通过荧光显微镜观察细胞呈绿色荧光;采用PCR和Western blot技术,检测hOAT1和EGFP在基因及蛋白水平均有表达;并且PAH摄取及进一步的丙磺舒抑制实验证实,所表达的hOAT1目的蛋白具有活性。综上所述,pEGFP-hOAT1稳定转染HEK293细胞系构建成功。PAH为hOAT1经典底物,故选择PAH对稳定转染pEGFP-hOAT1的HEK293细胞进行功能鉴定。为了进一步验证稳定转染pEGFP-hOAT1的HEK293细胞筛选模型的可行性,给予丙磺舒对模型进行了抑制剂研究,结果表明,对转染pEGFP-hOAT1的HEK293细胞系有明显抑制作用,与文献报道一致,提示该细胞模型可用于hOAT1抑制剂的筛选。
真核表达载体pEGFP-N1中包含增强型绿色荧光蛋白基因 (enhanced green fluorescence protein,EGFP),EGFP是水母体内绿色荧光蛋白(green fluorescence protein,GFP)的突变体[7],该蛋白对宿主细胞没有毒性、表达稳定,荧光强度是GFP的6倍以上;且EGFP与蛋白偶联后,不仅可在细胞内观察目的蛋白表达、分布,还不会影响外源蛋白的构象和功能。而在目的基因hOAT1中缺少EGFP基因,本文采用将EGFP与hOAT1基因相连接,得到可表达EGFP-hOAT1的融合蛋白,使其带有绿色荧光标记,易于观察。FuGENE®6 Transfection Reagent是一种新型的非脂质体基因转染试剂,需要少量的外源DNA,转染效率高,且该方法操作简单、重复性良好,不会对靶细胞产生直接损伤或毒性。本文构建EGFP-hOAT1融合蛋白,利用FuGENE®6 Transfection Reagent转染HEK293细胞,通过荧光显微镜观察不仅可以通过荧光强弱反映目的蛋白的含量,还可以研究目的蛋白的细胞分布。且PAH的摄取实验结果显示,与正常细胞相比,稳定转染细胞对PAH的摄取量明显较高,表明EGFP-hOAT1融合蛋白具有hOAT1特性介导的转运功能。此外,本文发现,转染效率与宿主细胞的状态有较大的联系,一般会选用50代以下的细胞,若出现细胞状态不好,转染效率下降,会转用新鲜培养的细胞,且细胞汇合度在80%时,转染效率最佳;在12 h后就可以观察到荧光信号,并随着时间的增加而增强,在36 h时转染效率最佳。
在以往的研究中,hOAT1转染模型的构建大多采用瞬时转染,瞬时转染基因导入细胞得以表达,但是基因不会整合到细胞的基因组上,随着细胞生长分裂,外源基因会逐渐消失,而大量的药理学研究需要的周期较长。而本文提供了构建稳定转染hOAT1的方法,解决了目的蛋白鉴定繁琐、转染方法复杂及转染效率低等问题,所得细胞模型灵敏、稳定、可靠。
综上所述,稳定表达pEGFP-hOAT1的HEK293细胞株的建立,可用于确定 hOAT1的底物和抑制剂,为进一步研究核苷类膦酸类似物类药物引起的临床剂量依赖性肾毒性的机制奠定模型基础。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
