雷公藤甲素在人和大鼠肝微粒体代谢消除和酶动力学的比较研究
2018-10-11阳海鹰车津晶
吴 桐,阳海鹰,原 梅,车津晶,李 桦
(军事医学研究院毒物药物研究所,抗毒药物和毒理学国家重点实验室,北京 100850)
雷公藤甲素(triptolide,TP)是中药雷公藤的主要活性成分,属于环氧化二萜内酯类化合物,具有免疫抑制、抗炎、抗癌、抗生育、神经保护等药理作用[1-2],临床用于治疗红斑狼疮、银屑病等免疫性疾病[3]。雷公藤是已知的有毒中药,临床主要导致剂量依赖的肝毒性[4]。国家药品不良反应监测中心病例报告数据库中,涉及雷公藤制剂不良反应的病例报告主要表现之一为药物性肝炎,毒性表现与急性黄疽型肝炎相似,常见谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)等指标升高,甚至有因肝毒性过大而致死的病例报道[5]。TP是雷公藤的主要药效成分,也是引起肝毒性的毒性成分,在人L-02细胞和大鼠原代肝细胞上表现为时间和剂量依赖的毒性[6-7];不同性别大鼠长期给药能引起不同程度的肝损伤[8]。
TP主要经细胞色素P450(cytochrome P450,CYP450)酶代谢消除,CYP3A介导的代谢是TP的解毒途径之一[9],肝脏对TP的代谢能力与肝毒性紧密相关。CYP酶基因敲除、CYP酶广谱抑制剂1-氨基苯并三唑(1-aminobenzotriazole,ABT)预处理,以及谷胱甘肽耗竭均能降低TP代谢,增强其肝毒性;而合用地塞米松、甘草甜素等CYP酶诱导剂,能减轻TP的大鼠肝毒性[10]。已有的TP肝毒性和代谢研究主要在大鼠上进行,但TP在人和大鼠肝代谢的差异尚无报道。为此,本文应用人肝微粒体(human liver microsomes,HLM)和大鼠肝微粒体(rat liver microsomes,RLM),研究TP在两个种属的代谢消除性质和酶动力学特征,比较种属间差异;并采用重组的人和大鼠CYP3A酶,探讨TP肝脏代谢消除种属差异的可能原因,为TP代谢与肝毒性关系研究和动物结果向人体的外推,提供科学依据。
1 材料与方法
1.1药品与试剂TP,纯度99.78%(中国科学院成都生物研究所,批号:MUST-17020405);还原性辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH),购自瑞士Roche公司;混合人肝微粒体和重组CYP3A酶(美国BD Gentest公司);色谱纯甲醇和乙腈(美国Fisher公司);大鼠肝微粒体为实验室自制,BCA法测得蛋白含量为15 g·L-1。
1.2仪器6410B三重四级杆串联质谱(美国Agilent公司),配备Agilent1290超高压液相色谱(UHPLC)和美国安捷伦公司Zorbax SB-C18(2.1 mm×50 mm,3.5 μm)色谱柱。
1.3人和大鼠肝微粒体的代谢稳定性孵育体系为200 μL的K2HPO4缓冲液(100 mmol·L-1,pH 7.4,含5 mol·L-1氯化镁),内含TP(1 μmol·L-1)、HLM(蛋白含量1.0 g·L-1)或RLM(蛋白含量0.5 g·L-1)和NADPH(1 mmol·L-1),每组设3个平行样品。将肝微粒体与药物的混合溶液和NADPH分别在37℃预孵育5 min后,加入NADPH启动反应,并继续在37℃孵育,于5、15、30、45、60 min取样,加入600 μL含内标(普萘洛尔 100 μg·L-1)的乙腈终止反应,涡旋振荡1 min,18 800×g离心10 min,取上清液至LC-MS/MS检测TP的剩余浓度。孵育实验平行设置不加辅酶的空白对照组、零时反应组和加入咪达唑仑的阳性对照组。
1.4人和大鼠肝微粒体的酶动力学将不同浓度药物加入上述孵育体系孵育,TP的终浓度分别为0.5、1、2、4、10、25、50、100 μmol·L-1。根据代谢稳定性实验结果,设置HLM组和RLM组的反应时间分别为45 min和5 min,同时设置零时对照组。孵育终点加入600 μL含内标的乙腈终止反应,涡旋振荡1 min,18 800×g离心10 min,取上清液至LC-MS/MS检测TP的剩余浓度。
1.5人和大鼠CYP3A同工酶的酶动力学在大鼠源重组CYP3A1和CYP3A2同工酶孵育体系(蛋白含量1 μmol·L-1),加入终浓度为0.5、1、2、4、10、25 μmol·L-1的TP,NADPH(1 mmol·L-1),37℃孵育5 min;在人源重组CYP3A4的孵育体系中(蛋白含量1 μmol·L-1),加入终浓度为0.5、1、2、4、10、25、50 μmol·L-1的TP,同法孵育45 min。孵育终点加入600 μL含内标的乙腈终止反应,涡旋振荡1 min,18 800×g离心10 min,取上清液至LC-MS/MS检测TP的剩余浓度。
1.6LC-MS/MS定量检测方法应用本课题组前期建立并验证的液质联用方法检测样品[9]。液相条件:以流动相A(含体积分数为0.1%甲酸和2.5 mmol·L-1甲酸铵的纯水)和B(含体积分数为0.1%甲酸的乙腈)按如下梯度洗脱:30% B(0 min),80% B(0~1 min),95% B(1~2 min),30% B(2.1 min),30% B(2.1~3.1 min);流速为3 mL·min-1,运行时间为3.1 min。内标为普萘洛尔。质谱条件:以电喷雾电离(ESI)源正离子多反应监测方式检测,毛细管温度350℃,毛细管电压+4 000 V,雾化气25 psi,干燥气流速10 L·min-1,TP的检测离子对为m/z 378.1→361.1,内标为m/z 260.0→116.2。TP在定量范围(10~10 000 nmol·L-1)内,线性良好(线性相关系数R2>0.9900),定量下限为10 nmol·L-1,在低、中、高3个浓度下的批内和批间相对标准偏差(RSD)值均<10%,准确度的RE值均在±15%内,提取回收率均>90%。方法满足本研究要求。

CLint,E=Vmax/Km(4)
以TP的浓度为横坐标,其消除速率为纵坐标,应用Graphpad Prism 5软件绘制曲线,得到TP在肝微粒体和重组酶的表观酶动力学参数Km和最大反应速度Vmax,由酶动力学参数经公式4计算得到内在清除率(CLint,E)。
应用Microsoft Excel进行数据和统计学检验分析,采用成组t检验比较组间差异。
2 结果

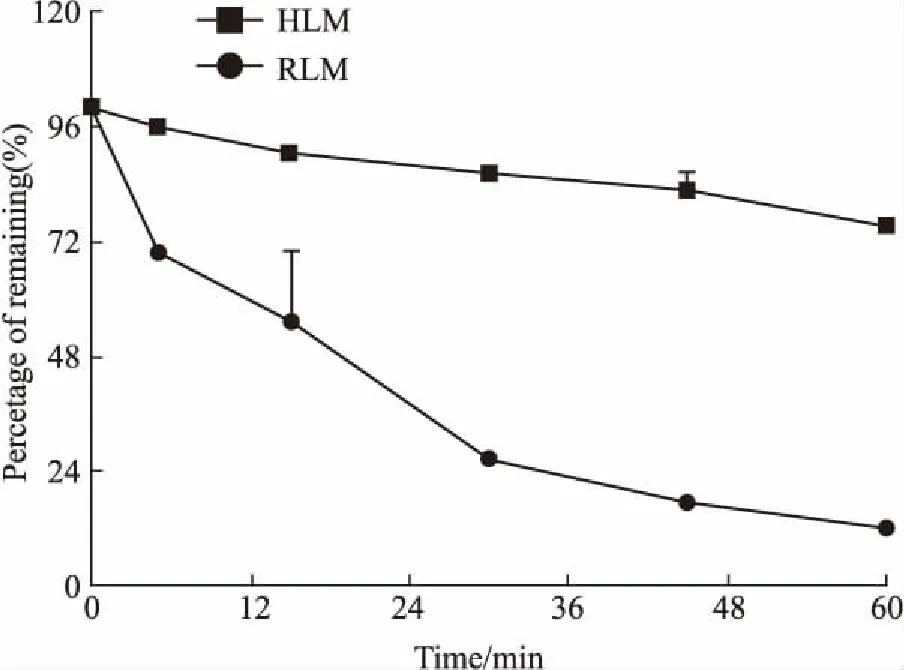
Fig 1 Metabolic elimination of TP in HLM or
*P<0.05 vs HLM

Tab 1 Metabolic clearance parameters of TP
**P<0.01vsHLM
2.2TP在人和大鼠肝微粒体的酶动力学采用底物消除法,考察TP在HLM和RLM的酶促动力学。通过酶蛋白浓度和孵育时间的预实验,确定RLM和HLM的孵育时间分别为5 min和45 min(原药消除约20%);RLM和HLM蛋白浓度分别为0.5、1 g·L-1。应用非线性回归分析方法,拟合TP在人和大鼠肝微粒体的酶动力学曲线,见Fig 2,得到的参数列于Tab 2中。TP在RLM的表观Km和Vmax分别为18.4 μmol·L-1和2 194 pmol·min-1·mg-1,与文献报道结果相符[10]。TP与HLM的表观亲和力(Km=11.2 μmol·L-1)与RLM(Km=18.4 μmol·L-1)相比,有统计学差异(P<0.05),但大鼠的最大反应速率Vmax(139 pmol·min-1·mg-1)远高于HLM(P<0.01);由酶动力学参数得到的两个种属的CLint,E,HLM也明显低于RLM(P<0.01)。

Tab 2 Parameters of enzymatic kinetics of TP
*P<0.05,**P<0.01vsHLM

Fig 2 Reaction rate-substrate concentration curves
2.3TP与重组CYP3A同工酶孵育的酶动力学为了探讨TP人和大鼠肝代谢消除种属差异的可能原因,本研究进一步采用人重组CYP3A4和大鼠重组CYP3A1、3A2同工酶与TP孵育,比较TP在不同CYP3A亚型的酶反应动力学参数。CYP3A4、3A1、3A2的酶动力学曲线见Fig 3,计算得到的酶动力学参数见Tab 3。结果显示,TP在人和大鼠CYP同工酶的亲和力和反应速率差异均具有显著性。TP与大鼠CYP3A1和CYP3A2酶的亲和力明显高于人源CYP3A4酶(P<0.05);在CYP3A1和CYP3A2酶中的反应速率Vmax也更高(P<0.01,P<0.05)。由此得到的内在清除率CLint差异也具有显著性。

Tab 3 Parameters of enzymatic kinetics of TP
*P<0.05,**P<0.01vsCYP3A4

Fig 3 Reaction rate-substrate concentration curves of TP
3 讨论
CYP介导的代谢是TP在肝脏的重要解毒途径[9]。TP在肝脏的代谢消除动力学以及与肝脏CYP酶的酶动力学性质,是比较不同种属肝脏对TP的解毒能力的关键指标,也是实验动物肝代谢与毒理学评价结果向人体外推的重要前提。为此,本研究首先在肝微粒体孵育体系中比较了人与大鼠对TP代谢消除的差异。在0.5 g·L-1的RLM中,TP代谢较快,60 min内代谢消除了87.7%;但在同样蛋白浓度的HLM,TP仅有很少量的代谢(<8%)。将HLM的蛋白浓度提高到1 g·L-1,TP在60 min内的代谢消除仍不到25%,两个种属之间差异有显著性。酶动力学的结果显示,TP与两个种属肝微粒体的表观亲和力稍有差别(1.7倍),但RLM的表观反应速率是HLM的15.8倍,二者有很大的差异,使得TP在两个种属肝微粒体中代谢消除动力学和清除率差异有显著性。
TP在肝微粒体的代谢消除是由多个CYP酶亚型介导的,CYP3A是其主要代谢酶表型[13]。我们的前期研究显示,人CYP3A4酶对TP代谢的贡献率为35%。由于人和大鼠肝脏的CYP3A同工酶亚型和丰度存在差异。人CYP3A包括CYP3A4、3A5、3A7、3A43,其中CYP3A4是成人肝脏主要表达和参与代谢的亚型;大鼠CYP3A亚型包括CYP3A1、3A2、3A9、3A18等亚型,其中CYP3A1/2所占比重最大[14]。为此,我们用重组CYP3A同工酶,进一步比较研究了TP在人CYP3A4和大鼠CYP3A1/2酶孵育体系的酶反应动力学。结果显示,TP与CYP3A1的亲和力最高,其次是3A2;CYP3A1和3A2的Vmax分别是CYP3A4的5.7和4.7倍。TP与人和大鼠CYP3A亚型的亲和力及反应速率差异具有显著性,可能是其在RLM代谢清除明显快于HLM的主要原因之一。
尽管TP在大鼠肝脏的代谢消除较快,但TP长期或高剂量给药仍可导致大鼠严重肝损伤,甚至死亡[8]。本文采用充分搅拌模型(Well Stirred Model)外推公式(2和3)[11],对肝微粒体实验得到的内在清除率进行体外-体内外推,得到大鼠和人的肝清除率CLh分别为(16.7±0.01)、(4.43±0.21)mL·min-1·kg-1,外推得到大鼠的肝清除率约为人肝清除率的3.8倍,提示TP在人肝的代谢消除明显慢于大鼠。已有的研究表明,TP在体内主要经代谢转化消除,尿粪累积排泄率为67.5%[15]。由此可以预测,临床应用时由于人体的TP代谢清除率较低,药物对人肝的毒性和损伤可能会更为严重。由于TP在临床上治疗免疫性疾病时多为长期给药,并有可能与其它药物联合应用,因此,临床应用时最好定期检查患者的肝脏功能,必要时调整剂量,并避免将TP与CYP3A抑制剂合用。
本研究结果显示,TP在大鼠和人肝的代谢清除存在明显差异,提示在将TP的大鼠毒性实验结果外推至人时,应考虑到人和大鼠之间在代谢解毒能力上的种属差异。此外,本研究得到的大鼠和人肝微粒体代谢清除和酶动力学数据,可以进一步用于构建基于生理模型的药代动力学模型,更为准确地预测TP在人体的药代动力学和代谢清除。
