大肠埃希菌外膜囊泡递呈猪瘟病毒E2蛋白的表达及其免疫效果评价
2018-10-11龚永平文继峰颜其贵
黄 杰,龚永平,文继峰,杨 锐,任 露,颜其贵,,*
(1.四川农业大学 动物医学院,四川 成都 611130;2.四川农业大学 动物疫病与人类健康四川省重点实验室,四川 成都 611130)
猪瘟(classical swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)引起的一种高度接触性传染病,被世界动物卫生组织(OIE)列为A类传染病,我国列为一类传染病,可造成养猪业的巨大损失[1-3]。CSFV是黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)的成员,为有囊膜的单股正链RNA病毒[4],该病毒的E2蛋白是一种囊膜糖蛋白,是CSFV诱导被感染动物机体产生主要免疫保护性的抗原蛋白[5],在病毒吸附和入侵宿主细胞中起主要作用,所以常用作疫苗研究和免疫诊断等方面的目标蛋白[6]。
外膜囊泡(outer membrane vesicles,OMVs)是革兰氏阴性菌和部分革兰氏阳性菌以出芽方式分泌的一种球形、双层膜状结构分泌小泡,与所分泌细菌的外膜成分相同,包括脂多糖、外膜蛋白、磷脂等,还包裹有部分周质甚至DNA,形成直径为20~250 nm的颗粒[7-8]。OMVs具备适于被免疫细胞识别的特征,可作为外源大分子抗原的递呈载体[9]。由于OMVs不能复制且含有大量的细菌抗原,具有免疫佐剂效果,并能有效激活免疫系统,因而被认为是极具潜力的候选疫苗或者疫苗载体。在欧洲,脑膜炎奈瑟菌(Neisseriameningitidis)B群OMVs疫苗已经上市,该疫苗的使用大规模地降低了B群奈瑟脑膜炎发病率[10]。此外,OMVs也可作为其他传染性疾病的预防用疫苗[11-12]。
细胞溶素A(cytolysin A,ClyA)是一种细菌外膜上的成孔蛋白,将目的蛋白的核酸序列融合在ClyA基因序列的C-端后,融合的外源蛋白被定位在菌体及其所分泌的OMVs的外膜上,且外源蛋白暴露于囊泡外部,同时起到富集外源蛋白的作用[13-15]。本研究利用基因重组技术,将切除跨膜区后的CSFVE2基因序列连接在ClyA的C-端,通过大肠埃希菌原核表达出含ClyA-E2融合蛋白的OMVs,成功地将E2蛋白融合呈现在OMVs表面,对ClyA-E2 OMVs进行兔体免疫效果评价,为新型CSFV疫苗研究提供思路和基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂
pMD19-T Vector和E.coliDH5α感受态细胞购自TaKaRa公司;表达质粒pBAD18-Cm-ClyA由四川农业大学猪病研究中心曹三杰教授惠赠;包含CSFVE2片段(含跨膜区)的pUC57质粒和CSFV E2蛋白由本实验室提供;Solution Ⅰ购自TaKaRa公司;胶回收试剂盒和质粒小量提取试剂盒均购自OMEGA公司;组氨酸标签单抗和山羊抗鼠HRP-IgG酶标二抗及ECL显色液购自生工生物工程(上海)股份有限公司;猪瘟兔化弱毒疫苗(C株)由四川华神兽用生物制品有限公司提供。
1.1.2 实验动物
实验动物为平均体质量约1 kg的清洁级新西兰大白兔雌兔,购自成都达硕实验动物有限公司。
1.2 方法
1.2.1 引物设计
以CSFVE2基因的pUC57质粒为模板,设计引物:上游5′-TCTAGAATGCGTCTGGCCTGT-3′(单下划线部分为XbaⅠ酶切位点),下游5′-CTACTTCGAAGATTACCACTACCACTACTACAAA TTCTGCAAAATAATCGCT-3′(单下划线部分为HindⅢ酶切位点,虚线为终止密码子,双下划线部分为6个组氨酸的标签序列),PCR扩增出去除E2蛋白跨膜区后的序列及其C-端引入的6个组氨酸的标签序列基因片段,预期扩增长度为1 056 bp。引物均由生工生物工程(上海)股份有限公司合成。
1.2.2 E2-His DNA片段的扩增与克隆
以含CSFVE2基因的pUC57质粒为模板进行PCR扩增,反应程序:98 ℃预变性3 min;98 ℃变性10 s,58 ℃退火10 s,72 ℃延伸1 min,35个循环;72 ℃延伸5 min。1%琼脂糖电泳检测PCR产物,并回收目的片段。
将回收的E2-His片段与pMD19-T Vector连接,转化E.coliDH5α。用质粒小量提取试剂盒提取pMD19-T-E2-His进行单双酶切鉴定,并送生工生物测序。
1.2.3 pBAD18-Cm-ClyA-E2-His原核表达质粒的构建及鉴定
用限制性核酸内切酶XbaⅠ和HindⅢ双酶切pMD19-T-E2-His质粒DNA,1%琼脂糖凝胶回收目的片段,同法酶切pBAD18-Cm-ClyA质粒DNA,回收大片段,将目的片段和大片段用SolutionⅠ进行连接,置16 ℃连接10 h,转化E.coliDH5α感受态细胞,用氯霉素抗性的LB固体培养基筛选,获得含pBAD18-Cm-ClyA-E2-His质粒的重组菌。抽提质粒进行单双酶切鉴定,并送生工生物测序。
1.2.4 重组OMVs的诱导表达、制备与定量
将含重组表达质粒pBAD18-ClyA-E2-His的E.coliDH5α培养至D600为0.5~0.6时,加入终浓度为0.2%阿拉伯糖于30 ℃、160 r·min-1振荡培养20 h进行诱导表达;表达菌液于4 ℃、12 000g离心去除菌体,收集上清液;通过0.45 μL孔径滤膜过滤、100 ku超滤浓缩和超高速离心(4 ℃,125 000g,4 h)处理后,取沉淀溶于200~300 μL PBS液中,即为重组OMVs。将重组OMVs送武汉谷歌生物科技有限公司进行透射电镜观察重组OMVs囊泡。使用BCA蛋白定量试剂盒(BestBio)对重组OMVs进行总蛋白质定量,操作按照试剂盒说明书进行。经定量的重组OMVs于-80 ℃保存备用。
1.2.5 重组OMVs的蛋白酶K与EDTA处理及Western blot分析
取3份重组OMVs,分别经蛋白酶K(终浓度为0.1 mg·mL-1)、EDTA(终浓度为0.1 mol·mL-1)、蛋白酶K和EDTA(终浓度同前)37 ℃处理过夜。以含重组OMVs未经蛋白酶K与EDTA处理的表达菌做对照,将经过处理的重组OMVs样品经10% SDS-PAGE电泳;以25 V、25 min半干转移至硝酸纤维素膜上,用含5%脱脂奶粉封闭液封闭1.5 h;加入His标签单克隆抗体(1∶5 000),4 ℃孵育过夜;TBST洗膜3次,每次5 min,加入二抗HRP-IgG(1∶5 000),常温孵育1.5 h;TBST洗膜3次,每次5 min,加入ECL底物显色液进行显色并曝光拍照。
1.2.6 重组OMVs兔体免疫试验
选取经ELISA方法检测为猪瘟抗体呈阴性的16只平均质量为1 kg的健康新西兰大白兔雌兔,将其随机分为A、B、C、D 4个组,A、B、C组各4只,D组3只。隔离条件下饲养一周后,A组用重组OMV免疫(500 μg·只-1),以PBS稀释;B组用猪瘟兔化弱毒疫苗免疫对照(1 头份·只-1),以疫苗稀释液稀释;C组用E2蛋白免疫对照(500 μg·只-1),以完全和不完全弗氏佐剂乳化;D组用PBS注射作为空白对照(2 mL·只-1)。免疫方式为皮下多点注射,每2周免疫一次,共免疫3次。
1.2.7 间接ELISA检测血清抗体水平
在每次免疫一周后进行耳静脉采血,分离血清。通过间接ELISA方法测定血清抗体效价。以2 μg·mL-1的CSFV E2蛋白包被酶标板,包被量为100 μL·孔-1,4 ℃包被12 h,然后用200 μL TBST缓冲液(含5% BSA)封闭1.5 h;加300 μL·孔-1缓冲液TBST洗涤,洗涤3次,每次5 min;加100 μL经1∶200稀释后的免疫血清,37 ℃孵育1.5 h;加300 μL·孔-1TBST缓冲液洗涤,洗涤3次,每次5 min;加入按1∶6 000稀释的HRP标记的山羊抗兔IgG二抗(100 μL·孔-1),37 ℃孵育1 h;加入ECL底物100 μL·孔-1,避光显色10 min;加入2 mol·L-1硫酸溶液100 μL·孔-1,终止反应并测定D450值。D450值≥0.328判为阳性,D450值≤0.271判为阴性,二者之间为可疑值,需重新测定。
1.2.8 兔体攻毒保护试验
三免后2周进行攻毒试验,每只兔子耳缘静脉注射50头份的猪瘟兔化弱毒疫苗,攻毒后每6 h测一次体温,共测96 h,并评定各免疫组在免疫保护方面的差异性。
2 结果与分析
2.1 E2-His DNA片段的PCR扩增及电泳鉴定
以含CSFVE2基因的pUC57质粒为模板进行PCR扩增后,1%琼脂糖凝胶电泳检查,结果显示在约1 056 bp处有一条带,与预期大小符合,如图1所示。
2.2 克隆质粒pMD19-T-E2-His的鉴定
用限制性内切酶XbaⅠ和HindⅢ对质粒pMD19-T-E2-His进行单酶切和双酶切,然后用1%琼脂糖凝胶电泳鉴定,在相应泳道上均出现与预期大小相符的目的条带,如图2所示。序列测定分析显示,重组片段无任何碱基突变,表明重组质粒构建成功。
2.3 原核表达质粒pBAD18-Cm-ClyA-E2-His的鉴定
用限制性内切酶XbaⅠ和HindⅢ对质粒pBAD18-Cm-ClyA-E2-His进行单酶切和双酶切,然后用1%琼脂糖凝胶电泳鉴定,在相应泳道上均出现与预期大小相符的目的条带,如图3所示。序列测定分析显示,重组片段无任何碱基突变,表明重组质粒构建成功。

M,DL2000 DNA marker;1,E2-His DNA片段;2,阴性对照。M, DL2000 DNA marker; 1, E2-His DNA fragment; 2, Negative control.图1 E2-His DNA片段的PCR扩增结果Fig.1 E2-His DNA fragment amplified by PCR

M,DL10 000 DNA marker;1,pMD19-T-E2-His质粒的XbaⅠ单酶切;2,pMD19-T-E2-His质粒的XbaⅠ和HindⅢ双酶切。M, DL10 000 DNA marker; 1, Single digestion of pMD19-T-E2-His plasmid with XbaⅠ; 2, Double digestion of pMD19-T-E2-His plasmid with XbaⅠ and HindⅢ.图2 克隆质粒pMD19-T-E2-His的酶切结果Fig.2 Results of restriction enzyme of clone plasmid of pMD19-T-E2-His

M,DL10 000 DNA marker;1,pBAD18-ClyA-E2-His质粒的XbaⅠ单酶切;2,pBAD18-ClyA-E2-His质粒的XbaⅠ和HindⅢ双酶切。M, DL10 000 DNA marker; 1, Single digestion of pBAD18-ClyA-E2-His plasmid with XbaⅠ; 2, Double digestion of pBAD18-ClyA-E2-His plasmid with XbaⅠ and HindⅢ.图3 原核表达质粒pBAD18-ClyA-E2-His的酶切结果Fig.3 Results of restriction enzyme of prokaryotic expression plasmid of pBAD18-ClyA-E2-His
2.4 重组蛋白在OMVs上的表达
经SDS-PAGE显示,含重组表达质粒pBAD18-Cm-ClyA-E2-His的大肠埃希菌经过0.2%阿拉伯糖诱导后与空载菌相比较,约在72 ku处出现了目的条带。同样地,含重组蛋白的OMVs与空OMVs相比较,约在72 ku处出现了一条目的条带(图4)。
2.5 重组蛋白Western blot分析
Western blot分析显示,2%阿拉伯糖诱导的重组菌和含重组蛋白的OMVs在约72 ku处出现了特异性的目的条带,而2%阿拉伯糖诱导的空载菌和空OMVs则没有。同时,为了验证重组蛋白递呈在OMVs的外表面,将重组OMVs分别或同时用蛋白酶K和EDTA处理。Western blot结果显示,分别用蛋白酶K、蛋白酶K/EDTA处理后的重组OMVs没有出现任何条带,而EDTA处理后出现了目的条带,如图5所示。
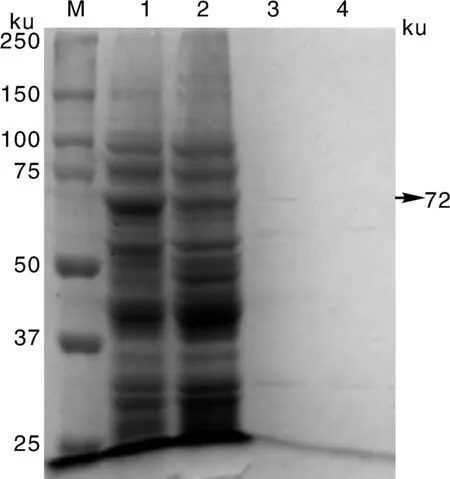
M,预染蛋白质marker;1,0.2%阿拉伯糖诱导后的重组菌;2,0.2%阿拉伯糖诱导后的空载菌;3,重组OMVs;4,空OMVs。M, Pre-stained protein marker; 1, Recombinant bacteria induced with 0.2% arabinose; 2, Empty bacteria induced with 0.2% arabinose; 3, Recombinant OMVs; 4, Empty OMVs.图4 重组蛋白的表达Fig.4 Expression of recombinant protein
2.6 呈递E2蛋白的重组OMVs的透射电镜观察
呈递E2蛋白的重组OMVs通过透射电镜观察可见大小20~250 nm的圆形膜状结构(图6)。
2.7 间接ELISA检测免疫家兔血清抗体水平
对每次免疫7 d后的家兔进行耳缘静脉采血,分离血清进行间接ELISA方法检测。结果显示,重组OMVs组首免后7 d,抗体水平与猪瘟疫苗组和E2蛋白质组差异都不明显(P>0.05);二免后7 d,三组抗体水平均迅速上升,重组OMVs组低于猪瘟疫苗组(P>0.05),比E2蛋白质组高,差异显著(P<0.05);三免后7 d,重组OMVs组抗体水平略低于猪瘟疫苗组(P>0.05),高于E2蛋白质组(P<0.05)。结果表明,OMVs-E2比猪瘟弱毒疫苗和E2蛋白质更快速地刺激并诱导机体产生免疫应答,比E2蛋白质更能刺激机体产生高水平的抗体(表1)。

M,预染蛋白质marker;1,0.2%阿拉伯糖诱导后的重组菌;2,0.2%阿拉伯糖诱导后的空载菌;3,重组OMVs;4,空OMVs;5,蛋白酶K处理的重组OMVs;6,EDTA处理的重组OMVs;7,蛋白酶K和EDTA同时处理的重组OMVs。M, Pre-stained protein marker; 1, Recombinant bacteria induced with 0.2% arabinose; 2, Empty bacteria induced with 0.2% arabinose; 3, Recombinant OMVs; 4, Empty OMVs; 5, Recombinant OMVs dealt with proteinase K; 6, Recombinant OMVs dealt with EDTA; 7, Recombinant OMVs dealt with proteinase K and EDTA simultaneously.图5 重组蛋白的Western blot分析结果Fig.5 Western blot analysis of recombinant protein

图6 呈递重组蛋白的重组OMVs的透射电镜观察Fig.6 Transmission electron microscopy of recombinant outer envelope vesicles presented of recombinant protein
2.8 兔体免疫保护效果评价
用兔化CSFV C株攻毒前一天,各组兔体的体温均在正常范围内(39.0~39.5 ℃)。PBS组两只实验兔在攻毒24 h后体温开始上升,均先后出现定型热反应,在48 h后体温最高的达41 ℃,以后逐渐下降至72 h恢复到正常体温。猪瘟兔化弱毒疫苗组、重组OMVs组和E2蛋白质组在36 h后出现轻热反应,但很快恢复正常体温(图7),说明OMVs呈递的E2蛋白能产生很好的保护效果。
表1重组OMVs免疫家兔不同时间后血清中特异性抗体水平
Table1Specific antibody level in rabbit serum detected by recombinant OMVs

组别Group免疫后不同时间兔体血清抗体水平Antibody level at different time after immunization in rabbit serum一免前7天7 days before thefirst immunization一免后第7天7 days after thefirst immunization二免后第7天7 days after thesecond immunization三免后第7天7 days after thethird immunization重组OMVs组Recombinant OMVs group0.139±0.0680.454±0.0630.949±0.1021.140±0.132猪瘟疫苗组Classical swine fever vaccine group0.157±0.0780.336±0.0081.042±0.0681.239±0.098E2蛋白质组E2 protein group0.162±0.0620.384±0.0360.767±0.0901.068±0.047PBS组PBS group0.175±0.0400.154±0.0090.192±0.0430.190±0.033

图7 兔体温变化曲线Fig.7 Rabbit body temperature curve
3 讨论
CSFV E2蛋白属于真核表达蛋白,利用原核表达系统表达的E2蛋白多为包涵体且表达量较少。本实验以包含按照大肠埃希菌密码子偏嗜性进行密码子优化后的E2基因的pUC57质粒为模板(本实验室保存),设计引物,利用PCR成功扩增了去除E2蛋白跨膜区后的DNA片段,并在其C-端引入了编码6个His的碱基序列(TACCACTACCACTACTAC)。通过构建的表达质粒获得了含去除跨膜区后的E2蛋白的重组OMVs。Western blot结果证明,重组蛋白和重组OMVs能特异地与His标签单抗结合,而经过蛋白酶K处理后的重组OMVs不能与His标签单抗结合,鉴于蛋白酶K只能破坏OMVs外表面的蛋白,而EDTA只能破坏OMVs的膜结构,说明重组E2蛋白递呈在OMVs的外表面[16]。同时,重组OMVs免疫印迹和SDS-PAGE条带较细,说明OMVs上递呈的E2蛋白量较全菌表达的量少。
兔体免疫试验表明,一免后重组OMVs比E2蛋白组和猪瘟疫苗能更快更强地刺激机体产生特异性抗体;二免后重组OMVs组上升较猪瘟疫苗组慢,比E2蛋白组快;但在三免后重组OMVs组和猪瘟疫苗组抗体上升较E2蛋白组慢,可能因为兔体内高水平的抗体干扰所导致。为了分析其免疫保护效果,在兔体上进行了免疫攻毒试验。CSFV弱毒C株是在家兔上反复传代致弱而得到的,对猪只有良好的安全性和免疫效力,但对家兔有一定的致病性,可以使其产生定型热反应[17]。本实验用家兔作为动物模型评价重组OMVs的免疫效果[18-19],发现兔体注射高剂量CSFV弱毒株C株后,PBS组的兔子出现明显的定型热反应,而重组OMVs组的兔体温只在攻毒后24 h出现轻微的热反应,但在12 h后恢复正常。综上,大肠埃希菌OMVs具有很好的免疫佐剂效应,为研究大肠埃希菌分泌的OMVs作为病毒性蛋白递呈载体提供了一定的理论依据,这将为CSF新型亚单位疫苗的研究提供新的思路和方向。
