胰岛素样生长因子-1对氧化损伤精子的保护作用
2018-10-11刘文静李月梅张荣玲高建军
刘文静 李月梅 王 磊 张荣玲 高建军
山东省潍坊市妇幼保健院 (潍坊 261011)
活性氧(reactive oxygen species,ROS)是指化学性质活泼、氧化能力很强的一类含氧物质,主要包括H2O2、羟基(-OH)、活性氮类(NO)等。过量的ROS引起的氧化应激损伤是导致男性不育的重要病因[1],导致ROS产生过多的因素包括吸烟、生殖道感染、精索静脉曲张、环境污染物以及实验室精液处理等。研究证实,过量ROS会导致精子膜、线粒体及核DNA受损,使精子运动功能改变,并导致受精能力下降[2,3]。因此寻找有效的抗氧化物质,降低ROS造成的氧化损伤成为目前男性不育的研究热点。
胰岛素样生长因子-1(IGF-1)具有促进有丝分裂、抗细胞凋亡等胰岛素样生物学效应,涉及生殖细胞的生长发育过程。许多报道显示IGF-1具有抗氧化、抗细胞凋亡的作用[4,5],但是IGF-1对精子氧化损伤时产生的作用目前鲜有报道。本研究旨在观察IGF-1对人精子体外氧化损伤时产生的作用。
材料与方法
一、材料
收集2015年1月至5月来潍坊市妇幼保健院生殖健康科查体的健康且有生育力的男性精液28例(志愿者),按照第5版《世界卫生组织人类精液检查与处理实验室手册》[6](以下简称第5版《WHO》)进行检测。纳入标准:液化时间在60min内,精子浓度>60×106/mL,精子前向运动率(PR)>32%,精液体积>1.5 mL,正常形态精子比率>4%,白细胞浓度<1×106/mL。本实验通过本院伦理委员会审查,并与志愿者签署知情同意书。
二、主要试剂与仪器
IGF-1购自美国PeproTech公司;Diff-Quik试剂盒购自深圳华康生物医学工程有限公司;DNA碎片率检测试剂盒购自深圳博锐德生物科技有限公司;丙二醛(MDA)试剂盒由南京建成生物工程研究所提供;精子培养液SpermRinse购自瑞士vitrolife公司;计算机辅助精子分析系统(CASA)使用清华同方精子分析仪。
三、精子悬液制备
男方禁欲3~7 d,手淫法留取精液。待精液充分液化后采用直接上游法处理精液:取精液1.5mL加入试管底部,在其上方缓慢加入等体积的培养液SpermRinse,将试管倾斜45°。于37℃培养箱放置30 min, 轻轻吸取上层云雾状液体,300×g,离心5 min,弃上清,加入培养液,将精子浓度调整为10×106/mL。
四、实验分组
每例精子悬液平均分成4份,实验分为4组。对照组:仅精子悬液;H2O2组:精子悬液+100μmol/L H2O2;25ng/mL IGF-1组:精子悬液+25ng/mL IGF-1+100μmol/L H2O2;50ng/mLIGF-1组:精子悬液+50ng/mL IGF-1+100μmol/L H2O2。各组样本置37℃,5% CO2培养箱中孵育,分别于12 h、24 h后进行各项检测。
五、检测指标
(一)精子活力检测
于培养后12 h及24 h,按照第5版《WHO》标准,采用CASA分析对各组精子进行活力检测,记录各组精子活力、PR。
(二) 精子形态学分析
将各组精子悬液涂片,自然晾干后,采用Diff-Quik染色法进行染色,按第5版《WHO》严格标准法进行判别,计数正常形态及畸形精子,记录各组正常形态精子比率。
(三)精子DNA碎片率的检测
按照试剂盒说明书,采用精子染色质扩散法检测精子DNA碎片率。(1)精液标本处理:取出精子悬液60μL加入已熔化的易熔凝胶管中,充分混匀;加30μL精子凝胶混合液于预先处理的载玻片上,迅速盖上盖玻片, 置于2~8℃冰箱5 min,使其凝固。(2)变性处理:从冰箱中取出载玻片,小心移去盖片。将载玻片浸入反应液A内,20~28℃反应7 min, 然后于反应液B内20~28℃反应25 min, 再将载玻片浸入大量的纯化水中5 min;(3)脱水、干燥、染色:将载玻片依次放入70%、90%和100%乙醇中脱水各2 min。空气中自然干燥后以瑞氏染液染色,室温15min后用流水轻轻冲洗染片;(4)光学显微镜观察:普通光学显微镜高倍镜下观察500个精子,计数存在DNA碎片率的精子数量。
(四)MDA的检测
采用硫巴比妥酸法(TBA)检测精子脂质过氧化产物MDA,按试剂盒说明书操作方法测定MDA含量,用分光光度计读取吸光度值,根据精子浓度平衡后的MDA值以nmol/109精子表示。
六、统计学分析
结 果
一、各组精子活力比较
在培养后12h及24h,与H2O2组比较,对照组活力及PR均显著升高,差异有统计学意义(P<0.01);在培养后12h及24h 50ng/mL IGF-1组与H2O2组比较,活力和PR均有提高,差异均有统计学意义(P<0.05,P<0.01);另外,在培养后24 h,25ng/mL IGF-1组PR较H2O2组明显升高,差异有统计学意义(P<0.05),见表1。
二、各组正常形态精子比率、DNA碎片率比较
在培养后12h及24h,各组间正常形态精子比率差异无统计学意义(P>0.05)。在培养后12h及24h,与H2O2组比较,对照组及50ng/mL IGF-1组DNA碎片率显著降低,差异有统计学意义(P<0.01,P<0.05);在培养后24 h,25ng/mL IGF-1组DNA碎片率较H2O2组明显降低,差异有统计学意义(P<0.05),见表2。
三、 各组精子MDA水平比较
在培养后12 h及24 h,对照组MDA水平较H2O2组显著降低,差异有统计学意义(P<0.05,P<0.01);50ng/mL IGF-1组与H2O2组比较,50ng/mL IGF-1组MDA水平降低,差异有统计学意义(P<0.05)。另外,培养后24 h,25ng/mL IGF-1组与H2O2组比较,25ng/mL IGF-1组MDA水平降低,差异有统计学意义(P<0.05),见表3。
表1 各组精子活力及PR比较(±s)

表1 各组精子活力及PR比较(±s)
与H2O2组比较,*P<0.05,** P<0.01
PR(%)12h 24h 12h 24h对照组 87.43±2.93** 73.47±5.89** 81.75±3.63** 59.53±5.58**H2O2组 80.27±4.87 59.28±6.57 70.63±5.19 45.51±7.78 25ng/mL IGF-1组 83.08±3.76 62.93±5.43 72.81±4.94 51.47±5.83*50ng/mL IGF-1组 86.35±2.42* 72.14±4.97** 76.57±4.43* 56.13±4.69**组别 活力(%)
表2 各组正常形态精子比率、DNA碎片率比较(±s)

表2 各组正常形态精子比率、DNA碎片率比较(±s)
与H2O2组比较,*P<0.05, ** P<0.01
组别 正常形态精子比率(%) DNA碎片率(%)12h 24h 12h 24h对照组 11.05±3.41 11.56±3.04 4.73±1.15* 8.26±1.72**H2O2组 10.68±2.64 10.56±2.48 6.14±1.38 13.63±2.05 25ng/mL IGF-1组 10.42±2.26 11.14±2.73 5.78±1.66 11.71±1.69*50ng/mL IGF-1组 10.86±3.29 10.67±2.50 5.27±1.43* 10.45±1.87**
表3 各组精子MDA水平比较(±s)
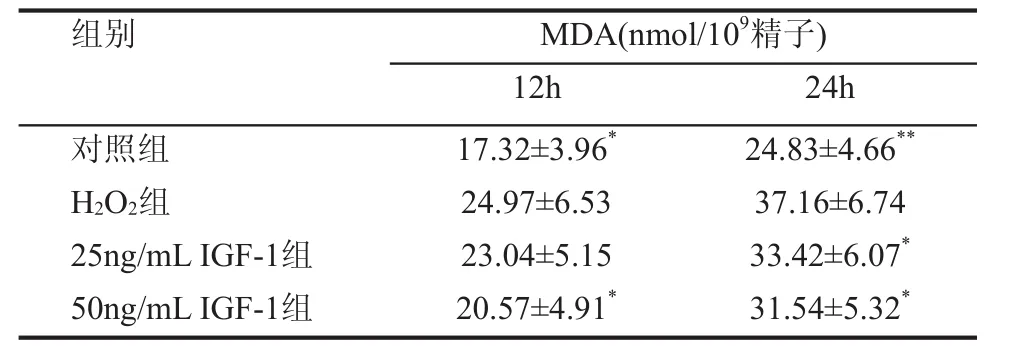
表3 各组精子MDA水平比较(±s)
与H2O2组比较,*P<0.05, **P<0.01
组别 MDA(nmol/109精子)12h 24h对照组 17.32±3.96* 24.83±4.66**H2O2组 24.97±6.53 37.16±6.74 25ng/mL IGF-1组 23.04±5.15 33.42±6.07*50ng/mL IGF-1组 20.57±4.91* 31.54±5.32*
讨 论
越来越多的研究表明IGF-1对睾丸功能起着重要的调节作用,IGF-1通过旁分泌/自分泌调节睾丸的发育和功能。IGF-1缺陷可导致Leydig细胞体积和数量减少,睾酮水平下降及精子数量减少[7]。研究显示IGF-1受体存在于精原细胞、精母细胞及精子中,IGF-1可能对精子的产生、成熟及活力发挥着重要的作用[8]。研究发现IGF-1对低温培养及冷冻保存的精子有保护作用[9,10],因此IGF-1对精子氧化损伤时产生的作用是一个值得探讨的问题。
活性氧(ROS)能引起精子细胞膜的脂质过氧化,并且损伤精子线粒体从而导致精子活动力下降[11]。本研究显示,在培养后12 h及24 h ,H2O2组的精子前向运动百分比及活力较对照组均下降,且差异有统计学意义,说明ROS导致精子运动能力下降。50ng/mL IGF-1组的精子活力及前向运动百分比较H2O2组均显著上升(P<0.05),提示适当浓度的IGF-1能明显降低ROS对精子运动能力的损伤。
本研究中,在培养后12 h及24 h ,各组间正常形态精子比率差异无统计学意义。精子在生成过程中经过一系列的变化而形成了精子特定的形态,因此精子形态是经过一定时间和复杂的变化而形成的,在短时间内,ROS介导的过氧化反应并未引起精子形态的明显改变。但H2O2会造成精子超微结构的哪些改变以及IGF-1对此结构损伤是否有改善作用还需进一步研究。
精子DNA完整性对精卵结合和胚胎发育具有重要意义,与辅助生殖技术也密切相关,DNA完整性的破坏可从精子浓度、活力及受精能力等各方面影响精子。研究证实,氧化应激是造成精子DNA损伤的主要原因,DNA碱基对氧化应激敏感,活性氧自由基能与其反应引起碱基修饰、DNA链断裂以及染色质交联[12]。本研究采用精子染色质扩散试验检测精子DNA碎片率,结果显示,H2O2组精子DNA碎片率较对照组均明显升高,25ng/mL IGF-1组在培养后24 h、50ng/mL IGF-1组在培养后12 h及24 h DNA碎片率较H2O2组均明显下降,提示IGF-1能在一定程度上抑制ROS对精子DNA的损伤,保护精子DNA的完整性。
MDA是ROS攻击精子细胞膜产生的主要脂质过氧化产物,MDA的水平可间接反映ROS对精子的损害程度。有报道IGF-1能够提高超氧化物歧化酶(SOD)含量,降低MDA水平,具有一定的抗自由基的作用[4,5]。本研究结果显示50ng/mL IGF-1组MDA水平明显低于H2O2组,说明IGF-1可以降低ROS引起的精子脂质过氧化反应,从而保护精子的运动功能,降低精子的DNA损伤。
无论是精子活力还是DNA碎片率各组间比较,均显示50ng/mL IGF-1组具有明显的保护作用。本研究显示,IGF-1对活性氧导致的精子运动功能下降及DNA损伤具有一定的保护作用,为IGF-1在男性不育中的应用提供了理论依据,其作用机制有待进一步研究。
