培养学科核心素养的教学实践研究
——以“原电池工作原理”教学为例
2018-10-10朱将娥南俊民
朱将娥 南俊民
(1.华南师范大学化学与环境学院 510006;2.广东省惠州市第八中学 516001)
一、教学思路
1.设计理念
原电池工作原理是高中阶段学习化学反应原理的典型代表.在本节的教学中,原电池构成条件判断、正负极判断、电极式书写、设计原电池和双液电池是学习的要点.
2.教材分析
“原电池工作原理”是鲁科版化学选修4《化学反应原理》第1章第3节内容,前两节依次为“化学反应的热效应”和“电能转化为化学能——电解”.教材以“能量转化”为主线,先定量描述化学反应的热效应,再通过电解和电池介绍电能与化学能相互转化的具体形式.第3节 “化学能转化为电能——电池”包含3个部分:原电池工作原理、化学电源和金属的腐蚀与防护.其中,“原电池工作原理”是本节教学的重点.
二、教学设计和实践
1. 回顾化学反应与能量变化知识判断原电池,培养变化观念与平衡思想
学生在必修课阶段学习能量变化,主要是了解化学能与其他能量(热能、电能和光能)的转化,并且遵循能量守恒定律.其中原电池是将化学能转化为电能的装置.这些知识因只作过简单介绍,往往使学生对这些内容印象不深,再加上前一节刚学习了电能转化为化学能的装置——电解池,对本节知识学习容易造成混淆,为此设计了如下的学习任务1.
学习任务1 :原电池中涉及的能量变化及其构成条件
师:(演示实验)①将锌片插入硫酸铜溶液;②将锌片与铜片一起插入硫酸铜溶液;③将锌片与铜片用导线连接后插入硫酸铜溶液.问:请描述这三个实验的现象,分别涉及哪些能量的转化?生:①锌片表面有红色固体附着,化学能转化为热能;②锌片表面有红色固体附着,铜片表面无明显变化,化学能转化为热能;③锌片逐渐溶解,铜片变厚,化学能转化为电能.师:实验③中化学能转化为电能,它通过定量的一个反应源源不断地提供电能吗?为什么?生:不能.这不符合能量守恒原理.师:根据实验回顾,构成原电池的条件有哪些? 生:(多个学生回答综合)构成条件包括闭合回路、活泼性不同的两个电极、电解质溶液和能自发进行的氧化还原反应.师:呈现热化学方程式:

ΔH=-216.81 KJ·mol-1

ΔH=216.81KJ·mol-1
提出问题:为什么在这个原电池中,Zn与CuSO4溶液能反应放电,而逆向反应不能放电呢?
生:通常情况下,Zn与CuSO4溶液反应是化学能转化为热能,在原电池中是化学能转化为电能,而逆向反应在能量变化中不能自发进行.
设计意图:演示实验能激发学习欲望,学生感知实验中同一个化学反应既能由化学能转化为热能,又能由化学能转化为电能,培养学生变化观念.在原电池形成条件中通过补充热化学方程式,从理论上提供了能量转化的依据;实验③说明一个定量的化学反应不能源源不断提供能量,热化学方程式中焓变数据为定值都能让快速回顾能量守恒定律相关知识,培养平衡思想.
2.巧设问题链判断原电池正负极,培养宏观辨识与微观探析能力
学习任务2:从宏观、微观角度判断原电池正负极
师:将刚才演示实验③中的铜-锌-硫酸铜原电池接上检流计,问:电流流向?哪一极为正极、哪一极为负极?生:从铜电极流向锌电极;铜电极为正极,锌电极为负极.师:我们一起观察分析该原电池,从宏观上可以通过哪些直观现象判断原电池的正负极呢?生:(多个学生回答综合)化学反应类型方面,发生氧化反应的一极为负极;电极材料方面,通常较活泼的一极为负极;电极质量方面,质量会减少的一极为负极.师:将该原电池的电解液硫酸铜溶液换成稀硫酸,引导学生找出与上述不同的现象并判断正负极.生:该原电池中铜电极表面有气泡产生,所以电极反应中若有气泡冒出的一极为正极.师:投影出镁-铝-氢氧化钠溶液原电池,请同学们继续分析该原电池的正负极.生1:镁较活泼,镁电极为负极.生2:镁电极表面有气泡产生,故镁电极为正极.师:以上两位同学的说法都有依据,究竟个答案是正确的呢?请同学们从微观角度分析.生:在这个原电池中,事实上是铝与氢氧化钠发生反应,铝元素失电子发生氧化反应,故铝电极为负极,镁电极为正极.师:原电池的正负极判断中,哪种判断依据是适用于各类型原电池的呢?生:从宏观上发生氧化反应或还原反应的电极判断,或从微观上得失电子角度判断正负极是适用于各类型原电池的.
设计意图:宏观上辨识原电池正负极有多种方法,引导学生从多角度辨识原电池正负极,培养学生的宏观辨识能力.通过镁-铝-氢氧化钠溶液原电池正负极的分析,让学生自相矛盾,自己区分正负极判断依据并非全部适用于各类原电池,能培养学生辨证能力,再从微观(得失电子)角度探析原电池正负极,并归纳出适用各类原电池正负极判断依据,培养学生宏观辨识与微观探析能力.
3.书写电极反应式,培养证据推理与模型认知能力
在 “电解池”一节中,学生已经学习过电极反应式的书写,联系两者,均是形成闭合回路,通过电子、离子移向模型推断电极反应式的书写.但是“电解池”中有电源,电源的正负极对应阴阳极,电极反应式相对较易推导出;原电池得先判断正负极,并判断得失电子的物质,才有可能书写电极反应式.因此,设计了如下的学习任务3.

学习任务3:通过原电池模型,推断电极反应式的书写
师:投影铜锌硫酸铜原电池实验装置模型图(图1).
我们已经知道:宏观上,该原电池的现象是锌片逐渐溶解,铜片变厚;微观上,Zn失电子, Cu2+得电子.那么,该如何书写该原电池两极的电极反应式呢?
生:书写负、正极电极反应式.


生:从氧化还原反应的角度拆分,若书写电极反应式,可以将电池反应式画出双线桥,然后将双线桥分成两部分,每一条桥写成一个半反应,就是电极反应式了.
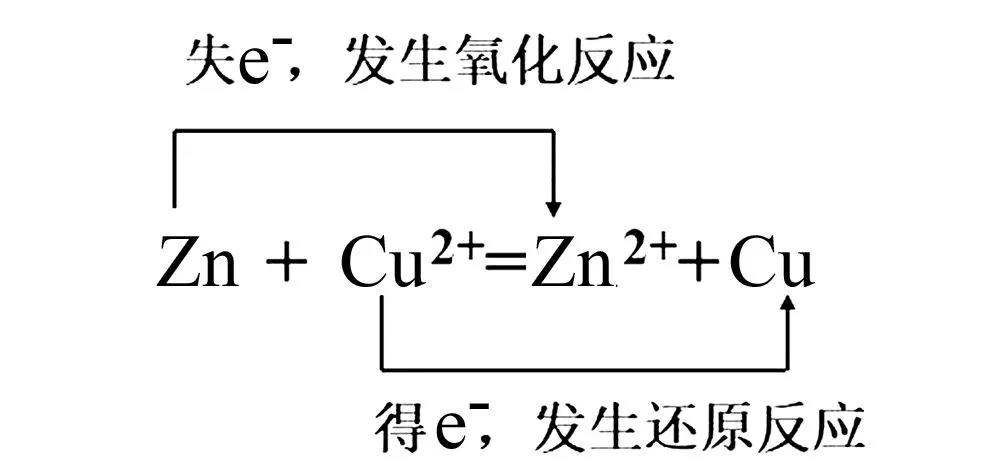


设计意图:化学学习最重要的是需要将知识运用化学符号表达出来.在原电池电极反应式书写过程中,通过建立宏观的原电池模型,引领学生对原电池电子流向的微观探析,便于形成立体思路,能帮助学生提取有效信息,以电极反应式的形式进行化学符号表达.引导学生依据氧化还原反应双线桥分析元素得、失电子,从已知的知识推理出正、负极电极反应式,培养学生证据推理能力,同时解决本节难点.
4.设计原电池分组实验,培养实验探究与创新意识
在学习了原电池构成条件、正负极判断、电极反应式书写后,学生有能力进行相关原电池的设计和分组实验.为此,把设计原电池并进行分组实验作为本次教学的学习任务4.
学习任务4:设计原电池并进行分组实验
师:提供实验仪器和药品:铁片、铜片、石墨棒、检流计(G)、导线、大烧杯、FeCl3溶液,请学生按小组选择上述仪器和药品设计成一个原电池并进行实验.


生:设计原电池,书写正负极电极反应式.
设计意图:设计两组实验,其中第一组是提供仪器和药品,让学生设计原电池,培养学生实验探究能力.第二组是只给出原电池总反应式,要求学生设计电极材料及电解质溶液,不同的学生会选取不同的电极材料,给学生创新的空间,培养创新意识.
5.从能量转换效率出发学习双液电池,培养科学精神与社会责任
理论只有联系了实际才能为我们所用.简单的单液原电池不能提供稳定电流,只有将实际应用中遇到的问题解决,才能掌握原电池的原理,这将通过如下的学习任务5来实现.
学习任务5:了解盐桥,学习双液电池
师:我们前面所进行的是简单的单液原电池设计和实验,事实上,这类原电池不能长时稳定供电.细心的同学会发现,演示实验③的原电池中负极锌片上也有红色物质附着,这是为什么?请小组讨论并代表发表观点.生:我们小组认为,锌直接置换出单质铜并附着于表面.师:怎么证明你们的观点?生:思考、讨论、回答.首先锌与硫酸铜溶液直接接触,部分锌失去电子可能不经外电路而直接传递给溶液中的Cu2+,生成单质铜.这里的能量变化主要是化学能转化为热能,可以使用温度计测量溶液中的温度变化确定.所以这部分本来可以转化为电能的化学能却转化成了热能,造成能源浪费.师:要避免这种情况发生,只能将锌片与硫酸铜溶液分离,这样原电池就会断路,解决此问题的方式就是使用盐桥.生:了解盐桥的制备方法和使用说明,学习双液电池.
设计意图:学生自行观察实验发现单液电池的弊端,思考并寻找解决该弊端的方法,培养将化学成果应用于生产生活的意识,依据实际条件运用化学知识解决生产生活中的化学问题.通过单液电池部分化学能转化成热能造成浪费的角度,让学生明白化学服务于社会过程中要尽量避免浪费.这是培养学生科学精神和社会责任感的良好契机.
三、实践教学反思与讨论
本教学过程是“原电池工作原理”完整一课时的课堂实录.教学设计主要有原电池构成条件判断、正负极判断、电极式书写、设计原电池以及双液电池的学习五个部分.对比教学设计与教学实践,以下几个方面需要引起特别关注.
首先,在原电池构成条件判断中,可添加热化学方程式说明电势差是原电池构成条件.学生判断Zn与CuSO4溶液反应是化学能转化为热能,同时,推理该反应也能是化学能转化为电能的过程,是培养学生“证据推理”能力的好方式.
其次,电极反应式是原电池工作原理的重点,在书写电极反应式教学过程中,可采用“宏-微-符”表征的方式.电极反应式作为一种化学符号,能够通过原电池的宏观现象揭示微粒的微妙变化,结合实验装置模型,联系氧化还原反应双线桥法,达到培养证据推理与模型认知能力的目标.
再者,在双液电池的学习中,关于培养科学精神与社会责任方面体现的不够明显,需要引起特别注意.教师可以设计拓展实验,让学生课余时间使用水果、铜丝、铁丝、棉布等常见材料设计双液电池.另外,课后可以收集一些废旧电池带到学校,分析废旧电池工作原理,同时引导学生不乱丢废电池,保护环境,这样让学生在课外也能培养社会责任.
发展学生核心素养的“核心”是促进人的全面发展,根本目的是“使教育转向人、聚焦人、发展人”.我国还主要处于对核心素养的理论研究上,对学生发展核心素养研究的实践很少,对化学学科核心素养的研究更少.一线教师多学习理论,将理论联系教学实践促进学生发展核心素养显得尤为迫切.
