下丘脑室旁核中CART 55-102在创伤应激诱导的大鼠饮酒行为中的作用
2018-10-10李晓健
刘 婕 李晓健 肇 晖
(复旦大学基础医学院中西医结合系 上海 200032)
酒精滥用是继心脑血管疾病和癌症之后第3大影响人类健康的公共卫生问题。研究显示,酒精滥用不仅破坏肝脏、胃肠道和胰腺等多种器官的功能,而且对中枢神经系统造成极大损伤,影响睡眠,降低记忆力[1]。青春期神经系统发育尚未成熟,多种神经递质及激素仍处于持续变化中,机体对酒精的药理作用有独特的敏感性[2],对酒精的厌恶反应较弱[3]。如何有效地抑制青春期的饮酒行为已成为医学界的热门话题。
应激是导致酒精滥用的危险性因素,如束缚应激、强迫游泳、足底电击等[4]。创伤是一种常见的应激源,50%~70%的个体在一生中至少会经历1次创伤应激[5]。我们的前期研究发现创伤应激会抑制机体的免疫系统[6],还有研究指出免疫炎症可以引发酒精滥用行为[7-8]。那么,创伤应激是否会诱导饮酒行为呢?
可卡因安非他明调节转录因子(cocaine-and-amphetamine-regulated transcript,CART)于1995年由Douglass等[9]在急性注射可卡因和安非他明的大鼠纹状体中首次发现。而后发现CART编码的肽有129或116个氨基酸两种形式,其中包括27个氨基酸的前导区序列(pro-peptide sequence),所以成熟的CART肽含有102个或89个氨基酸[9]。1999年,Kuhar等[10]确认并分离出两种主要的活性肽片段:CART 55-102和CART 62-102。有研究指出CART 55-102可以参与调控饮食、能量代谢、稳态调控、药物成瘾等多种生物学过程[11]。CART最初在管理可卡因和安非他明中被发现,而后越来越多的报道证明其在其他精神兴奋性药物(如吗啡、酒精)管理中的调节作用[12-14]。然而,对于CART 55-102在创伤模型中饮酒行为的研究却十分有限。
应激反应往往伴随着下丘脑-垂体-肾上腺(hypothalamus-pituitary-adrenal,HPA)轴的激活[15-16]。CART 55-102作为一种神经递质类的活性肽,广泛分布于HPA轴3个水平上[17]。下丘脑室旁核(hypothalamic paraventricular nucleus,PVN)作为HPA轴的起始位点,参与对多种应激反应的调控,如足底电击[18]、束缚应激[19]、慢性可变应激[20]等。本研究旨在探讨PVN中CART 55-102是否参与创伤应激对饮酒行为的调控。
材 料 和 方 法
实验动物青春期雄性SD大鼠(PND 33)购自上海斯莱克实验动物中心。室温(23±1)℃,湿度 50%±5%,光照强度(200±50)lx,每天12 h (7:00/19:00)明暗交替,自由摄食摄水。所有操作处理均符合复旦大学动物和国际实验动物使用准则。
药品与试剂兔抗-CART 55-102 多克隆抗体(德国菲尼克斯医药公司,批号H-003-62),CART 55-102 (美国R&D公司,批号3337)。
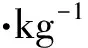
血药浓度测试在饮酒行为测试结束后,动物立即被断头处死。收集血液并离心(4 ℃,931×g,30 min),得到的血清于-80 ℃下保存。按照EnzyChromTMEthanol Assay试剂盒(ECET-100,美国BioAssay 公司)的说明书进行测定。
免疫组化染色对照组麻醉及创伤组造模后,次日取脑,切片,厚度为30 μm。按照切片位置选取合适脑片,0.01 mol/L PBS浸洗10 min×3次,于3% H2O2中37 ℃孵育30 min,0.01 mol/L PBS浸洗10 min×3次,于封闭液中37 ℃封闭1 h,加入一抗兔抗CART 55-102,37 ℃孵育1 h,4 ℃过夜。次日用0.01 mol/L PBS浸洗10 min×3次,生物素二抗37 ℃孵育1 h,PBS浸洗,37 ℃ AB液中继续孵育1 h,PBS浸洗。DAB显色,PBS浸洗,贴片,脱水透明,封片,显微镜拍照。
于PVN处微注射CART55-102SD大鼠体重约160 g时,进行埋管,PVN定位至坐标(前/后:-1.5 mm,内/外:± 0.4 mm,背/腹:-8.0 mm),双侧固定于头骨,并使用牙托粉和螺丝加以固定。恢复约7天后,在出生后42天进行应激模型构建,次日双侧给予PVN生理盐水和CART 55-102,每侧0.5μL(含1.25μg CART 55-102),每组6只。预实验中选择0.025、0.625、1.25μg CART 55-102 和生理盐水进行PVN注射,观察饮酒行为。结果发现,与生理盐水组比较,CART 55-102组抑制饮酒行为呈现剂量依赖性,且1.25μg CART 55-102组的差异有统计学意义。因此,选用1.25μg CART 55-102和生理盐水进行PVN微注射,测试后续14天的饮酒行为及饮酒结束后的血药浓度。另外,通过导管给予断头处死的大鼠双侧PVN各1.0μL墨水,制做切片,观察墨水的位置,以验证给药导管位置的正确性。

结 果
创伤应激可以诱导大鼠的饮酒行为与对照组相比,创伤组大鼠的饮酒量及酒精偏好均从第4天呈现大幅增加(P<0.01,t=3.219,df=10,图1A;P<0.01,t=3.562,df=10,图1C),且14天的平均饮酒量和酒精偏好差异有统计学意义(P<0.05,t=2.669,df=10,图1B;P<0.05,t=2.552,df=10,图1D),测试结束后血清中乙醇浓度明显增多(P<0.05,t=2.527,df=10,图1E)。说明创伤应激可以诱导大鼠的饮酒行为,增加饮酒量和酒精偏好。
创伤应激导致PVN中CART55-102免疫活性降低为了探究创伤应激诱导大鼠饮酒行为的机制,我们观察并统计了PVN中CART 55-102的免疫活性。与对照组相比,创伤组大鼠PVN中CART 55-102的免疫活性明显降低,差异有统计学意义(P<0.05,t=2.23,df=10,图2),提示创伤应激后PVN中CART 55-102活性被抑制。
PVN中CART55-102可以抑制饮酒行为为了探索创伤应激对CART 55-102的调控是否介导后续的饮酒行为,我们对创伤组大鼠PVN微注射生理盐水和CART 55-102,观察其对饮酒行为的影响。与生理盐水组相比,CART 55-102注射组的饮酒量和酒精偏好分别从第3天和第1天开始减少,差异有统计学意义(P<0.05,t=2.412,df=10,图3A;P<0.001,t=8.48,df=10,图3C),14天的平均饮酒量、酒精偏好及饮酒结束时的血药浓度均明显下降(P<0.001,t=4.86,df=10,图3B;P<0.01,t=3.258,df=10,图3D;P<0.05,t=2.543,df=10,图3E)。为了验证给药导管位置是否正确,测试结束后,通过导管给予双侧PVN各1.0μL墨水,制做切片观察墨水的位置(图3F)。结果说明下丘脑PVN中CART 55-102可以抑制创伤应激诱导的饮酒行为,提示创伤应激可能通过调控PVN中CART 55-102的活性来增强饮酒行为。


图1创伤应激增强青春期大鼠的饮酒行为
Fig1Traumaticstressincreasesdrinkingbehaviorinadolescentrats
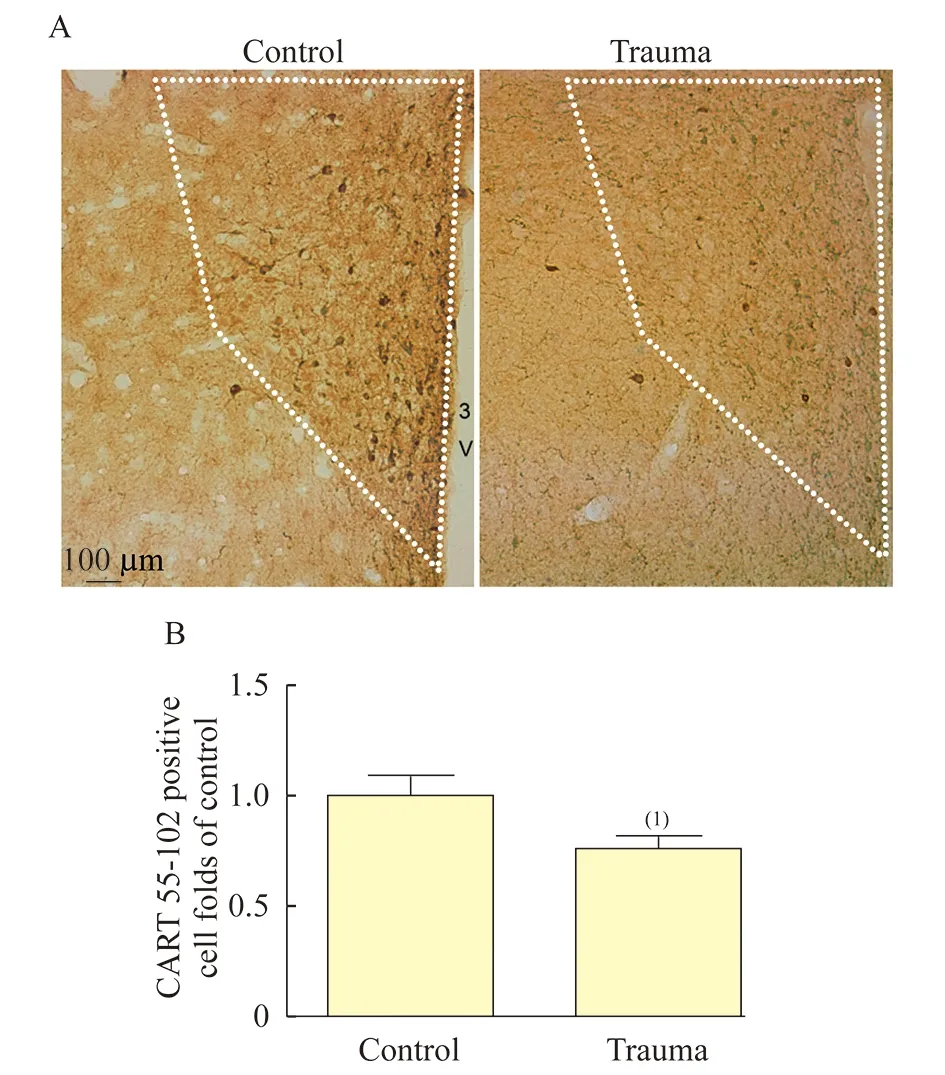
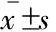
图2创伤应激降低大鼠PVN中CART55-102的免疫活性
Fig2TraumaticstressdecreasestheimmuneactivityofCART55-102inthePVNofrats
讨 论
应激是机体遭受内外环境因素刺激时做出的非特异性的全身反应。适度的应激会促使机体做出代偿性反应,调控机体的内环境稳态。而强烈或持久的应激会破坏机体的神经免疫内分泌系统稳态,损害多项器官功能,导致机体功能紊乱和组织损伤,且常诱导异常的行为学反应,其中最为显著的是酒精滥用行为[22-23]。研究指出多种应激因素会参与酒精滥用的发生与发展,如束缚应激、强迫游泳、足底电击等[4]。 Koob等[24]认为酒精滥用是应激通过某种适应机制导致的病理现象。而创伤作为一种常见的应激源,对其与饮酒行为的研究却非常有限。本研究结果说明创伤应激可以诱导青春期SD大鼠的饮酒行为,加强饮酒量、酒精偏好以及血清中乙醇浓度(图1)。

图3PVN中CART55-102可以抑制创伤应激后的饮酒行为
Fig3CART55-102inthePVNcaninhibitthedrinkingbehavioraftertraumaticstress
CART是在PVN中广泛表达的一种神经肽。除了饮食方面的功能研究指出PVN中CART 55-102可能通过神经肽Y通路参与机体能量代谢及饮食调节[25],更多研究是关于CART 55-102与应激反应的联系以及对精神兴奋性药物的管理。Sharma等[26]发现PVN中CART 55-102不仅可以调控能量代谢,而且介导了2,4,5-三甲基-3-噻唑啉(2,4,5-three methy-3-thiazoline,TMT)诱导的恐惧应激的神经内分泌反应,且呈现核区特异性。在TMT暴露的大鼠中,中央杏仁核、腹侧终纹床核及PVN中CART 55-102免疫活性增强,而在嗅球中无明显差异。Balkan等[27]指出强迫游泳应激可以调控CART 55-102的免疫活性,且有性别差异性,在雄性大鼠中强迫游泳增强下丘脑和杏仁核中CART 55-102的活性,而在雌性大鼠中强迫游泳降低杏仁核中CART 55-102的表达,下丘脑中CART 55-102没有明显变化。本研究发现,创伤应激可以减弱雄性大鼠PVN中CART 55-102的免疫活性(图2)。因此,CART 55-102的表达不仅与应激反应的类型有关,而且具有性别和核区特异性。
另有研究指出,在大鼠急性管理高剂量吗啡以及吗啡戒断阶段,脑脊液和血液中CART 55-102均大幅度上升[12]。Salinas等[28-29]认为CART 55-102 可以参与对饮酒行为的管理。本研究结果发现,PVN中微注射CART 55-102可以明显减弱大鼠的饮酒行为(图3),说明PVN中CART 55-102可以抑制创伤应激所诱导的饮酒行为,从而对机体产生保护性作用。CART 55-102对饮酒行为的调控作用在其他文献中已有报道。King等[30]指出大鼠侧脑室给予CART 55-102会抑制环境所诱导的酒精找寻行为。伏隔核内微注射CART 55-102会剂量依赖性地减弱动物饮酒行为,而CART 1-27则对饮酒行为没有影响[14]。在中脑腹侧被盖区的管理会促使大鼠出现相似于CART诱导的条件位置偏好行为[31]。CART 55-102对精神兴奋性药物的管理机制非常复杂,且具有核区特异性及剂量依赖性。CART 55-102对摄取精神兴奋性药物的促进或抑制作用依赖于其所在核区及各核区之间的联系,研究其对药物管理的作用不应只局限于对动物行为学的观察,应该加入更多对相关激素水平的研究。
应激反应往往伴随HPA轴的激活,促使PVN分泌并释放促肾上腺激素释放激素(corticotropin releasing factor,CRF),从而刺激垂体中促肾上腺激素(adrenocorticotrophic hormone,ACTH)的分泌和肾上腺中糖皮质激素[大鼠中为皮质酮(corticosterone,CORT),人类中为皮质醇]的释放[15-16]。CART 55-102在HPA轴3个水平上的高表达提示CART 55-102可能与HPA轴活性存在某种调控关系[17],相关研究也指出PVN中CART 55-102可以刺激促肾上腺激素的分泌释放,增强HPA轴的活性[32],而且CART 55-102也可以被HPA轴相关激素促肾上腺激素释放激素和皮质醇所调节[33],两者呈相互促进的关系。另有研究指出,CORT可以通过与伏隔核中多巴胺系统发生作用,导致长时程的酒精管理行为加强[34-36],提示HPA轴可以调控长期的饮酒行为。本研究中发现单次给予创伤大鼠CART 55-102,可以长时间维持对饮酒行为的抑制,这可能是通过对HPA轴的介导而实现的。在创伤模型PVN中CART 55-102是否通过作用于HPA轴来抑制饮酒行为,还需要进一步的研究和探讨。
Dandekar等[37]指出酒精戒断后不同时间会影响PVN中CART 55-102的表达,戒断24 h时免疫活性细胞和纤维大量表达,戒断48 h时活性细胞大幅下降。也有研究指出PVN中相关肽会促进饮酒反应耦联的多种行为,从而增加酒精的摄入量[38]。这些研究结果都说明PVN在调控饮酒行为中起着重要的作用。本研究中,我们观察到创伤应激可以诱导青春期大鼠的饮酒行为,而PVN中CART 55-102参与并抑制创伤应激诱导的饮酒行为,这也在临床上为创伤后酒精滥用的患者提供了一个治疗性靶点。
