基于Luminex平台的非洲流行的病毒性出血热IgG抗体多重检测方法的初步建立
2018-10-10芜为刘洋张全福李川梁米芳李建东李德新
芜为 刘洋 张全福 李川 梁米芳 李建东 李德新
近年来,随着中非友谊的不断加深,中非间的经贸往来也不断增多。尤其是“一带一路”战略将中非间的交往推向了一个新的高度。但这同样带来了诸多公共卫生方面的问题,很多流行于非洲大陆的传染病也会趁机流入我国,这其中就有不少与病毒性出血热相关的疾病,例如埃博拉出血热、拉沙热、克里米亚刚果出血热、裂谷热、黄热等[1]。2016年,各有11例黄热病例和1例裂谷热病例从非洲输入我国。这就要求相关单位采取积极的应对措施,包括开发有效的实验室检测试剂。
Luminex多重悬浮芯片检测技术作为标准化的高通量检测平台,可实现同时快速检测100种靶标,敏感度高,特异度强,样本用量少,目前已应用于多个领域,如细胞因子检测[2],感染性疾病检测[3],抗体和疫苗的研发[4],核苷酸多态性分析[5]等。 本研究首次将Luminex多重检测技术应用于非洲流行的病毒性出血热血清学的检测,这些病毒主要包括克里米亚刚果出血热病毒(CCHFV)、裂谷热病毒(RVFV)、拉沙热病毒(LASV)、卢约病毒(LUJV)、埃博拉病毒(EBOV)、马尔堡病毒(MBGV)、登革热病毒(DENV)和黄热病毒(YFV)。初步建立了针对这些病毒抗原相应IgG抗体的快速、敏感、高通量的特异性检测方法,为最终实现鉴别诊断提供了理论依据。
1 材料与方法
1.1 病毒基因、临床血清样本及动物血清 登革病毒 rEⅢ基因提取自患者血清,CCHFV、RVFV、LASV、LUJV核蛋白(NP)基因,EBOV、MBGV核蛋白基因和VP40基因,以及YFV rEⅢ基因由北京擎科新业生物技术有限公司合成。动物血清由上述基因经原核系统重组表达的抗原免疫新西兰大白兔制备。78份临床血清样本采自2014年埃博拉疫情暴发期间,有发热症状的由非洲入境人员,但埃博拉核酸检测均为阴性。114份阴性对照血清采自参加体检的健康人。
1.2 出血热病毒抗原的表达及纯化 将上述8种病毒的10个基因分别克隆至pET30 a载体,并转化入BL21(DE3)感受态细胞,均匀涂布于含50 μg/ml卡那霉素抗性的固体LB培养基,37℃过夜培养后挑选出正确的克隆并接种至含50 μg/ml卡那霉素抗性的2xYT培养基,37℃培养至OD值达到0.6~0.8后加入IPTG至终浓度为1 mmol/L,30℃过夜培养。收获细胞后用细胞裂解液重悬并超声破碎,沉淀溶于8 mol/L尿素后过滤并经金属镍离子亲和层析纯化,收集目的蛋白并通过透析的方法缓慢去除尿素成分,使得蛋白得以复性。纯化的11种病毒抗原经SDS-PAGE鉴定后分装冻存于-80℃。
1.3 重组抗原与荧光微球的偶联 荧光微球与偶联试剂均购自伯乐公司,每种病毒抗原偶联一种荧光微球,偶联方法参照公司提供的方法手册,每次将大约20 μg的重组抗原偶联至100 μl荧光微球(1.25×106个)。偶联前需要在微球中加入10 μl N-羟基硫代琥珀酰亚胺(Sulfo-N-hydroxysulfosucc inimide,S-NHS,50 mg/ml)和 10 μl1-(3-二甲基氨丙基)-3-乙基碳二亚胺盐酸盐(1-ethyl-3-[3-dimethylaminopropyl]carbodiimide,EDC,50 mg/ml),以活化微球的羧基端,从而与蛋白的氨基端进行共价偶联。偶联抗原的荧光微球可在4℃避光保存1年。
1.4 重组抗原与荧光微球偶联效果的评价 评价每种抗原的偶联效果使用相应的兔血清。首先在96孔滤膜板每孔加入100 μl稀释缓冲液(PBS+1%BSA)预湿,真空泵抽滤;加入100 μl稀释缓冲液和12.5 μl含相应编码微球的工作溶液(母液稀释25倍,保证400个/μl,即每孔5 000个微球),真空泵抽滤;加入100 μl从1∶1 000开始4倍稀释至1∶4 096 000的相应兔血清,阴性对照为相同比例稀的EV71-VP1免疫兔血清。混匀后室温避光振摇1 h,稀释缓冲液反复洗涤并抽滤3次;加入50 μl按1∶100稀释的PE标记的羊抗兔IgG,混匀后室温避光振摇1 h,稀释缓冲液反复洗涤并抽滤3次;加入125 μl的稀释缓冲液,避光振摇1 min后用Bio-Plex 200悬浮芯片仪检测。
1.5 多重荧光微球检测临床血清样本 在96孔滤膜板上每孔加入100 μl的稀释缓冲液预湿滤膜,真空泵抽滤;加入100 μl的稀释缓冲液和12.5 μl含10种荧光微球的工作溶液,真空泵抽滤;加入100 μl以1∶1 000稀释的血清,包括78份临床血清和114份正常人血清。混匀后室温避光振摇1 h,稀释缓冲液反复洗涤并抽滤3次;加入50 μl按1∶100稀释的藻红蛋白标记的羊抗人IgG,后续步骤参见1.4。将阴性对照的平均值加3倍标准差定义为Cutoff值。
1.6 多重荧光微球检测技术与酶联免疫吸附法的比较 将10种出血热病毒重组抗原分别以每孔500 ng包被于96孔ELISA板并封闭。每种板同时检测78份临床血清和114份正常人血清,将每份血清1∶100稀释后加入板中,每孔加入100 μl,37℃温育1 h。PBST洗板后加入1∶2 000稀释的辣根过氧化物酶标记的羊抗人IgG抗体,37℃温育1 h。PBST洗板后加入TMB显色,用酶标仪测定反应板中每孔液体450 nm处的吸光度值(A450)。Cutoff值定义为阴性对照的平均值加3倍标准差,并将每种抗原检测的数据与多重荧光微球检测的数据做四格表卡方检验,用统计学软件进行两种方法的一致性分析。
2 结果
2.1 10种出血热病毒抗原的表达与纯化 分别收集表达10种出血热病毒抗原的菌液并超声,上清与沉淀分别进行SDS-PAGE检测,结果显示目的蛋白多存在于沉淀中,为包涵体表达。经过变复性并纯化后通过SDS-PAGE鉴定,均呈现较单一的蛋白条带,纯度可以达到90%以上,达到检测抗原的要求(结果未显示)。
2.2 单重荧光微球检测兔血清评价偶联效果 将10种病毒重组抗原分别偶联荧光微球后,用Bio-Plex 200悬浮芯片仪单重检测相应的多克隆兔血清以及用于阴性对照的EV71-VP1免疫的多克隆兔血清以评价偶联效果。检测结果说明大部分多克隆兔血清的IgG抗体滴度基本都能达到1比100万以上,抗原偶联成功,而所有抗原与阴性对照EV71-VP1兔免疫血清均无明显免疫学反应,结果未显示。
2.3 多重荧光微球检测临床血清样本 将10种病毒重组抗原分别偶联相应的荧光微球后混合,利用悬浮芯片仪检测了78份临床血清和114份正常人血清IgG抗体。每种抗原均检测了上述两组样本,以检测正常人血清的平均值加3倍标准差定义为cutoff值,大于cutoff值判定为IgG抗体阳性。共检出LASV IgG阳性1份,LUJV IgG阳性1份,DENV IgG阳性4份,YFV IgG阳性6份,其余病毒IgG抗体均未检出。检测结果如表1所示。
2.4 ELISA检测临床血清样本并与多重荧光微球检测技术比较 将10种重组抗原分别包被ELISA板并检测78份临床血清和114份正常人血清样本IgG抗体,以检测正常人血清的平均值加3倍标准差定义为cutoff值(结果未显示),并将ELISA检测结果与多重荧光微球检测结果做四格表卡方检验进行比较并做一致性分析,结果如表2所示,可知用两种方法检测血清样本中10种IgG抗体的结果差异无统计学意义,且一致性较好。
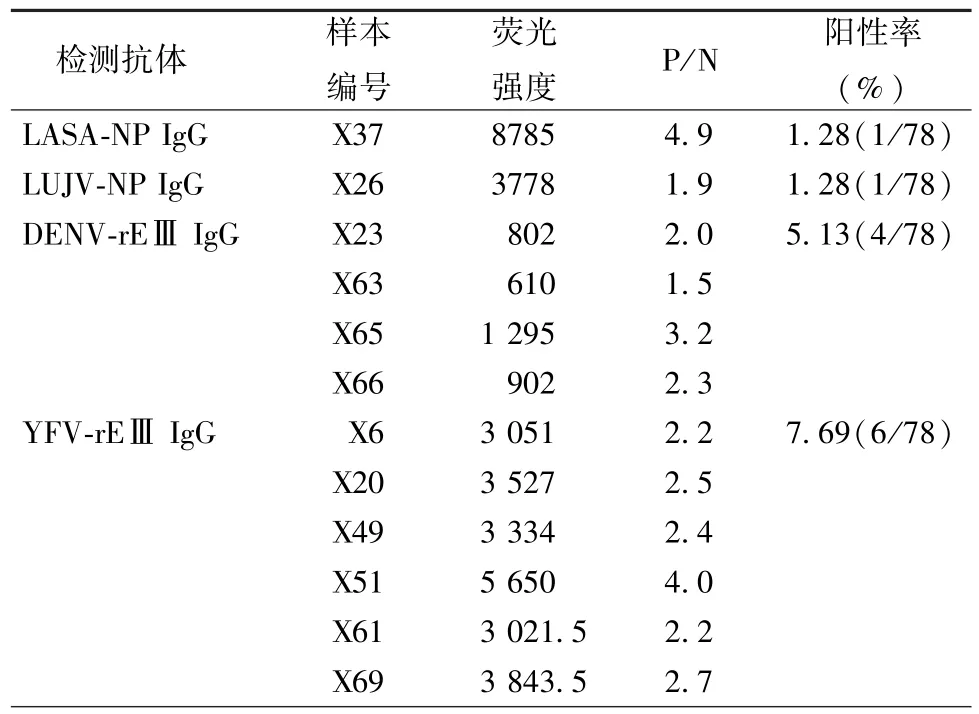
表1 多重荧光微球检测临床血清样本出血热病毒IgG抗体Tab.1 Detection of hemorrhagic fever virus IgG antibodies in clinical sera by multiplexed assay
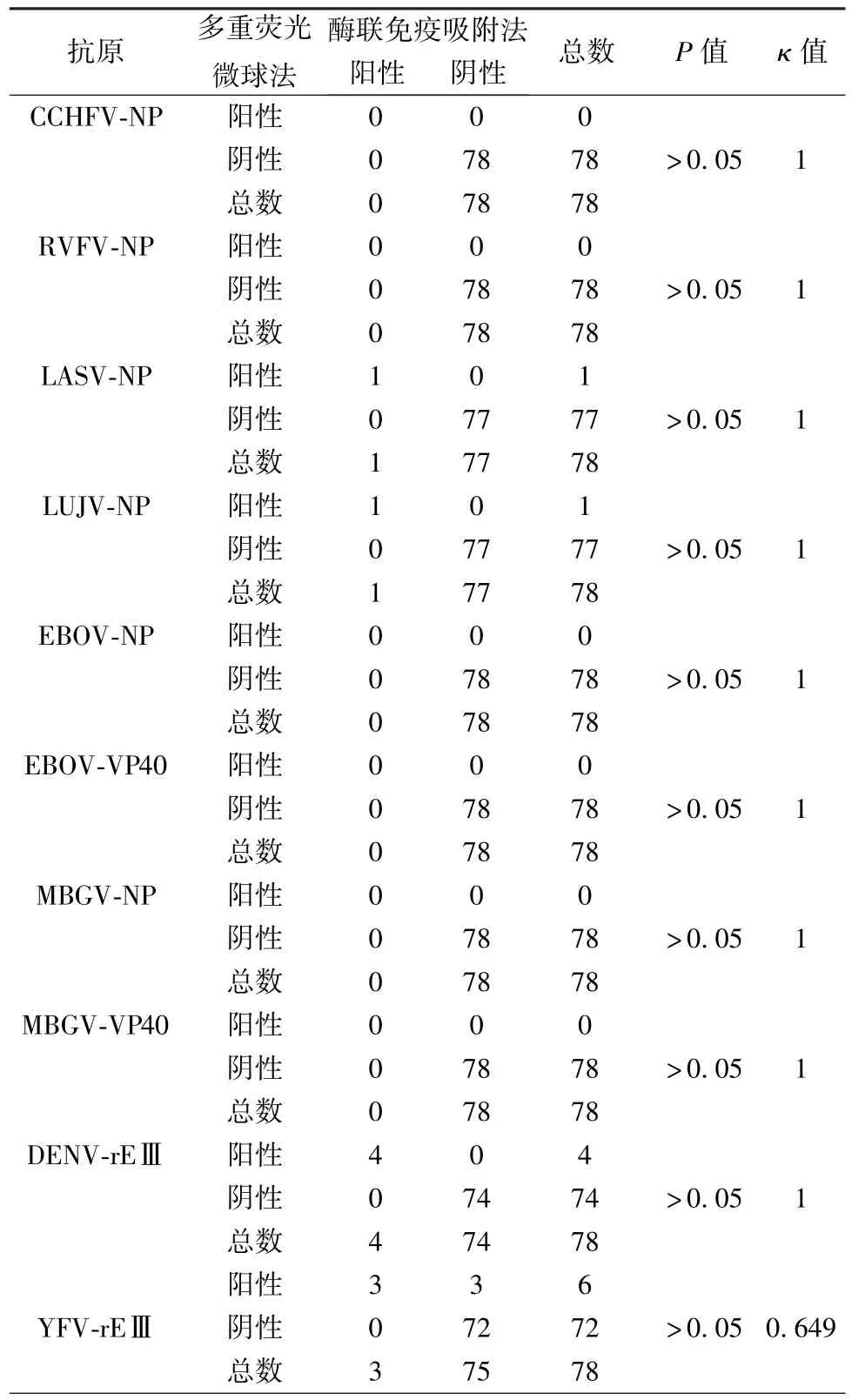
表2 多重荧光微球检测方法与酶联免疫吸附法检测临床血清的比较Tab.2 Comparison of Luminex multiplex assay and ELISA for clinical sera detection.
3 讨论
本研究主要将Luminex高通量检测方法应用于非洲流行的病毒性出血热IgG抗体的多重检测。该方法相比于传统的ELISA方法在血清学检测过程中最大的优势在于能够实现高通量检测,因此能够大大节省检测时间和样本用量。以本实验10重检测为例,使用Luminex检测方法的样本用量为0.1 μl,2.5 h即可完成,而ELISA检测方法需要10 μl样本用量,至少需要6~8 h才能够完成,并且ELISA抗原包被需要过夜,而Luminex的抗原偶联只需要5 h[6]。除此之外,由于96孔ELISA板的底面积和侧面积要比滤膜板每孔5 000个荧光微球的表面积之和大得多,从而增加非特异性的吸附并导致ELISA检测结果的特异度降低。Luminex检测方法的敏感性也要优于ELISA方法,这是由于Luminex的荧光信号比酶的化学发光信号更加直接、稳定和敏感,并且蛋白与微球之间以共价键相连,这比蛋白与ELISA板之间的疏水键更加稳固、不易断裂[7]。
目前,国内外已建立起多种基于出血热病毒核蛋白为检测抗原的实验室血清学检测方法,如汉坦病毒(hantavirus),RVFV,发热伴血小板减少综合征病毒(SFTSV),LASV和EBOV等,并且都取得了很好的应用效果。这主要是因为核蛋白具有很强的抗原性和免疫原性,能够刺激机体产生很强的特异性体液免疫应答和细胞免疫应答,从而生成大量的特异性抗体可供检测。同时,核蛋白不具有糖基化位点,且本身作为病毒主要的结构蛋白,耐热性和蛋白酶抗性较强,性质较为稳定,适合重组表达、纯化和保存,是病毒性出血热血清学诊断的首选抗原。此外,对于YFV而言,包膜糖蛋白E的结构域Ⅲ(rEⅢ)具有较多的抗原位点,也常用于黄病毒血清学的检测[8]。本研究中的DENV-rEⅢ是将登革病毒四个型的结构域Ⅲ串联在一起而形成的融合抗原,该抗原具有更好的抗原性和免疫原性,可增加检测的敏感度。
本研究从非洲归国的78例发热病例中,共检出1例LASV IgG抗体阳性,1例LUJV IgG抗体阳性,4例DENV IgG抗体阳性以及6例YFV IgG抗体阳性,并用ELISA方法进行了复核。虽然这些临床病例均确诊为疟疾,但可以证明这些病患的既往感染史,从而间接反映出这些疾病在非洲的感染率情况。在今后的工作中,本课题组将继续依托Luminex高通量检测平台,着重朝两个方向发展:①利用IgG抗体的检测经验,建立病毒性出血热IgM抗体以及抗原的多重检测方法;②以不同的地域为划分,建立针对流行于当地区域的病毒性出血热多重检测方法,例如在本研究所针对的非洲地区基础之上,建立流行于南美的、欧洲的或者东南亚的病毒性出血热多重检测方法。
综上所述,本研究通过重组表达纯化流行于非洲的出血热病毒抗原,初步建立了基于Luminex高通量检测平台的针对非洲流行的病毒性出血热IgG抗体多重检测方法,为进一步验证和完善该检测方法,最终实现鉴别诊断奠定了基础。
利益冲突:无
