基于受体捕获诺如病毒检测方法的特异性及应用
2018-10-10李慧莹王飞王大鹏靳淼程露阳段招军
李慧莹 王飞 王大鹏 靳淼 程露阳 段招军
诺如病毒(Norovirus,NoVs)属于杯状病毒科诺如病毒属,是引起食源性病毒病和急性胃肠炎的主要病原体,其引起的暴发案例主要发生在疗养院[1]、医院、游船、学校、餐厅和其他饮食场所[2]。
NoVs主要通过粪口途径传播。因诺如病毒不能进行常规细胞培养,该病毒的检测依赖于RTPCR和RT-qPCR等分子检测方法[3]。但这些分子检测方法具有一定的局限性,主要体现在:需要专门的步骤获得病毒基因组;无法区分扩增模板RNA是来源于感染性病毒粒子,还是游离的病毒RNA;检测通量低[4]。为了能够区分检测具有感染性的病毒粒子,研究人员建立了 Cell culture-PCR(ICCPCR),和Viability(PMA/EMA/Reagent D)RT-qPCR等RT-qPCR衍生的分子生物学检测方法[5-6]。
组织血型抗原(Histo-blood Group Antigens,HBGAs)是人体感染NoVs的受体或辅助受体,商品化PGM包含多种类型HBGAs,可识别并特异性吸附 NoVs多种基因型[7]。 Wang 等[6]基于 HBGAs 受体可特异性捕获NoVs的原理,以猪胃黏膜提取物(porcine gastric mucin,PGM)为介质初步建立了原位捕获反转录实时定量PCR感染性NoVs的检测方法[6]。 周震寰等[8]以 ISC-RT-qPCR 评估杜兰病毒(Tulane virus,TV)和NoVs的灭活效率,并将其应用于市售贝类样品中NoVs的检测[8]。ISC-RT-qPCR具有特异性强,可批量检测,无需核酸提取复杂操作和无PCR抑制剂等优点[6,8]。
生鲜食品为诺如病毒食源性暴发的主要载体[9]。由于浆果类食品酸性较强,含有各种检测抑制剂,污染的病毒含量低等因素,使得食源性病毒检测成为全球公共卫生面临的重点和难点[10]。为了验证ISC-RT-qPCR方法是否可以用于浆果类污染NoVs的检测,本研究针对ISC-RT-qPCR方法进行了检测特异性评估,并以该方法对人工污染草莓进行NoV检测。
1 材料与方法
1.1 材料 诺如病毒阳性粪便NoVs GⅡ型(GⅡ3、GⅡ4、GⅡ6、GⅡ12、GⅡ13、GⅡ17、GⅡ21 和 GⅡ22)由中国疾病预防控制中心病毒病所病毒性腹泻室保存;猪胃黏膜蛋白(PGM)由美国农业部西部研究中心PengTian博士惠赠;草莓购自于北京市昌平区水果菜市场。HBSS稀释液(Gibica);0.05%TBST缓冲液(0.05%Tween20);1%BSA;TGBE洗脱液(0.1 mol/L Tris-HCl,0.05 mol/L Glycine,3%Beef Extract,PH9.5); 果 胶 酶(Sigma); PEG6000(Sigma);病毒RNA提取试剂盒(Geneaid);One step qRT-PCR probe kit(南京诺唯赞生物科技有限公司)。
1.2 仪器与设备 ABI Prism©7500型荧光定量PCR仪(ABI);高速冷冻离心机(Hitachi);水平摇床(北京六一);台式高速冷冻离心机(Thermo Fisher Scientific);电热恒温培养箱(上海森信实验仪器有限公司);微孔板快速振荡器(上海碧云天生物技术有限公司);酶标板条(Nunc);荧光定量封板膜(ABI)。
1.3 诺如病毒原液的制备 取诺如病毒阳性粪便标本约0.1 g,按照1∶9的比例加入0.9 ml HBSS(1×)稀释液稀释诺如病毒粪便标本,涡旋剧烈震荡直至样本呈均质化状态,4℃,7 000×g离心10 min后仔细吸取上清液,作为病毒原液。提取病毒核酸确定病毒基因载量,并将其作为接种病毒原液,200 μl分装,-80℃保存备用。
1.4 ISC-RT-qPCR检测NoVs 按照周震寰等发表的参考文献进行操作[8]。主要步骤为:取100 μl包被液(1.0 mg/ml PGM)添加到酶标孔内,4℃静置包被过夜。取出酶标板,将包被液倒尽,将终浓度为1%的BSA添加到酶标孔内,37℃恒温孵育封闭1 h。取出酶标板,将封闭液倒尽,加入200 μl PBS缓冲液清洗酶标孔3次,倒尽液体。将100 μl NoV样本分别加入到酶标孔内,37℃恒温孵育1 h。将孔内液体吸出,加入200 μl 0.05%TBST缓冲液清洗酶标孔3次,于每孔中添加9.5 μl DEPC水,并以聚烯烃膜封盖,95℃高温热裂解5 min,4℃冷却。RT-qPCR:酶标板短暂离心,将其全部的核酸转移到已装有反应体系(具体成分比例见3.4)的 PCR八联排管中,并混合均匀。混匀后按照RT-qPCR扩增条件进行PCR扩增。
1.5 ISC-RT-qPCR检测新鲜草莓中NoVs 称取10 g新鲜草莓,在生物安全柜中点滴接种100 μl NoV原液于草莓表面,4℃孵育30 min;小心把模拟样品转移到100 ml锥形瓶中,加入30U果胶酶,再加入30 ml TGBE洗脱液(pH9.5),放置摇床100 r/min摇洗30 min;收集全部含有NoV洗脱液至50 ml高速离心管中,4℃、10 000×g离心15 min后取上清液,调节pH值至7.0~7.4。使用终浓度为10%PEG6000/0.3 mol/L NaCl沉淀富集上清液中的NoV,4℃摇转1 h。4℃、10 000×g离心45 min,弃上清保留沉淀,200 μl PBS重悬沉淀。加等体积的氯仿∶丁醇(1∶1)涡旋 10 s,静置 5 min,4 ℃、10 000×g离心15 min,取上清100 μl,添加到已包被好的酶标孔内。ISC-RT-qPCR检测回收液和接种原液中NoV。
1.6 RT-qPCR扩增
1.6.1 病毒核酸提取:按照Viral Nucleic Acid Extraction KitⅡ说明书提取病毒RNA。100 μl的粪便悬液样品进行病毒核酸纯化,最终以50 μl洗脱液进行核酸洗脱。10 μl分装,-20℃保存备用。
1.6.2 RT-qPCR:实时荧光RT-PCR反应体系总体积为 25 μl,包括 2 × One-step Q probe Mix12.5 μl,50 × ROX Reference Dye2、上下游引物(10 μmol/L)各 0.5 μl,探针(10 μmol/L)0.25 μl,One-step Q probe enzyme Mix1.25 μl,其余 9.5 μl,包括 2.5 μl的模板和7 μl DEPC水(ISC-RT-qPCR的体系中9.5 μl均为模板核酸)。扩增条件为:50℃ 15 min;95℃ 30 s;[95 ℃ 10 s;60 ℃ 40 s],45 个循环。 Ct值是按照是每个反应管内的荧光信号到达阈值时所经历的循环数计算。用已知拷贝数的标准品做标准曲线,确定接种原液中NoVs的基因拷贝数,NoVGⅡ的扩增效率为102%。
2 结果
2.1 ISC-RT-qPCR检测NoVs不同基因型别的特异性 我们筛选 NoVGⅡ型(GⅡ3、GⅡ4、GⅡ6、GⅡ12、GⅡ13、GⅡ17、GⅡ21 和 GⅡ22)阳性临床腹泻样本,评价ISC-RT-qPCR检测NoVs不同基因型别的特异性。结果见表1,ISC-RT-qPCR检测NoV GⅡ3、GⅡ4、GⅡ6、GⅡ12、GⅡ13、GⅡ17、GⅡ21 和 GⅡ22 的 Ct值分别为 34.87、35.56、31.78、28.39、30.88、34.78、36.19 和36.77。 NoVGⅡ3、GⅡ4、GⅡ6、GⅡ12基因型的ISC-RT-qPCR检测的Ct值大于传统RT-qPCR检测 Ct值;而 NoVGⅡ13、GⅡ17、GⅡ21和GⅡ22基因型ISC-RT-qPCR检测的Ct值小于传统RT-qPCR检测的Ct值。

表1 传统RT-PCR和ISC-RT-qPCR检测诺如病毒不同基因型别代表株Tab.1 Representative strains of NoV were detected with ISC-RT-qPCR and conventional RT-PCR
2.2 ISC-RT-qPCR检测不同 将已筛选确认NoVGⅡ基因型阳性且NoV载量含量高的临床腹泻样本的便悬液用HBSS缓冲液10倍梯度稀释到10-4倍,包括 NoVGⅡ3、GⅡ4、GⅡ6 和 GⅡ12 基因型。ISC-RT-qPCR检测结果见图1。无论是NoV GⅡ3、GⅡ4、GⅡ6和GⅡ12,传统RT-PCR检测的 Ct值随着稀释倍数的增加而呈线性增加,而ISC-RT-qPCR检测的Ct值并没有随着稀释倍数的增加而变化。并且当梯度稀释到10-3倍和10-4倍时ISC-RT-qPCR检测的Ct值小于传统RT-PCR检测的Ct值。
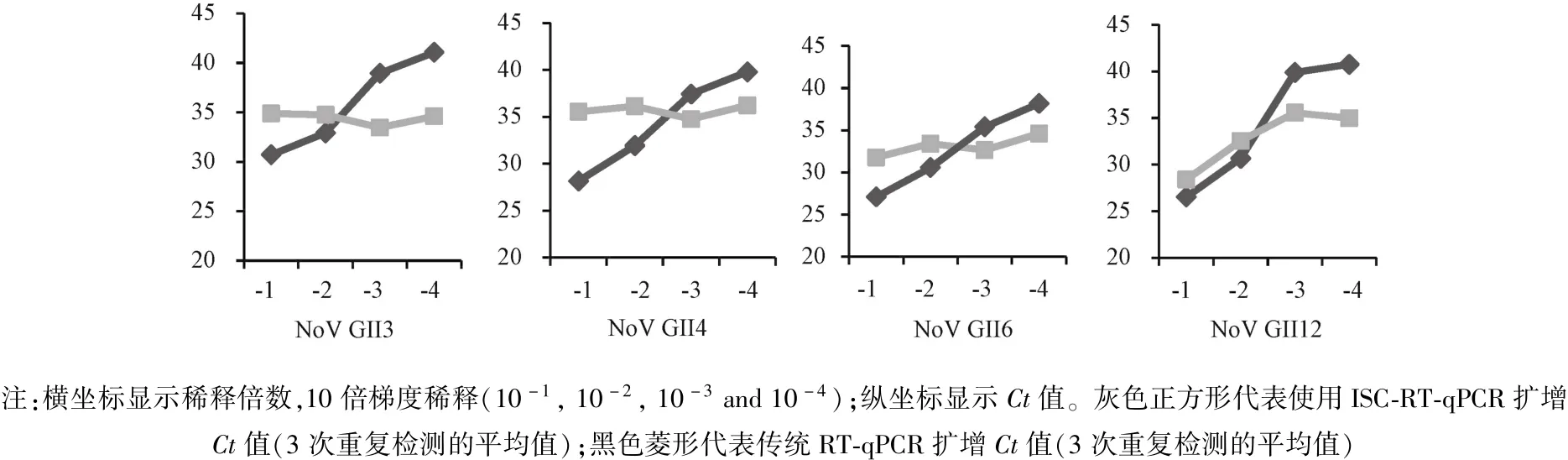
图1 比较传统RT-qPCR和ISC-RT-qPCR检测不同浓度NoVGⅡ基因型临床腹泻标本Note:Horizontal axis shows the dilution ratio,tenfold serial dilutions(10-1,10-2,10-3and 10-4),and the vertical axis shows Ct value.The gray solid square indicate the Ct value(the average of three repeated detections)using ISC-RT-qPCR;the black solid diamond indicate the Ct value(the average of three repeated detections)using RT-qPCRFig.1 Comparison of detection results on clinical diarrhea samples with various inoculum of NoV GⅡusing RT-qPCR and ISC-RT-qPCR
2.3 ISC-RT-qPCR检测草莓中NoV的效果 在10 g鲜草莓中接种100 μl不同浓度NoVGⅡ型阳性临床腹泻样本便悬液,TGBE洗液洗脱,终浓度10%PEG6000/0.3 mol/LNaCl富集后,用 ISC-RT-qPCR检测回收液中NoV,用传统RT-qPCR检测接种原液的NoV。结果表明(见表2),随着接种NoV浓度的降低,用传统RT-qPCR检测方法检测接种原液NoV所得到的Ct值在线性上升,当接种原液NoV总浓度达到102基因拷贝数以下,达到了该方法的检测限。而用ISC-RT-qPCR检测草莓回收液中NoV,得到的Ct值在33.98~41.17之间。当接种原液NoV浓度为1.36基因拷贝数/10 g时,ISC-RT-qPCR检测Ct值为38.78。说明ISC-RT-qPCR检测草莓中NoV GⅡ的检测限可达到1.36基因拷贝数/10 g。
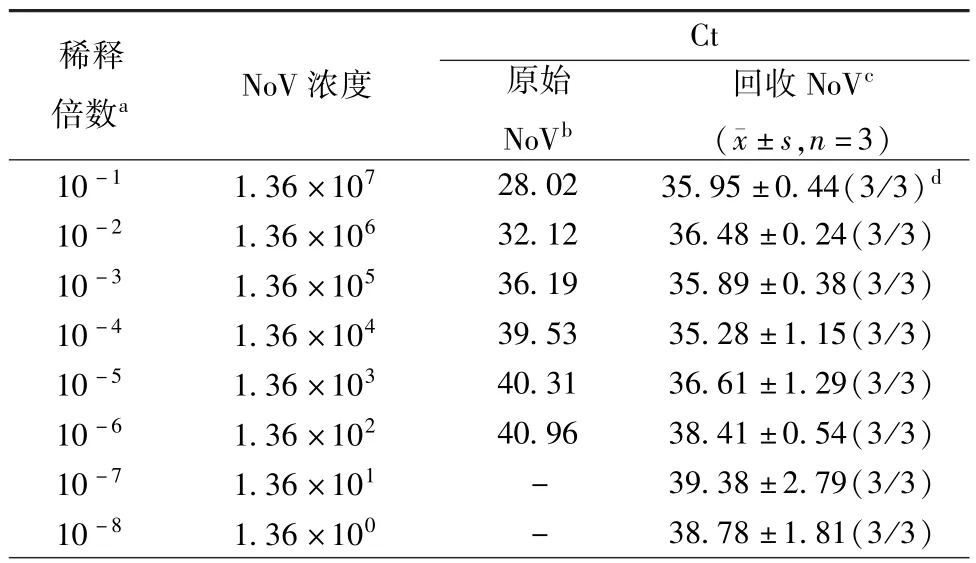
表2 ISC-RT-qPCR检测不同梯度诺如病毒Tab.2 The effect of detection of viral quantity by ISC-RT-qPCR
3 讨论
近几年,全球范围内食源性诺如病毒暴发频繁被报道,该病毒已造成了严重的公共健康负担。为更好的对病毒疫情进行控制,及对患者进行准确诊断治疗,建立高效而灵敏的NoVs检测方法显得尤为重要。因NoVs不能进行常规细胞培养,目前分子生物学技术是检测NoVs的主要手段,其中RT-qPCR因其准确性强、特异性好和灵敏度高等特点被公认为 NoVs检测的金标准[11]。但是传统 RT-qPCR无法区分检测信号是来源于完整的病毒颗粒还是游离的 RNA[12]。为尽可能的达到区分的目的,建立了RT-qPCR衍生的分子生物学检测方法[6]。ISC-RT-qPCR是衍生技术的主要代表,该方法基于HBGAs受体捕获病毒的原理,即以NoVs受体HBGAs为介质特异性吸附病毒颗粒,热裂解释放核酸后,再对病毒核酸进行实时定量检测,从而达到区分感染性 NoVs的目的[6]。 目前,ISC-RT-qPCR仅被应用于市售贝类样品NoV检测[8]。本研究进一步探讨ISC-RT-qPCR检测GⅡ组NoVs不同基因型的特异性,并评估其在新鲜草莓中NoV的检测效果。
Tian等对猪胃黏蛋白偶联磁珠(Porcine Gastric mucin-conjugated magnetic beads,PGM-MB)捕获不同NoV GⅡ基因型的特异性和动力学研究报道称,85%NoVGⅡ基因型(GⅡ1a/1b/1c/1 d、GⅡ4 Farmington/Hunter-like/sample B、GⅡ5、GⅡ7、GⅡ11和GⅡ12)成功地被 PGM-MB捕获并浓缩,仅NoVGⅡ4 Bristol和NoVGⅡ6基因型没有得到理想的浓缩效果[7]。本研究筛选了除Tian选用的NoVGⅡ4和GⅡ12基因型外,还对NoV GⅡ3、GⅡ13、GⅡ16、GⅡ17、GⅡ21和 GⅡ22基因型进行 ISC-RT-qPCR检测,并且成功的在临床腹泻标本中检测到以上NoV基因型信号。
在本研究中,当临床腹泻样本中NoVs的基因载量相对高时,ISC-RT-qPCR检测的Ct值高于传统RT-qPCR的Ct值;而当临床腹泻样本中NoVs的基因载量相对低时,ISC-RT-qPCR检测的Ct值低于传统RT-qPCR的Ct值。同时也发现,之前 ISC-RT-qPCR检测的Ct值高于传统RT-qPCR的Ct值的临床腹泻样本(NoVGⅡ3、NoV GⅡ4、NoV GⅡ6和NoV GⅡ12基因型)随着稀释倍数增加到10-3倍后,ISC-RT-qPCR检测得到的Ct值低于传统RT-qPCR的Ct值。说明ISC-RT-qPCR在检测NoV载量低的临床腹泻样本的灵敏度高于传统RT-qPCR。ISC-RT-qPCR使用的是包被在一定表面积的酶标板孔上的1 mg/ml PGM捕获病毒粒子,王大鹏等已确认1 mg/mL PGM是避免过量低效的最佳浓度[8],那么“有限的酶标孔表面积仅能提供一定量NoV结合位点”这一特点,将使得ISC-RT-qPCR方法有一个结合NoVs的饱和值。当待检样品中NoVs的载量大于该饱和值时,ISC-RT-qPCR检测所得的Ct值将不会像传统RT-qPCR那样随着NoVs的载量的增加而Ct值线性降低,反而高于RT-qPCR的Ct值。
目前草莓中诺如病毒检测主要分为两个步骤,包括病毒的分离和RT-qPCR核酸检测。用碱性洗脱液洗脱和PEG沉淀获得病毒,其检测限可达到102RT-PCRU/10 g,回收率在 2% ~ 44% 之间[3];用碱性洗脱液洗脱和超滤的方法被报道的很少,但检测限可达到54 RT-PCRU/15g[13]。本研究采用碱性洗脱液洗脱和PEG沉淀,再结合ISC-RT-qPCR检测草莓中NoV,其检测限可达到1.36基因拷贝数/10 g,低于以往的研究报道。无论是PEG沉淀、超滤还是超速离心均将30~50 ml洗脱液浓缩到30 μl~50 μl之间。 而本研究100 μl浓缩液通过 PGM 捕获后最终的浓缩体积降低到9.5 μl。也就是与传统的方法相比,ISC-RT-qPCR方法可以达到进一步浓缩的效果。另外,草莓的成分复杂,含有多种PCR抑制剂,有研究利用氯仿丁醇去除PCR抑制剂[14],但氯仿具有刺激性气味和剧毒。本研究通过PGM捕获病毒后,冲洗掉其他的遗留成分,不用添加任何试剂,便有效去除了PCR抑制剂对检测影响。
综上所述,ISC-RT-qPCR能特异性检测不同的诺如病毒GⅡ基因型,尤其是在对低浓度NoV的检测,无论是临床样本还是草莓样本,都要比传统RTPCR更灵敏。表明ISC-RT-qPCR是一种可用于临床腹泻样本和草莓中GⅡ组感染性诺如病毒的检测方法。
利益冲突:无
