Let-7d靶向LOX-1逆转ox-LDL诱导血管内皮细胞凋亡观察
2018-10-10黄宇玲葛庆锋刁增利苏鹏宇
闫 杰,陈 静,黄宇玲,葛庆锋,刁增利,苏鹏宇,李 燕
1)华北理工大学附属医院心血管内科 河北唐山 063000 2)华北理工大学生命科学学院 河北唐山 063000
动脉粥样硬化是大、中动脉动脉壁的一种慢性炎症性疾病,其特征是形成可部分或完全阻塞血管腔的动脉粥样硬化斑块[1]。氧化低密度脂蛋白(oxidized-low density lipoprotein,ox-LDL)在动脉粥样硬化形成中发挥重要作用[2]。凝集素样氧化低密度脂蛋白清除受体1(lectin-like oxidized low-density lipoprotein scavenger receptor-1,LOX-1)是负责结合、内化和降解ox-LDL的主要受体之一[3]。LOX-1的激活与许多病理生理事件有关,包括内皮细胞和血管平滑肌细胞增殖、细胞周期信号改变及细胞凋亡等[4]。研究[4]表明,动脉粥样硬化区域细胞凋亡显著增加,研究ox-LDL诱导的血管内皮细胞凋亡将有助于了解动脉粥样硬化的发生发展机制。
miRNA是非编码单链分子,由约22个核苷酸组成,可在转录水平上调控基因表达,miRNA与炎症、氧化应激和血管生成有关[5]。Let-7家族已被证实能够通过与mRNA的3’-UTR结合来抑制目的基因的表达[6],在炎症、动脉粥样硬化进展中起着至关重要的作用[7-8]。Qin等[7]研究表明let-7c可通过抑制Bcl-xl来促进内皮细胞凋亡。Chen等[9]研究报道了let-7g与LOX-1之间负反馈调节,LOX-1 mRNA的3’-非翻译区上含有let-7g结合位点。Bao等[10]研究报道,在冠状动脉粥样硬化性心脏病患者中Let-7d和Let-7i表达下调,提示Let-7d可能在动脉粥样硬化中起作用。本研究证实了ox-LDL能够诱导人脐静脉内皮细胞(HUVECs)中Let-7d表达降低,并且过表达Let-7d可通过靶向LOX-1表达来逆转ox-LDL对血管内皮细胞凋亡的诱导作用,现将结果报道如下。
1 材料与方法
1.1实验材料HUVECs购自美国ATCC;胎牛血清、RPMI 1640培养基、OPTI-MEM培养基、青霉素、链霉素、胰蛋白酶、Lipofectamine 2000购自美国Invitrogen公司;ox-LDL购自北京索莱宝科技有限公司;miRNA反转录试剂盒购自中国大连宝生物科技有限公司;KAPA SYBR FAST qPCR试剂盒购自美国KAPA Biosystems公司;miRNA 模拟物对照(NC)、Let-7d模拟物购自上海吉玛公司;pmirGLO质粒、Dual Luciferase®Reporter Assay System购自Promega公司;Ⅷ因子抗体购自北京中杉金桥生物技术有限公司;LOX-1抗体购自美国Sigma公司,Caspase 3、Bax、Bcl-2、GADPH抗体购自CST公司;辣根过氧化物酶联二抗和ECL发光液购自德国Merck Millipore公司。
1.2细胞培养及分组将HUVECs用含有体积分数10%胎牛血清和青、链霉素的RPMI 1640培养基,于37 ℃、体积分数5% CO2的培养箱中培养,待细胞融合度达到80%时,用胰蛋白酶消化并传代。用50 mg/L的ox-LDL分别处理HUVECs 0、24和48 h[11],分别记为0 h组、24 h组和48 h组。将对数生长期HUVECs消化,取1×105个细胞接种于24孔板中,分为4组,每组3个复孔,待细胞贴壁后融合度达50%时,用Lipofectamine 2000和OPTI-MEM培养基将NC与Let-7d转入细胞中,6 h后其中2组更换新鲜培养基,另外2组更换含有50 mg/L的ox-LDL的培养基,放入细胞培养箱继续培养至48 h,分别记为NC组、Let-7d组、NC+ox-LDL组和Let-7+ox-LDL组。
1.3HUVECs中Let-7d表达的RT-qPCR检测按照Trizol说明书提取各组细胞总RNA,采用miRNA反转录试剂盒进行反转录并于PCR仪上检测Let-7d的表达,以U6作为内参,用2-ΔΔCt法计算Let-7d相对表达量。循环步骤为:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,40个循环;然后进行熔解曲线分析。使用的引物序列如下。Let-7d:上游引物5’-AGGTTGCATAGTTTTAGGGCA-3’,下游引物5’-AAGGCAGCAGGTCGTATAGT-3’;U6:上游引物5’-CTCGCTTCGGCAGCACA-3’,下游引物5’-AACGCTTCACGAATTTGCGT-3’。实验重复3次。
1.4HUVECs中相关蛋白表达的Westernblot法检测取处理后的细胞用冷PBS洗2次,RIPA裂解
液提取总蛋白,BCA法测蛋白浓度并经SDS-PAGE电泳分离各组样品,蛋白分离后进行转膜至PVDF膜,50 g/L脱脂牛奶封闭后分别用LOX-1、Caspase 3、Bax、Bcl-2和GADPH(内参)抗体以及辣根过氧化物酶联二抗孵育,最后于曝光仪上用ECL发光液曝光显影。用Image J软件分析LOX-1、Caspase 3、Bax和Bcl-2蛋白的相对表达量。实验重复3次。
1.5Let-7d与LOX-1靶向调控关系的分析采用双荧光素酶报告基因实验进行Let-7d与LOX-1靶向调控关系的分析。采用TargetScan(http://www.targetscan.org/)在线预测网站检测到LOX-1 3’UTR与Let-7d存在结合位点,猜测LOX-1可能是Let-7d的一个靶基因。用Trizol提取细胞总RNA并反转录为cDNA,使用LOX-1的3’UTR引物进行PCR扩增,并将其克隆至pmirGLO,构建pmirGLO-LOX-1-WT载体。利用TaKaRa点突变试剂盒突变pmirGLO-LOX-1-WT上Let-7d结合位点来构建pmirGLO-LOX-1-Mut载体。利用Lipofectamine 2000将LOX-1-WT或LOX-1-Mut报告载体联合NC或Let-7d转染至HUVECs中,48 h后使用Dual Luciferase®Reporter Assay System试剂盒检测各组细胞荧光素酶活性。实验重复3次。
1.6HUVECs凋亡检测取1×106个对数生长期HUVECs接种至6孔板中,在培养基中加入终浓度为50 mg/L的ox-LDL,培养48 h;另取转染NC或Let-7d后的HUVECs加入50 mg/L的ox-LDL继续培养48 h。用不含EDTA的胰蛋白酶消化收集细胞,冷的PBS洗2次,上流式细胞仪检测各组细胞凋亡情况。实验重复3次。
1.7统计学处理采用SPSS 21.0进行统计学分析。0 h组、24 h组和48 h组间LOX-1蛋白表达及Let-7d表达的比较均采用单因素方差分析,两两比较采用LSD-t检验;NC组和Let-7d组间荧光素酶活性的比较采用两独立样本的t检验;NC组、Let-7d组、NC+ox-LDL组和Let-7d+ox-LDL组间LOX-1蛋白和mRNA表达、细胞凋亡率及Caspase 3、Bax、Bcl-2蛋白表达的比较均采用2×2析因设计的方差分析。检验水准α=0.05。
2 结果
2.1ox-LDL诱导HUVECs中LOX-1和Let-7d表达的变化结果显示,ox-LDL诱导细胞中LOX-1表达增加,Let-7d表达降低(图1、表1)。

1:0 h组;2:24 h组;3:48 h组图1 ox-LDL诱导HUVECs中LOX-1蛋白的表达表1 3组HUVECs中LOX-1蛋白及Let-7d相对表达量的比较

组别nLOX-1蛋白相对表达量Let-7d相对表达量0 h组30.19±0.020.98±0.0424 h组30.41±0.04*0.49±0.05*48 h组30.52±0.03*#0.34±0.03*#F70.580201.700P<0.001<0.001
*:与0 h组相比,P<0.05;#:与24 h组相比,P<0.05
2.2Let-7d与LOX1的靶向调控关系TargetScan在线预测网站预测发现LOX-1是Let-7d潜在靶基因,LOX-1 3’UTR中含有与Let-7d反向互补结合的核苷酸序列(图2)。双荧光素酶报告基因实验结果显示,Let-7d显著降低了LOX-1-WT荧光素酶活性,而对LOX-1-Mut荧光素酶活性无影响(表2)。
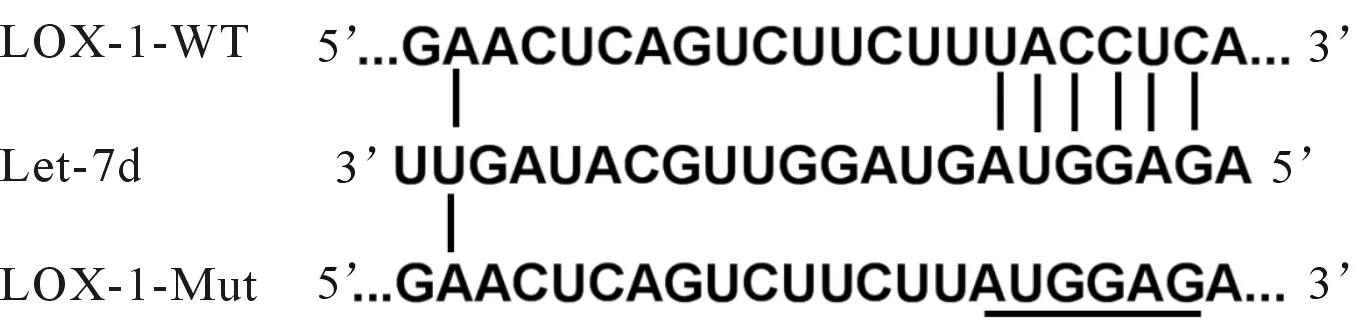
图2 Let-7d与LOX-1的3’UTR互补结合表2 2组HUVECs中荧光素酶活性比较
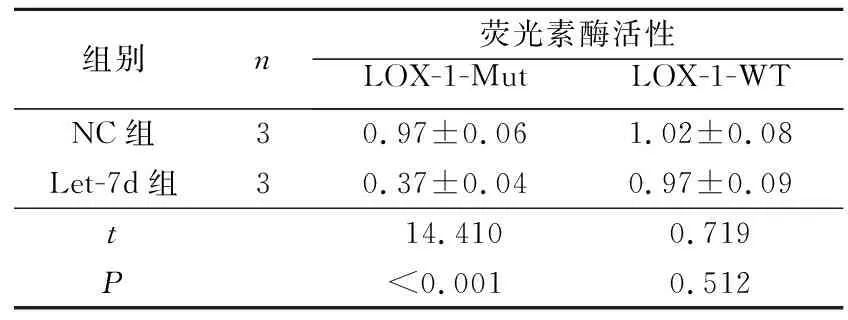
组别n荧光素酶活性LOX-1-WTLOX-1-MutNC组30.97±0.061.02±0.08Let-7d组30.37±0.040.97±0.09t14.4100.719P<0.0010.512
2.3Let-7d对HUVECs中LOX-1mRNA和蛋白表达的影响结果见图3、表3。
2.4Let-7d对ox-LDL诱导HUVECs凋亡及相关蛋白表达的影响结果见图4、表4。

1:NC组;2:NC+ox-LDL组;3:Let-7d组;4:Let-7d+ox-LDL组
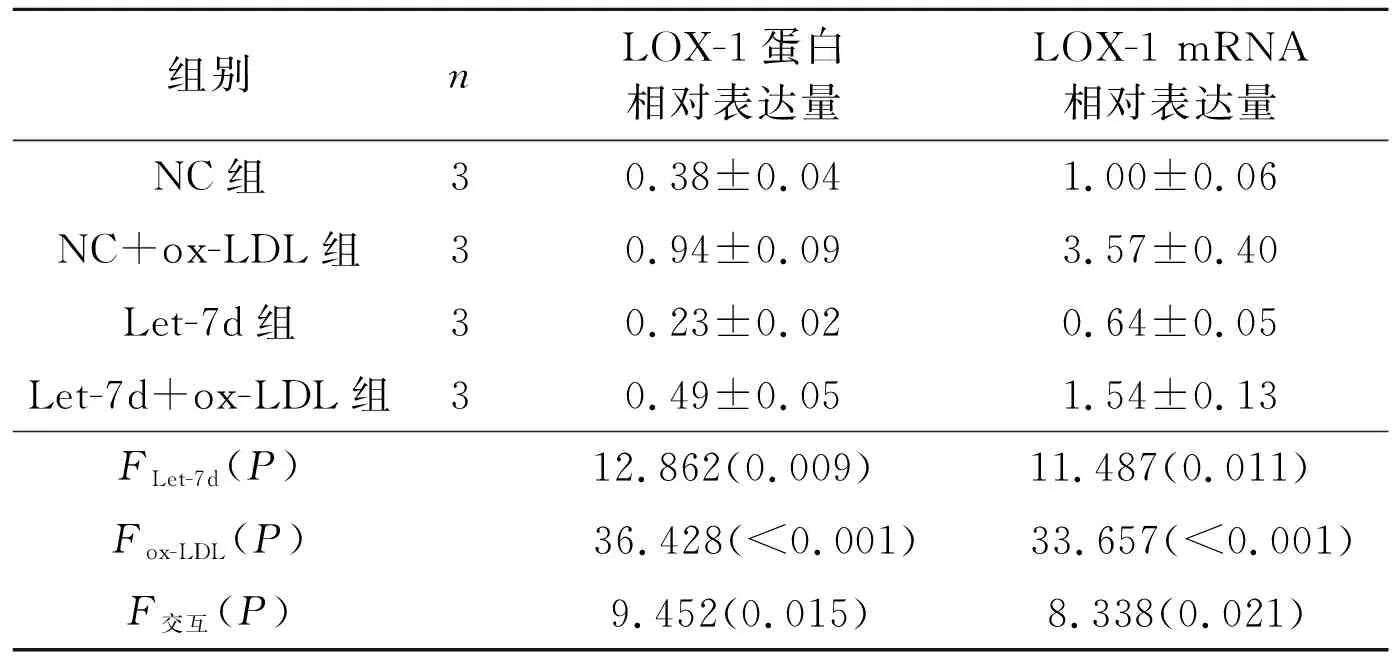
图3 各组HUVECs中LOX-1蛋白表达的检测表3 各组HUVECs中LOX-1蛋白和mRNA相对表达量的比较

1:NC组;2:NC+ox-LDL组;3:Let-7d组;4:Let-7d+ox-LDL组图4 各组HUVECs中凋亡相关蛋白表达的检测表4 各组HUVECs细胞凋亡率及Caspase 3、Bax、Bcl-2蛋白相对表达水平的比较

组别n细胞凋亡率/%Caspase 3BaxBcl-2NC组34.75±0.580.84±0.080.29±0.031.15±0.13NC+ox-LDL组317.97±2.351.95±0.160.83±0.090.22±0.02Let-7d组33.97±0.460.88±0.090.21±0.021.28±0.14Let-7d+ox-LDL组39.31±1.021.13±0.110.55±0.050.64±0.06FLet-7d(P)8.358(0.028) 11.765(<0.001) 14.226(0.006)16.582(<0.001)Fox-LDL(P)26.845(<0.001)25.824(<0.001) 32.475(<0.001)22.437(<0.001)F交互(P)14.243(<0.001)15.429(<0.001) 24.725(<0.001)9.852(0.013)
3 讨论
内皮细胞功能障碍是动脉粥样硬化的一个关键特征,其中包括内皮细胞增殖缺陷和异常的细胞凋亡[12]。动脉粥样硬化中的高脂血通常会导致内皮细胞损伤、死亡以及从血管壁的分离,进而失去对白细胞的抗黏附性作用,增加内皮壁对循环脂质的渗透性,最终导致动脉粥样硬化病变形成[13]。因此,内皮细胞对维持内皮细胞壁完整性是必不可少的,其通过修复血管来抵抗损伤。已有研究[14]证实,高脂血症导致的ox-LDL水平升高能够通过抑制内皮细胞增殖所必需的碱性成纤维细胞生长因子表达来抑制内皮细胞增殖。LOX-1表达于内皮细胞膜上,动脉粥样硬化病理状态下,LOX-1通常高表达,急性炎症条件下,LOX-1细胞外结构域可作为可溶性LOX-1(sLOX-1)从细胞膜释放到血液循环中,sLOX-1现已作为动脉粥样硬化的一个潜在诊断和预后指标[15-16]。LOX-1是ECs摄取ox-LDL的主要受体,在ox-LDL致HUVECs毒性作用中起了关键作用[17]。内皮特异性LOX-1过度表达增加主动脉ox-LDL水平,导致内皮功能障碍、血管炎症和斑块形成[18]。因此,抑制LOX-1的表达来逆转ox-LDL诱导的内皮细胞凋亡可能代表了遏制动脉粥样硬化发生发展的治疗新机制[19]。
先前的研究[4]表明,ox-LDL能够刺激内皮细胞中LOX-1的表达,且ox-LDL被LOX-1摄取,可诱导细胞发生病理变化,包括衰老和细胞凋亡,本研究结果与其一致:用50 mg/L的ox-LDL处理HUVECs可上调LOX-1表达,并且也可诱导细胞凋亡增加。有研究[13]表明,升高的LOX-1亦进一步促进了细胞对ox-LDL的摄取,ox-LDL/LOX-1正反馈环路可能进一步促进了疾病的发展,提示LOX-1可能是治疗血管内皮功能障碍的靶标。基于LOX-1在ox-LDL诱导内皮细胞凋亡中的作用,作者猜测miRNA可能参与调控ox-LDL诱导的HUVECs中LOX-1的表达和活性。通过TargetScan生物信息学分析发现LOX-1是Let-7d的潜在靶标,并且ox-LDL可下调Let-7d的表达,这与ox-LDL诱导LOX-1表达结果呈相反趋势。为进一步研究Let-7d和LOX-1之间调控关系,本研究利用双荧光素酶报告基因实验证实了Let-7d能够直接结合LOX-1 mRNA的3’UTR种子序列。此外,本研究将Let-7d模拟物转染至HUVECs中,亦发现其可抑制ox-LDL诱导的LOX-1表达,上述结果表明,Let-7d能够靶向结合LOX-1的3’UTR抑制LOX-1表达。
细胞凋亡是通过涉及死亡受体或线粒体信号传导途径的两个主要信号途径诱导的。在线粒体凋亡信号通路中,细胞膜电位发生改变,导致细胞色素c的释放和Caspase信号通路的激活,Caspase 3被认为是凋亡过程中的关键因子或调节因子[20]。细胞凋亡也受到几种凋亡相关蛋白的调节,包括作为抗死亡因子的Bcl-2和促凋亡因子的Bax[21]。研究[11]证实,ox-LDL能够通过与LOX-1相互作用参与调控Fas介导的内皮细胞凋亡,并且ox-LDL 通过 LOX-1 下调抗凋亡蛋白Bcl-2和抑制性细胞凋亡蛋白1的表达,从而激活细胞凋亡信号转导途径,诱导细胞凋亡。在本研究中,ox-LDL在增加LOX-1蛋白表达水平的同时,增加了Caspase 3和促凋亡蛋白Bax的表达,降低了抗凋亡蛋白Bcl-2的表达,而转染Let-7d后则逆转了ox-LDL对Caspase 3和Bax的诱导作用,并促进了抗凋亡蛋白Bcl-2的表达。
总之,本研究结果表明,Let-7d通过抑制ox-LDL对HUVECs中LOX-1表达的诱导,逆转了ox-LDL诱导的内皮细胞凋亡,对内皮细胞起到一定的保护作用。本研究结果将可能为内皮损伤的分子机制和动脉粥样硬化的发病机制提供新见解,Let-7d可能成为治疗动脉粥样硬化中内皮细胞功能障碍的新靶标。
