食管鳞癌紫杉醇耐药细胞株的建立及耐药机制探讨
2018-10-10惠怡然杨珍珍李岳衡许培荣范天黎
惠怡然,杨珍珍,李岳衡,高 盼,许培荣,范天黎
1)郑州大学基础医学院药理学教研室 郑州 450001 2)郑州人民医院药剂科 郑州 450003 3)郑州大学药学院 郑州 450001
食管癌是常见的恶性消化道肿瘤之一,在我国主要以食管鳞癌为主(占90%以上)[1]。紫杉醇(paclitaxel,PTX)是临床食管癌治疗的一线药物,作用原理是通过促进微管聚合阻止细胞有丝分裂,从而导致细胞凋亡[2];但在化疗过程中经常出现肿瘤耐药现象,是导致治疗失败的主要原因[3]。肿瘤对一种化疗药物产生耐药的同时,也常常会对作用机制不同的其他药物产生耐药,即多药耐药[4]。在这个过程中往往伴随着耐药蛋白以及Bcl-2家族蛋白的变化。体外建立肿瘤耐药细胞株的方法主要有低剂量持续诱导法和大剂量间歇冲击法,相比而言,低剂量持续诱导过程繁琐,持续时间较长。本实验采用大剂量间歇冲击结合时间递增的方法,建立食管鳞癌PTX耐药细胞株EC1/PTX,并对其耐药机制进行了初步探讨。
1 材料与方法
1.1材料人EC1细胞由本实验室保存,RPMI 1640培养基、凝胶电泳试剂盒为索莱宝公司产品,胰蛋白酶消化液、CCK-8试剂为碧云天公司产品,基质胶为美国BD公司产品,Transwell小室为美国Corning公司产品,小鼠抗人β-actin单抗购自武汉三鹰公司,兔抗人P-gp、Bcl-2、Bax单抗购自Abcam公司,PTX购自海南中化联合制药有限公司,多柔比星(ADM)购自浙江海正药业,五氟尿嘧啶(5-FU)购自上海旭东海普药业有限公司,顺铂(CDDP)购自山东罗欣药业集团股份有限公司。
1.2细胞培养将EC1细胞置于37 ℃、体积分数5%CO2恒温培养箱中,用含有体积分数10%胎牛血清的RPMI 1640 完全培养基培养。在细胞长势良好、密度达到90%以上的情况下传代,用PBS洗去残留培养基后,用胰蛋白酶消化,之后用培养基终止,按比例传代继续培养至后续实验。
1.3耐药细胞株EC1/PTX的建立取对数生长期的EC1细胞,以100倍半数抑制浓度(IC50)为诱导剂量用PTX诱导培养2 h,然后撤去含药培养基,用PBS漂洗3次,加入常规培养基继续培养,每天换液以去除死细胞。15~20 d后存活的细胞生长恢复,进入对数生长期后进行消化处理,传代3次后重复上述操作,此阶段共作用3次。之后延长药物作用时间为4 h,重复7次。总计加药作用10次,诱导过程共历时8个月,最后得到耐药细胞株EC1/PTX。
1.4耐药细胞株EC1/PTX的生物学特性
1.4.1 细胞形态 倒置显微镜下观察EC1和EC1/PTX的形态。
1.4.2 生长曲线及倍增时间 将对数生长期的EC1或EC1/PTX细胞经胰蛋白酶消化后制成单细胞悬液,按照1.0×104个/孔的细胞密度接种到24孔板中,每种细胞接种21孔,每天3孔。每天于相同时间点计数细胞,取3孔平均值,连续计数7 d。以细胞数为纵坐标,时间为横坐标,绘制生长曲线。根据 Patterson 公式计算倍增时间。倍增时间=Tlg2/lg(Nt/N0),其中N0为第一次计数的细胞数,Nt为培养th后的细胞数,T为细胞数从N0增至Nt的时间。实验重复3次。
1.4.3 耐药指数及交叉耐药性 制备EC1或EC1/PTX单细胞悬液,按照3×103个/孔的细胞密度接种到96孔板中,24 h后吸出培养基,分别加入含有不同浓度的PTX、ADM、5-FU和CDDP的培养基100 μL,共设9个梯度浓度,每个浓度设3个复孔。于培养箱中培养48 h(5-FU组培养72 h),每孔加入10 μL CCK-8溶液放置2 h后,用酶联免疫检测仪测定450 nm波长处的光密度值,计算IC50及耐药指数。耐药指数=耐药细胞IC50/亲本细胞IC50。
1.4.4 细胞迁移及侵袭能力 ①侵袭实验:将无血清RPMI 1640培养基和基质胶按4∶1比例混匀后,取40 μL涂布到Transwell小室上室面,置于培养箱中孵育1 h。与此同时制备EC1或EC1/PTX单细胞悬液,调整细胞密度为5×105mL-1,取200 μL加入Transwell小室上室中,再在24孔板中加入600 μL含体积分数20%胎牛血清的RPMI 1640培养基。48 h后取出小室放入甲醇中固定30 min,之后用结晶紫染色,漂洗,晾干,显微镜下观察并拍照,计数穿膜细胞数。实验重复3次。②迁移实验:不需要在Transwell小室涂布基质胶,其他步骤与侵袭实验相同。实验重复3次。
1.4.5 克隆形成能力 制备EC1或EC1/PTX单细胞悬液,以1 000个/孔的细胞密度接种于6孔板,每种细胞设3个复孔,置于培养箱1周,观察克隆形成情况。用PBS漂洗2次,加入1 mL甲醇固定30 min,PBS漂洗3次,再加入结晶紫染色液30 min,PBS洗去多余结晶紫。克隆形成率=(克隆数/接种细胞数)×100%。
1.4.6 细胞周期及凋亡 ①细胞周期:制备EC1或EC1/PTX单细胞悬液,调整细胞密度为1×106mL-1,体积分数70%乙醇4 ℃固定过夜,第2天加入预冷的PBS 1 mL重悬细胞,离心后移去上清。沉淀中先加入100 μL RNaseA混匀,37 ℃水浴30 min,再加入500 μL PI染色液混匀, 24 h内进行流式检测。实验重复3次。②细胞凋亡:制备EC1或EC1/PTX单细胞悬液,以2×105个/孔的细胞密度接种于6孔板中,24 h贴壁后,加入100 nmol 的PTX孵育48 h。收集(1~5)×105个细胞,先加入500 μL的Binding buffer重悬,再加入5 μL的Annexin-FITC混匀,加入10 μL的PI染色液混匀,室温下避光反应5~15 min,在1 h内上流式细胞仪检测。实验重复3次。
1.5EC1/PTX细胞中P-gp、Bcl-2及Bax蛋白的表达收集EC1/PTX或EC1细胞,PBS 清洗 2遍,加入裂解液置于冰上裂解 30 min,低温离心机 4 ℃、12 000 r/min 离心 10 min,收集上清,BCA 蛋白定量试剂盒测定蛋白浓度,根据蛋白体积加入上样缓冲液,置于100 ℃沸水中约5 min,通过SDS-PAGE 凝胶电泳分离蛋白,设置电压为90 V,约30 min跑完浓缩胶,再调节电压为120 V,继续电泳至跑完分离胶,之后设置电压为100 V,转膜1 h。室温封闭2 h,加一抗(P-gp、Bax按 1∶1 000 稀释,Bcl-2按 1∶2 000 稀释,β-actin 按 1∶5 000 稀释) 后4 ℃过夜,加二抗37 ℃孵育2 h。按照仪器要求步骤曝光。使用 Image J 软件分析,以目的条带和 β-actin 条带灰度值的比值作为目的蛋白的相对表达量。实验重复3次。
1.6统计学处理采用SPSS 17.0进行数据分析。EC1和EC1/PTX细胞各指标的比较采用两独立样本t检验,检验水准α=0.05。
2 结果
2.1EC1/PTX的细胞形态学观察亲本细胞EC1贴壁生长,排列均匀,形状规则。PTX诱导24 h后EC1细胞形态即发生明显改变,细胞变圆变小;敏感细胞不断死亡,需每天更换培养基,最后仅存少数贴壁细胞;撤药10 d后细胞开始增殖,20 d左右可以进行消化传代,最终形成的耐药细胞EC1/PTX形态变长,并常呈聚团生长状态(图1)。

A:PTX作用前;B:PTX作用24 h;C:撤药12~15 d;D:撤药20~22 d;E:EC1/PTX图1 倒置显微镜下观察PTX作用前后EC1细胞形态变化
(×200)
2.2EC1/PTX的生长曲线及倍增时间生长曲线见图2。根据生长曲线, EC1和EC1/PTX细胞倍增时间分别为(28.43±0.38)、(33.96±0.96) h,EC1/PTX增殖速度明显减慢(t=9.306,P<0.001)。
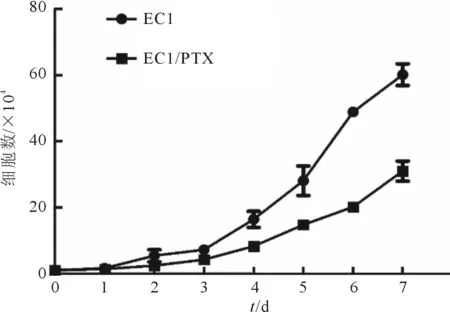
图2 细胞生长曲线
2.3不同药物对EC1/PTX细胞的IC50及其耐药指数IC50结果见表1。与亲本细胞EC1相比, EC1/PTX对PTX有较高的耐药性,对ADM、5-FU具有一定的交叉耐药性,耐药指数分别为12.82、3.92、5.04。

表1 IC50测定结果 mg/L
2.4EC1/PTX细胞的迁移、侵袭和克隆形成能力结果见图3和表2。EC1/PTX的迁移及侵袭能力均强于亲本细胞EC1,克隆形成能力弱于EC1。
2.5EC1/PTX细胞的细胞周期及凋亡率结果见
表3、4。与亲本细胞EC1相比,EC1/PTX的G0/G1、S期细胞增多,G2/M期细胞减少;100 nmol的PTX作用48 h后凋亡率显著降低。
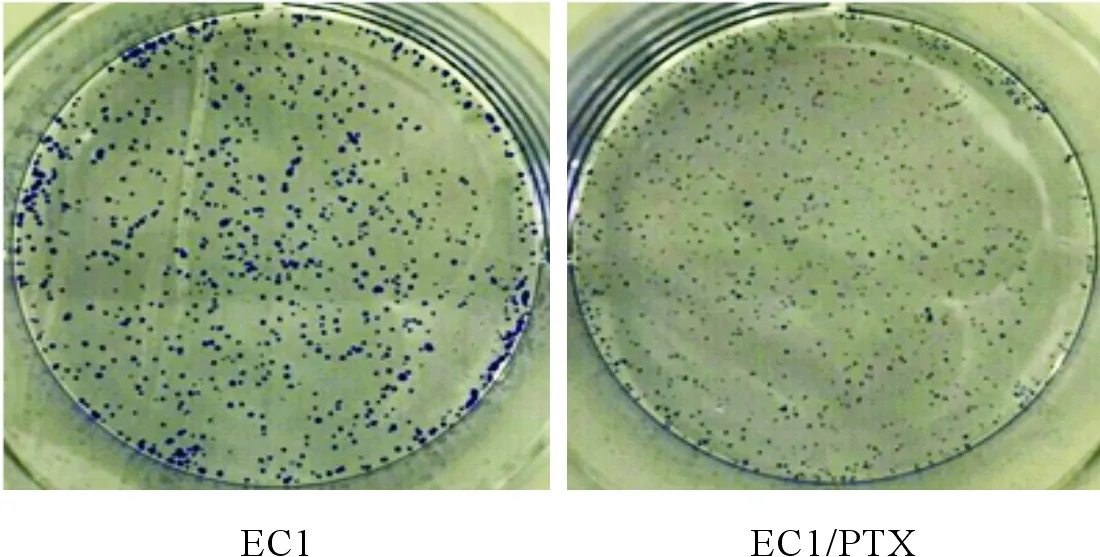
图3 EC1和EC1/PTX细胞平板克隆形成情况表2 EC1/PTX与EC1细胞迁移、侵袭和克隆形成能力的比较
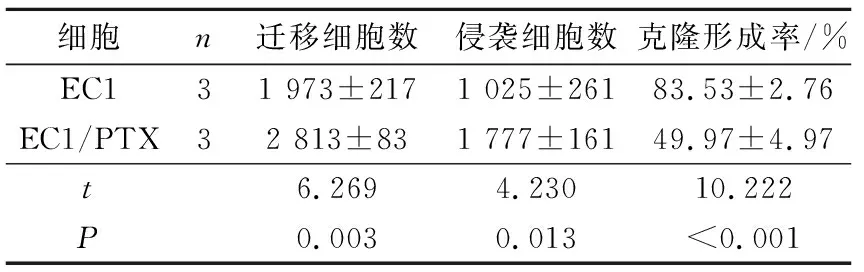
细胞n迁移细胞数侵袭细胞数克隆形成率/%EC131 973±2171 025±26183.53±2.76EC1/PTX32 813±831 777±16149.97±4.97t6.2694.23010.222P0.0030.013<0.001

表3 EC1/PTX与EC1细胞周期的比较 %
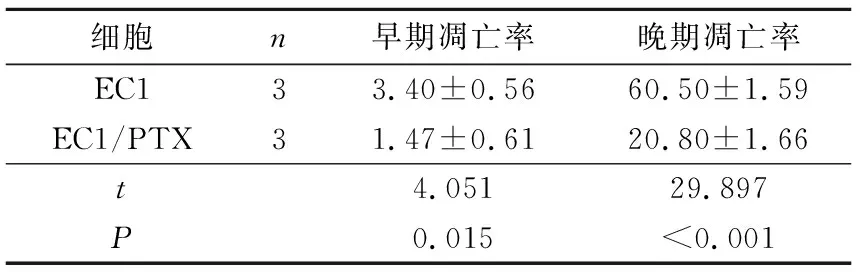
表4 EC1/PTX与EC1细胞凋亡率的比较 %
2.6EC1/PTX细胞P-gp、Bcl-2及Bax蛋白的表达Western blot结果(图4、表5)显示,与EC1细胞比较,EC1/PTX中耐药蛋白P-gp和抗凋亡蛋白Bcl-2相对表达量较高,促凋亡蛋白Bax的相对表达量较低。

图4 EC1和EC1/PTX细胞中不同蛋白的表达表5 EC1/PTX与EC1细胞不同蛋白表达的比较
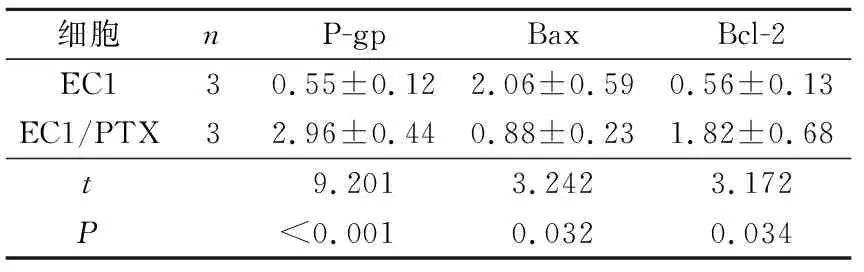
细胞nP-gpBaxBcl-2EC130.55±0.122.06±0.590.56±0.13EC1/PTX32.96±0.440.88±0.231.82±0.68t9.2013.2423.172P<0.001 0.0320.034
3 讨论
本实验采用大剂量间歇冲击结合时间递增的方法成功诱导出食管鳞癌紫杉醇耐药细胞株EC1/PTX。与亲本细胞EC1相比,EC1/PTX生长速度减慢,倍增时间延长;细胞周期重新分布,G0/G1期、S 期分布增多,G2/M期分布减少。有研究[5]认为细胞对化疗药物的敏感性与其自身的周期分布有密切关系,当细胞主要分布于对化疗药物相对不敏感的时期如G0/G1期时,则表现出耐药性。相同时间、相同剂量的药物作用下,亲本细胞EC1出现明显的凋亡形态,凋亡率显著高于EC1/PTX细胞,再次证明EC1/PTX细胞对PTX产生耐药。EC1/PTX不仅对PTX耐药,而且对从未接触过的其他化疗药物ADM、5-FU及CDDP也发生一定程度的交叉耐药。EC1/PTX细胞体外增殖能力、克隆形成能力均明显低于亲本细胞EC1,这种现象可能与细胞长期被药物冲击作用有关,并且与耐药细胞倍增时间延长的情况相符合,细胞增殖时间越长其对化疗药物越不敏感。
肿瘤细胞产生多药耐药最主要的机制是细胞表面膜蛋白介导的药物外排增加[6],其中ABC蛋白超家族又是促进药物外排的一个重要机制,目前研究最多的是三磷酸腺苷结合转运蛋白B1(ATP-binding cassette B1, ABCB1),又称P-gp[7]。另外,细胞凋亡通路受到抑制也在肿瘤耐药过程中发挥着重要作用。Bcl-2和Bax是Bcl-2家族成员,分别发挥着促进细胞生长和促进细胞凋亡的作用,两者共同调节细胞的生长,当Bcl-2蛋白表达量升高、Bax蛋白表达量降低时,将抑制细胞凋亡,反之将促进细胞凋亡[8-9]。因此我们采用Western blot实验来检测EC1/PTX细胞中P-gp和凋亡相关蛋白表达的变化情况,结果显示,与亲本细胞EC1相比,EC1/PTX中P-gp表达上升,凋亡相关蛋白Bcl-2的表达量上升的同时Bax蛋白表达量下降。
以上研究结果表明EC1/PTX产生了稳定的多药耐药表型,其耐药机制可能与P-gp、Bcl-2蛋白高表达有关。此细胞耐药模型将有助于我们更深入地研究肿瘤细胞耐药获得过程中相关基因及其信号通路的变化。
