肉芽肿性多血管炎心肌受累临床特点
2018-10-10杨云娇朱燕林费允云
杨云娇,李 菁,朱燕林,费允云
肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA),曾称为韦格纳肉芽肿(Wegener granulomatosis)是一种系统性、坏死性、肉芽肿性血管炎,主要累及中小血管,典型病理改变以坏死性、肉芽肿性血管炎为主要表现。GPA临床表现多样,上、下呼吸道和肾脏均受累者为经典的三联征[1],但心肌受累者少有报道,常影响治疗过程及预后。本文对GPA心肌受累患者的临床资料进行报道并对相关文献进行复习,以提高对该疾病的认识和心肌受累情况的重视。
1 资料与方法
1.1 对象
收集2000年1月至 2017年1月在北京协和医院住院的220例GPA患者临床资料,患者的诊断同时符合2012年Chapel Hill会议制定的血管炎新分类命名[2]及1990年美国风湿病学会(American College of Rheumatology,ACR) WG的分类标准[3]。心肌受累指由于GPA所致的心脏结构或功能异常[4],并排除高血压、冠心病等;耳鼻喉受累包括鼻结痂、鼻旁窦炎、中耳炎、持续性鼻溢、脓性/血性鼻分泌物、口腔和/或鼻溃疡以及多软骨炎、耳痛、传导性和感音神经性听力损失或耳漏等;肺部受累指GPA所致的肺实质或气道病变,主要包括呼吸困难、咳嗽、喘憋、胸痛、咯血等症状及肺部影像学提示的结节、斑片状或弥漫性阴影,部分患者可出现弥漫性肺泡出血、间质性肺炎[5-8];肾脏受累指GPA所致的以血尿、蛋白尿为表现的肾小球肾炎,部分患者可能出现高血压、急性或慢性肾功能不全,肾脏病理活检提示寡免疫复合物肾小球肾炎[9-10];眼受累指结膜炎、角膜溃疡、巩膜炎/表层巩膜炎、视神经病变、鼻泪管阻塞、眼球突出或球后占位、复视、视网膜血管炎和葡萄膜炎[11-12];神经系统受累指多数性单神经炎、颅神经异常、中枢神经系统占位病变、眼外肌麻痹和听力损失[13-14]。GPA所致胃肠道受累少见,主要是指GPA伴随胃肠道症状,典型影像学或病理表现明确为血管炎所致,严重者可导致消化道出血、肠梗阻或穿孔[15]。疾病的活动度采取伯明翰血管炎活动性评分(Bermingham vasculitis activity score,BVAS)进行评估[16]。复发定义为病情缓解后任意器官再次出现活动性血管炎的症状或体征[17],完全缓解即BVAS评分为0分。
1.2 方法
符合GAP并发心肌受累者7例。回顾性分析GAP患者的一般资料、临床表现、实验室检查、影像学检查及治疗和结局,并从同期住院的患者中选择年龄和性别匹配的19例无心肌受累GPA患者进行比较。
1.3 统计学方法

2 结果
2.1 一般资料
明确心肌受累GPA患者7例,占所有住院GPA患者的3.18%(7/220),其中男性6例,女性1例,男女比例6:1,发病年龄14~59岁,平均(45.3±16.1)岁;平均病程(5.3±4.0)个月。
2.2 GPA并发心肌受累临床特点
GPA并发心肌受累者7例中,5例以脓血分泌物的上呼吸道症状为首发症状,占71.4%;各有3例以听力下降、发热为首发症状,均占42.8%。2例以“头痛”为首发症状,占8.6%;以咳嗽、咳痰和耳痛为首发症状者各1例,均占14.3%。脏器受累方面,所有GPA心肌受累的患者均存在上呼吸道受累,并发肺受累者6例,占85.7%;肾脏受累者4例,占57.1%;神经系统受累者1例,占14.3%;眼部受累者1例,占14.3%。除心肌受累外,5例患者还存在肺、肾等多脏器受累,占71.4%;1例患者以鼻旁窦炎、硬脑膜炎、球后炎性假瘤等局部症状突出(表1)。1例患者有胸闷,其他患者无胸闷、胸痛、心慌等症状。GPA心肌受累患者比无心肌受累患者的眼部受累比例更低(14.3%vs. 68.4%),其他系统受累情况的差异无统计学意义(P均>0.05)(表2)。
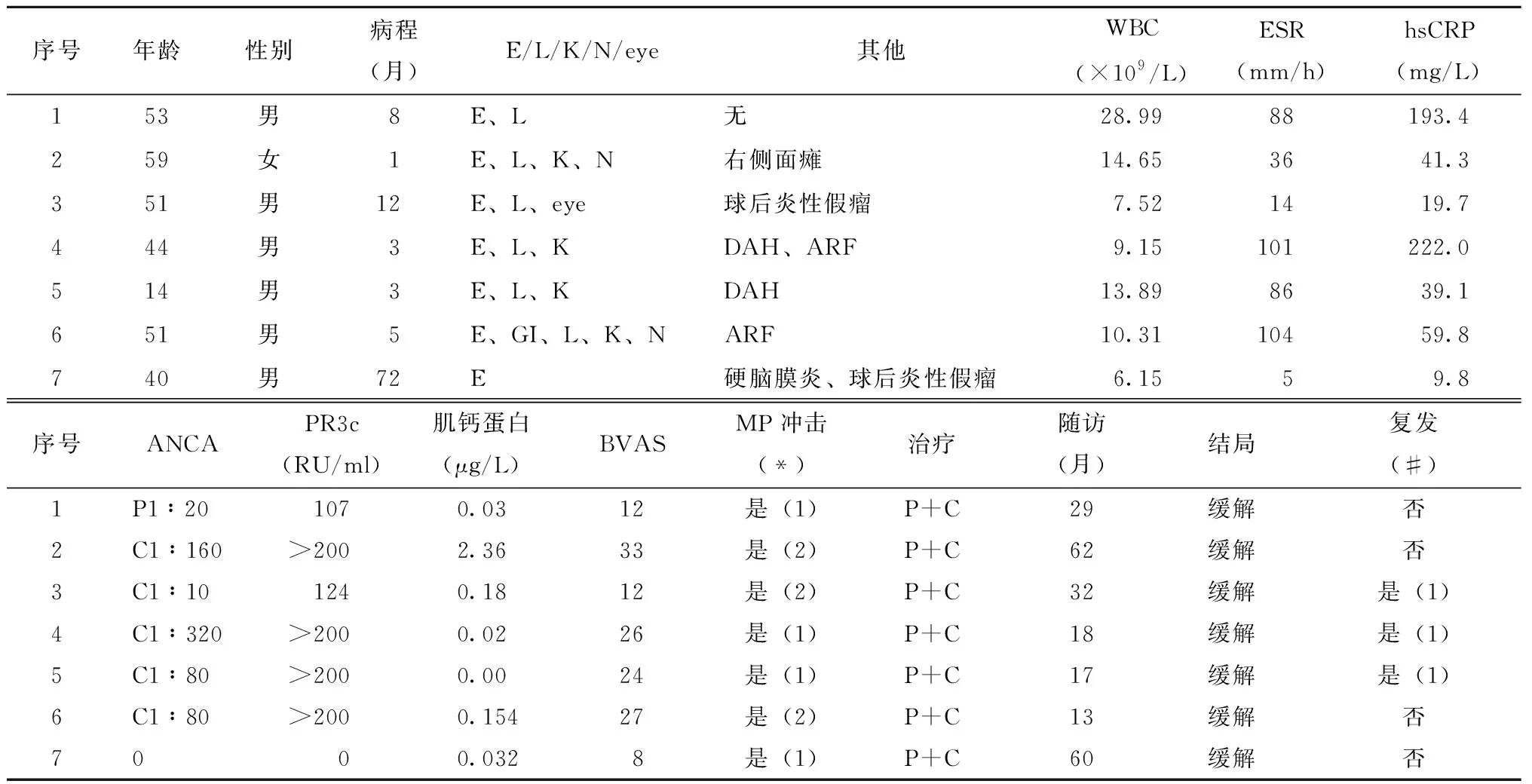
表1 7例患者一般情况及临床特点Table 1 General status and clinical characteristics of the 7 patients

表2 GPA心肌受累患者与无心肌受累患者临床表现和实验室检查结果比较Table 2 Comparison of clinical manifestations and labrotary results between with and without cardiomyopathy in GPA patients
2.3 GPA并发心肌受累辅助检查结果
7例GAP并发心肌受累患者白细胞计数为(13.0±9.5)×109/L;超敏C反应蛋白(hypersensitive C-reactive protein,hsCRP)为 (85.3±86.8)mg/L,均增高;5例患者平均红细胞沉降率(erythrocyte sedimentation rate,ESR)为(60.0±44.0) mm/h,显著增高;4例患者肌钙蛋白 为(0.45±0.87) μg/L,轻度升高;6例患者有高滴度抗中性粒细胞胞质抗体(anti-neutrophil cytoplasmic antibody,ANCA)呈阳性反应,其中阳性ANCA的靶抗原均为蛋白酶3 (protease 3,PR3);BVAS平均为20.3(12,27)分(表1)。7例患者治疗前后均接受超声心动图检查,提示心脏结构及心脏射血分数下降,5例患者存在节段性室壁运动异常,3例患者心脏左室射血分数(left ventricular ejection fraction,LVEF)下降,3例患者室间隔明显增厚,3例为左室舒张末期内径(left ventricular end diastolic diameter,LVDD)扩大(表3)。患者中例3和例5接受心脏磁共振成像检查(cardiac magnetic resonance images,CMR),均可见与心脏超声相似的节段性室壁运动减弱,射血分数下降,但并未有心内膜下延迟强化(图1)。6例患者进行冠脉增强CT检查,并未见冠脉狭窄表现。7例患者均行心电图检查,均有心电图异常(表3)。与无心肌受累GPA患者相比,心肌受累患者的BVAS评分更高(20.3分vs. 8.0分)、均有心电图异常,其他辅助检查无显著差异(表2)。
2.4 治疗和结局
7例患者均接受大剂量糖皮质激素和免疫抑制剂治疗,并且由于疾病高度活动,多脏器受累,接受甲强龙0.5~1.0 g/d冲击治疗,治疗3 d,然后给予足量糖皮质激素[泼尼松或相当量1 mg/(kg·d)]并逐渐减量,并给予环磷酰胺0.4~0.6 g/周,3例患者接受2次糖皮质激素冲击治疗,其中例2、例5因住院期间疾病活动和多脏器损伤而接受2次激素冲击治疗,例3为减量至泼尼松30 mg/d时突发视力下降和疾病反复而予以糖皮质激素冲击疗法。患者接受治疗后临床缓解,BVAS评分为0分。出院后平均随访时间33(17,60)个月,其中3例疾病复发1次,2例患者糖皮质激素减量过程中出现发热等全身症状、眼部受累等,1例出院后2个月因自行停用环磷酰胺再发咯血和发热,疾病复发,上述3例疾病复发时并未再出现心肌受累证据,治疗原发病后仍能达到疾病缓解。治疗后所有患者均复查超声心动图,提示LVEF及LVDD较治疗前均好转或恢复至正常,3例心脏室间隔增厚者原发病治疗后室间隔厚度也恢复至正常。心肌受累与无心肌受累GAP患者随诊中复发率无显著差异(表2)。
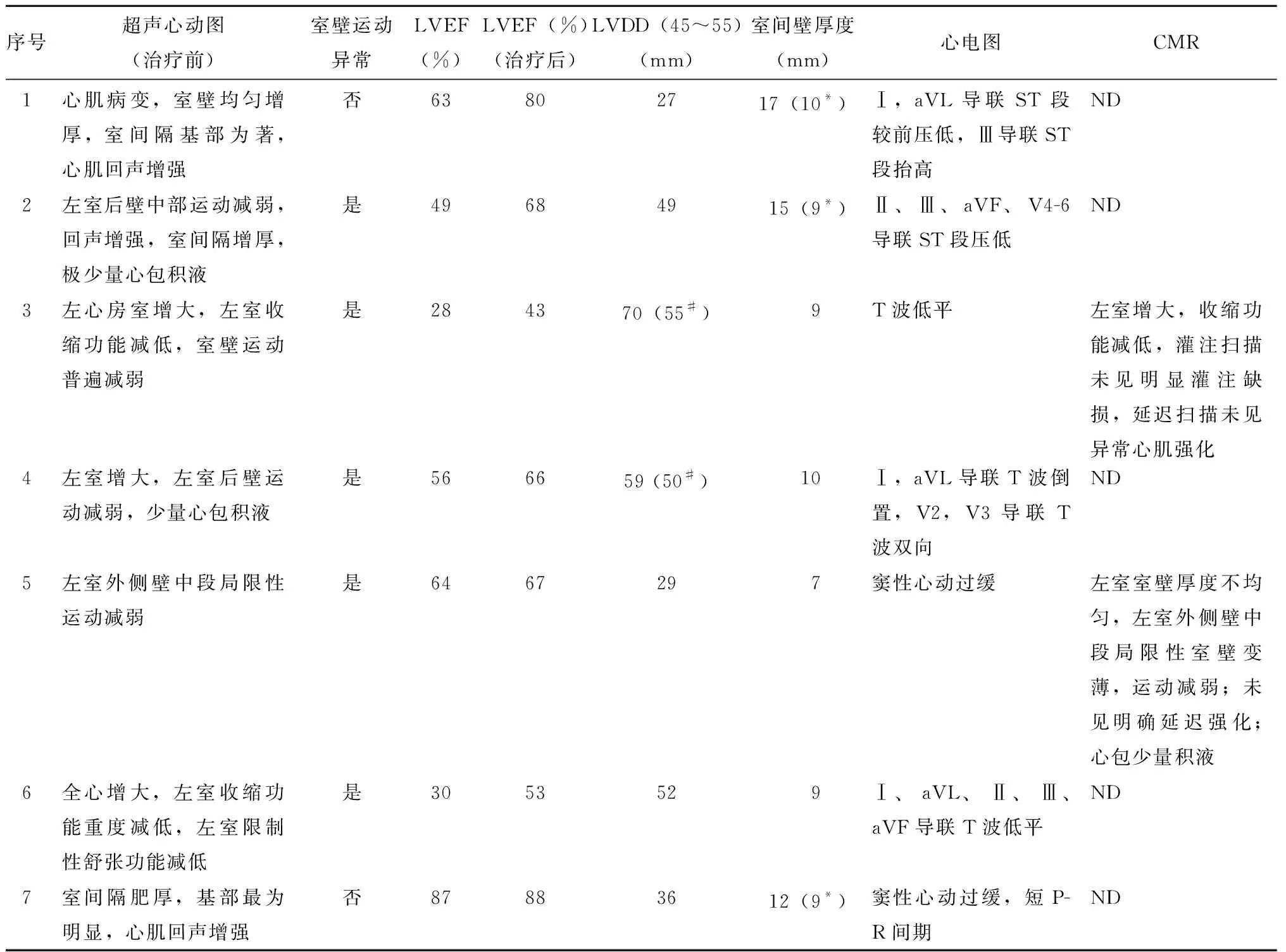
表3 7例患者超声心动图及其他相关检查Table 3 Echocardiography and relative examination of the 7 patients
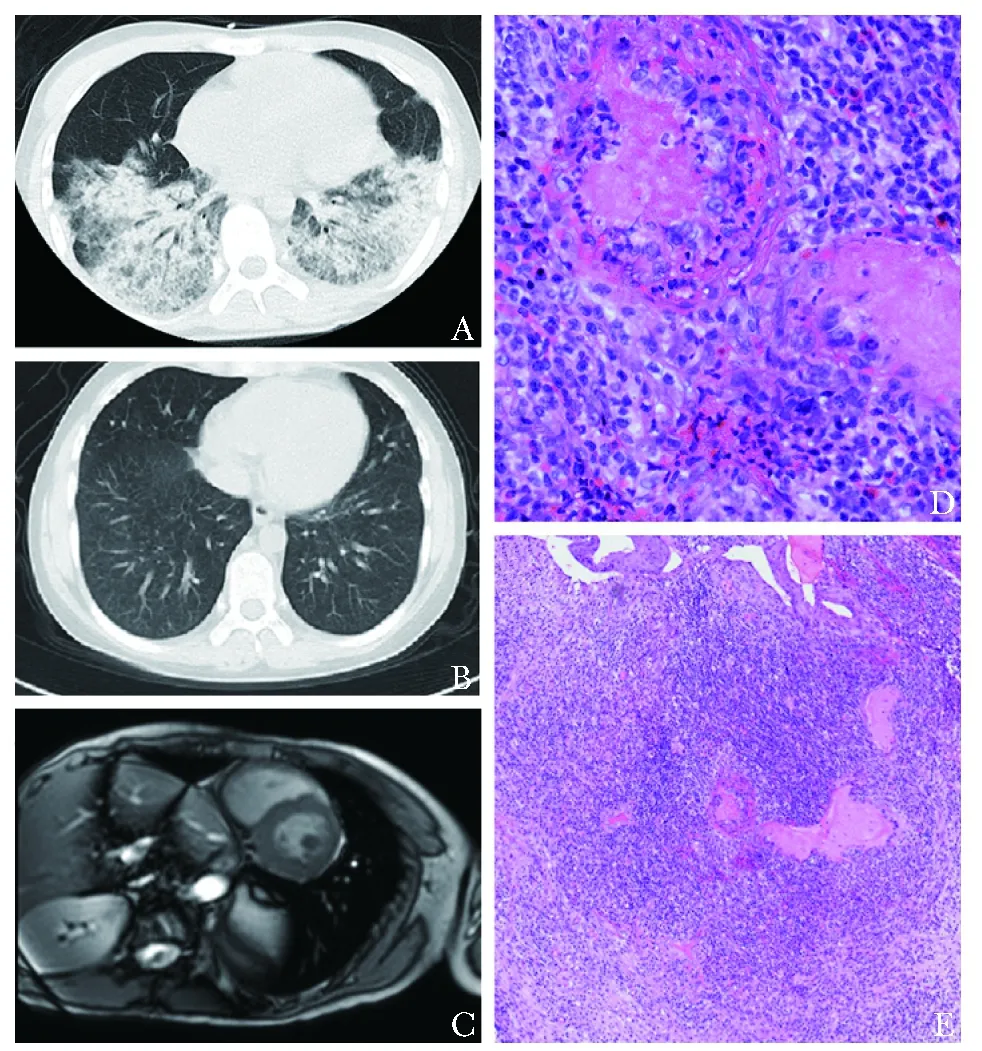
图 1 例5患者检查结果Fig 1 Examination results of case 5
3 讨论
GPA心肌受累表现多样,发生率为3.3%~44%,国内尚无相关病例报道。北京协和医院2007年曾对295例系统性血管炎中存在心肌受累的10例患者进行报道,未发现GPA心肌受累[18],目前国外多为个案报道。 GAP可引起心包炎、心肌炎、心脏传导系统异常,也有冠脉炎、瓣膜病变等[19-27](表4),这些患者部分心电图及超声心动图与本研究病例报告类似,但室间隔增厚并未见报道。本研究患者的心电图也未见恶性心律失常或房室传导阻滞。国外报道的病例中多数存在胸闷、胸痛等心血管相关症状,并有肌钙蛋白水平增高、心电图异常等表现,经进一步检查发现心脏受累,而北京协和医院的心肌受累患者仅有1例出现胸闷症状,容易漏诊。Mcgeoch等[23]对南美517例GPA患者进行研究,发现GAP心脏受累的发生率为3.3%,常见的表现为心肌受累,而本研究GPA心肌受累者占同期住院患者的3.18%。大部分队列研究并未对所有GPA患者行超声心动图检查,因此心脏受累包括心肌受累的发病率可能远远被低估。
ANCA相关性血管炎心脏受累的机制是由于血管炎所致心脏缺血或心肌直接损伤,而GPA的病理变化为坏死性肉芽肿性血管炎,累及中小血管为主的血管炎,临床表现复杂,全身均可受累,因此除了常见的特征性上、下呼吸道和肾脏受累外,也可出现类似心脏受累的征象,具体机制目前尚不明确,推测可能为冠脉炎所致类似冠心病的缺血性损伤或血管炎所致心肌受累。本研究共6例患者接受了冠状动脉增强CT检查,并未见明确的冠脉炎证据,因此推测本研究报道的心肌受累患者多为小血管炎所致的心肌直接损伤,国外个别GPA心肌受累的患者进行了心肌活检,病理变化为中性粒细胞、嗜酸性粒细胞和组织细胞等多种炎性细胞浸润所致心肌炎,局灶性心肌坏死[28]。本研究3例患者因室间隔增厚曾初诊为GPA并发肥厚性心肌病,但积极治疗原发病后超声心动图室间隔增厚消失,心脏形态的可逆性改变进一步证实室间隔增厚应为GPA所致。推测GPA所致室间隔肥厚可能与心肌受累所致的炎症水肿有关,进一步的心肌活检可证实。本研究仅有7例报道,样本量小,不足以代表GPA心肌受累的所有患者特征,对于超声心动图提示节段性室壁运动异常的患者,仍应进一步行冠脉CT血管造影或CMR,以排查冠脉炎或冠心病等冠脉血管病变所致的心肌损伤。与对照组相比,心肌受累组患者有更高的心电图异常率,提示心肌损伤,同时由于心脏受累有更高的BVAS评分,心肌受累患者眼部受累比例更低,原因尚不明确。本研究也尚未明确GPA心肌受累的危险因素和相关机制,有待于进一步大规模的临床研究和发病机制研究加以明确。
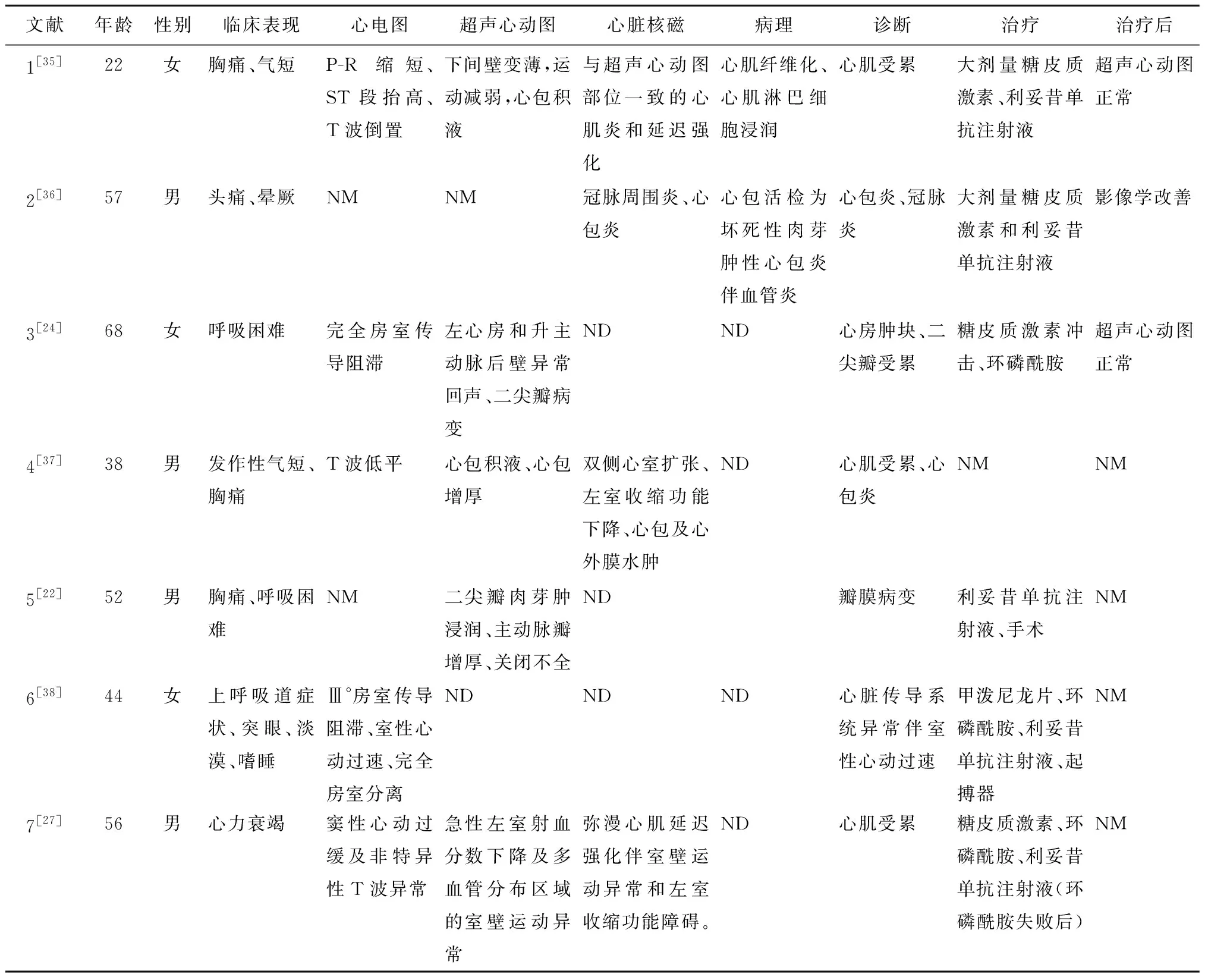
表4 文献中GPA心脏受累个案报道的相关临床表现、辅助检查和治疗Table 4 Clinical manifestations, examination, and treatment outcome of GPA with cardiopathy in literature
本研究GPA心肌受累患者均处在疾病高度活动状态,且均为多系统受累,心脏特异性症状并不突出,起病隐匿,常被忽略,应重视常规心脏受累的筛查,临床上对有心脏特异性症状或心电图异常/心肌酶增高的患者应警惕并发心肌受累。超声心动图检查对于GPA心脏受累的诊断有重要提示作用,安全无创,可行性好,应作为重要筛查手段之一。超声心动图常表现为射血分数下降、室壁运动异常及与肥厚性梗阻/非梗阻性心肌病类似的室间隔增厚,但需与缺血性心肌病等其他心肌病相鉴别。本研究心肌受累患者经原发病治疗后心脏超声检查结果可逆,因而超声心动图也可作为监测治疗效果的重要手段。近年来随着影像学技术的发展,CMR已在临床上广泛使用,对于心脏结构、功能状态的评估及炎症或纤维化状态的区分有较高的临床价值。既往文献提示,典型的GPA心肌受累的CMR除可见到类似于超声心动图的形态结构改变外,血管灌注与否也能明确有无中等血管受累,急性期T1加权像增强后可见水肿、毛细血管渗漏和心肌强化,对于区分心肌病变的急性炎症、慢性纤维化有较好的特异性[26, 29]。本研究仅有2例患者CMR显示结构和功能异常,并未见心肌延迟强化等典型特征,可能与患者行CMR时并未处于心肌病的急性炎症期有关。Pugnet等[30]对GPA患者进行CMR检查,发现61%(19/31)的患者存在异常,可见心脏病变的比率被低估,而金标准心脏/心肌活检风险较高,应用受到限制,因此临床实践中应对更多的疑诊心肌受累患者及时进行CMR检查,提高GPA心肌受累的诊断及鉴别诊断水平。
糖皮质激素联合免疫抑制剂是GPA心肌受累治疗的基石,与既往嗜酸细胞肉芽肿性血管炎(eosinophilic cell granulomatous vasculitis,EPGA)心肌受累严重不良预后报道不同,本研究报道的7例患者经糖皮质激素和免疫抑制剂的应用均得到临床缓解,可能与疾病的早期识别和积极治疗有关,结果与部分其他国外报道类似,即是否有心脏受累对于疾病缓解和预后影响并无影响[23]。本研究末次随访发现,GPA并发心肌受累的复发率为42.9%,国外文献并未涉及相关心肌受累患者复发率的报道,本研究对GPA患者有无心肌受累患者的复发率进行比较,也未发现二者间有统计学差异。研究发现GPA在缓解后复发率为10%~60%,疾病的高复发率可能与多种因素有关,包括ANCA(尤其是PR3滴度)、上下呼吸道受累、金黄色葡萄球菌感染、治疗等有关[32-33]。由于本研究病例数太少,很难总结出复发患者与未复发患者的区别,应进行前瞻性、大规模的临床研究,进一步明确相关因素并采取相应措施。此外北京协和医院既往报道GPA的患者20%死于心力衰竭[34],推测除常见继发心力衰竭的原因外,也可能存在对心肌受累认识不足,不能早期识别相关症状有关,GPA出现晚期心力衰竭者往往无法追溯原因。GPA心肌受累对患者临床预后的影响有待进一步研究,而生物制剂利妥昔单抗注射液在GPA心肌受累治疗中的作用也属空白,有待进一步研究。
本研究为回顾性病例研究,样本量较少,难以避免回顾性研究的偏倚,但GPA心肌受累作为少见疾病,临床表现无特异性,本研究结果可提高临床医生对该疾病的认识,有助于该病变的早期诊断和及时治疗。今后应开展相关疾病的大规模前瞻性队列研究,关注GPA的心脏受累情况,对高危患者进行筛查。
