多模态超声评价颈动脉斑块易损性的多因素分析
2018-10-09余海歌何文张东宁彬阚艳敏魏世纪于腾飞刘梦泽李海欣
余海歌,何文,张东,宁彬,阚艳敏,魏世纪,于腾飞,刘梦泽,李海欣
缺血性卒中具有发病率高、致残率高、死亡率高和复发率高的特点[1]。大动脉粥样硬化是导致心脑血管事件的主要原因之一,约75%的卒中患者发生在颈动脉供血区,约30%的缺血性卒中是由颈动脉易损斑块引起[2]。常规超声是动脉粥样硬化斑块的首选检查方法,常规超声对斑块回声、表面形态等的判断与其稳定性有一定相关性,但准确性欠佳[3-5]。
病理组织学研究证实,斑块内新生血管对判断动脉粥样硬化斑块的易损性起着重要作用[6]。超声造影(contrast-enhanced ultrasonography,CEUS)及超微血管成像(superb micro-vascular imaging,SMI)技术能够显示斑块内新生血管[7]。但在临床中发现,CEUS及SMI显示斑块内新生血管丰富,患者可能并无明显症状,而显示新生血管较少,亦有可能导致急性卒中的发生。如何通过CEUS及SMI成像特点联合常规超声对斑块易损性进行准确评价,是目前超声和临床医生亟待解决的问题。本研究将颈动脉粥样硬化斑块常规超声表现特征及CEUS、SMI成像特点及临床缺血性卒中的相关危险因素作为自变量,经临床判断为颈动脉斑块导致卒中为因变量,明确缺血性卒中的相关危险因素及危险度大小。
1 研究对象与方法
1.1 研究对象 前瞻性连续选择2016年8月-2017年10月在首都医科大学附属北京天坛医院超声科行颈动脉超声检查的患者,依据临床诊断有无缺血性卒中分为症状组和非症状组。入组标准:①斑块厚度≥2 mm,位于分叉处或颈总动脉;②目标斑块同侧颈动脉无狭窄或狭窄率50%~99%;③年龄40~80岁;④患者知情同意。另外,症状组需要满足:患者症状侧为单发动脉粥样硬化斑块,符合同侧脑缺血症状;非症状组需要满足一年内未发生脑缺血症状且经影像学检查排除卒中者。
排除标准:①患心脏疾病、主动脉弓斑块者;②颅内肿瘤、脑出血、颅内血管狭窄或闭塞等颅内病变;③合并恶性肿瘤,心、肺、肾功能不全者;④合并颈椎病者;⑤斑块广泛钙化等因素致图像不清晰者;⑥造影剂过敏或拒绝参加研究者。
1.2 仪器和检查方法 超声检查采用 Toshiba Aplio 500超声诊断仪,11L线阵探头。常规超声选择颈动脉条件,调节机器使图像显示清晰,嘱患者头轻度后仰,偏向对侧。多切面观察斑块,记录斑块厚度、狭窄率、表面形态、内部回声、钙化结节、血栓、极低回声区。狭窄率按照美国超声医师协会共识分4类:狭窄率<50%、50%~69%、70%~99%和闭塞[8]。斑块回声参照Gray Weale等[9]提出的方法分为五类:Ⅰ型:均质低/无回声斑块;Ⅱ型:不均质低/无回声斑块,以低回声为主,高回声面积小于总的斑块面积的25%;Ⅲ型:不均质高回声斑块,斑块以高回声为主;Ⅳ型:均质高回声斑块;Ⅴ型:广泛钙化斑块(此类型由于图像质量差不纳入统计)。表面形态参照De Gray[10]的方法,分为3类:表面规则;表面不规则,有裂隙或凹陷深度及宽度达不到溃疡标准;溃疡斑块(凹陷深度及宽度均≥2 mm)。钙化结节分3类:无钙化结节;钙化结节位于斑块基底或中部;钙化结节位于表面。极低回声区为与管腔回声相似、难以区分的低-无回声区域,按照有无极低回声区分两类。
超声造影采用随机配置的编码反向谐波成像技术,双幅显示。自肘静脉注射造影剂,第1次注射1.6 ml,随即推注5 ml生理盐水,待造影剂浓度减低时,每次补充0.8 ml重复观察。SMI采用随机配备的成像软件,观察并记录斑块表面形态及新生血管分级。CEUS增强程度按照Mattia Cattaneo等[11]的标准对斑块内新生血管进行半定量分析:0级:斑块内无明显新血管形成;1级:斑块内少量、局限的新生血管形成;2级:斑块内中量新生血管形成;3级:大量、在斑块内存在搏动的动脉新生血管。0~1级为低增强,2~3级为高增强。SMI显示新生血管分级采用相同方法。
采用盲法对患者进行资料记录和症状分组。记录每一例患者的基本信息(姓名、年龄、性别)、体质指数(body mass index,BMI)、症状、临床基础疾病、吸烟指数、饮酒指数、实验室检查资料(血浆甘油三酯、总胆固醇、载脂蛋白、血糖等)、收缩压及舒张压(住院患者以入院查体为准,门诊患者如无查体记录在超声检查前测量3次取平均值)。体重指数=体重(kg)/身高平方(m2),吸烟指数=每日吸烟量(支/天)×吸烟年数,饮酒指数=日饮白酒量(g/d)×饮酒年数[12]。
1.3 统计学方法 采用SPSS 20.0统计分析软件。符合正态分布的计量资料以(表示,不符合的采用中位数表示。对临床危险因素和颈动脉粥样硬化斑块声像图特征分别进行单因素分析,将差异有统计学意义的因素纳入多因素Logistic回归。超声联合诊断的价值采用ROC曲线,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 收集患者92例,共105个斑块,其中9例患者双侧均单发斑块且明确一侧有症状,入组症状组,4例无症状患者为双侧斑块。症状组50例,男35例,女15例,年龄48~80岁,平均(64.85±7.44)岁,共59个斑块。非症状组42例,男26例,女16例,年龄42~75岁,平均(61.86±7.60)岁,共46个斑块。
2.2 临床危险因素单因素分析 症状组吸烟指数、血清总胆固醇、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)高于非症状组,血清载脂蛋白B低于非症状组,差异有统计学意义(表1)。性别、年龄、BMI、血压等组间差异无统计学意义。
2.3 颈动脉斑块超声特征单因素分析 单因素分析显示,与非症状组相比,症状组斑块CEUS增强程度更高(χ2=22.494,P<0.001)、SMI新生血管更多(χ2=8.186,P=0.041)、SMI及CEUS图像斑块表面形态更不平整(χ2=10.367,P=0.006;χ2=6.865,P=0.032),钙化结节更多且位置更趋近于斑块表面(χ2=11.223,P=0.004),差异均有统计学意义。狭窄率、斑块回声、斑块极低回声区等组间差异无统计学意义。本研究中斑块伴血栓仅2例,故不纳入统计分析。
2.4 多因素分析结果 将血清总胆固醇、LDL-C、载脂蛋白B以正常值上限为界值纳入Logistic回归,吸烟指数ROC曲线得出界值纳入多因素Logistic回归。血清总胆固醇以正常值上限5.2 mmol/L,高胆固醇者症状组占64.3%(9/14),血清LDL-C以正常值上限4.14 mmol/L,高LDL-C者症状组占80%(4/5)、血清载脂蛋白B以正常值上限男1.26 mmol/L,女1.12 mmol/L,高载脂蛋白B者症状组占71.4%(5/7)。吸烟指数以755为界值症状组占83%(15/18)。多分类变量纳入Logistic回归前先转换为二分类变量:CEUS和SMI显示新生血管以<2级为低增强/少量,≥2级为高增强/大量;斑块表面形态分为规则、不规则(包括不规则、溃疡)两类;斑块钙化结节分为位于表面和不位于表面(无钙化、钙化位于基底部或中部)两类。
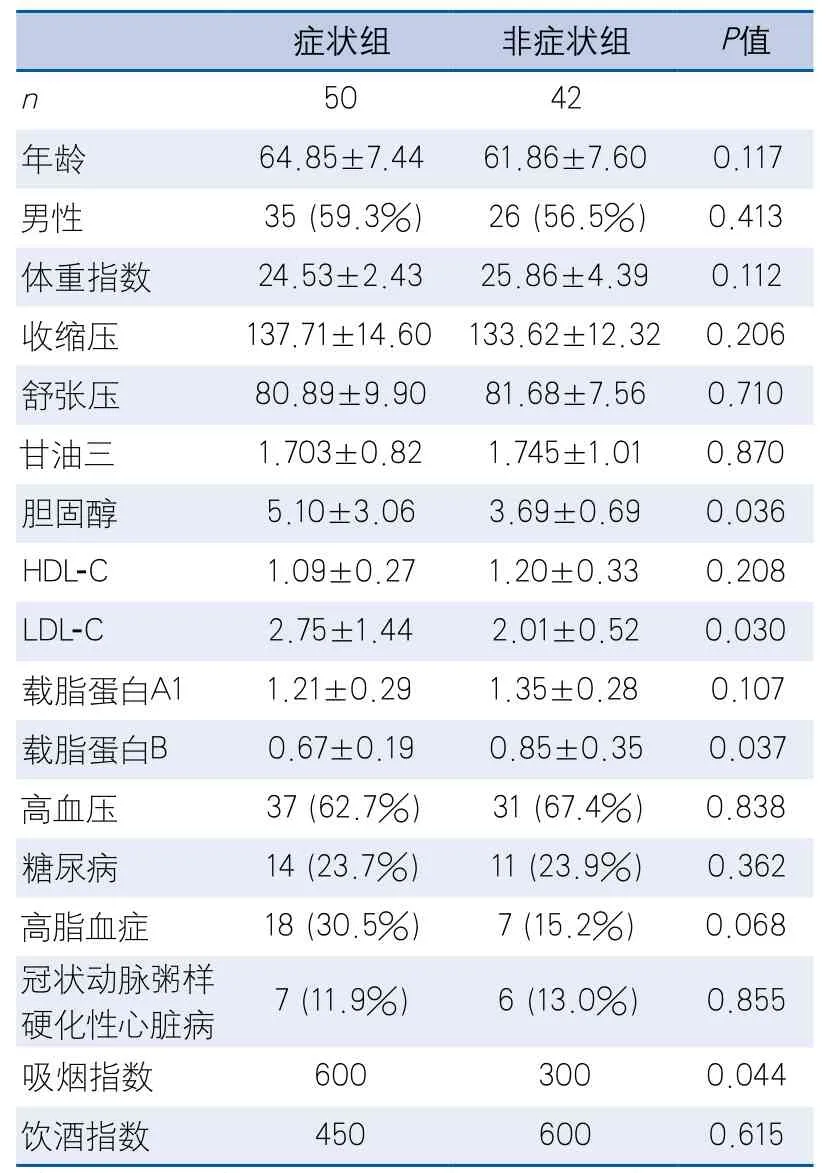
表1 症状组及非症状组患者一般资料比较
多因素Logistic回归分析显示,超声造影高增强、SMI显示斑块表面不规则、表面钙化结节提示颈动脉粥样硬化斑块易损,是预测缺血性卒中的独立危险因素,SMI显示斑块内新生血管、血清胆固醇、LDL-C、载脂蛋白B、吸烟指数与卒中症状无相关性(表2)。
2.5 超声联合诊断颈动脉斑块ROC曲线 对Logistic回归得出参数采用ROC曲线分析,结果显示超声造影增强程度、SMI显示斑块表面形态、钙化结节ROC曲线下面积分别为0.723(P<0.001)、0.657(P=0.006)、0.679(P=0.002),联合诊断曲线下面积0.837(P<0.001)(图1,表3)。联合诊断易损斑块准确性高于上述任一参数。
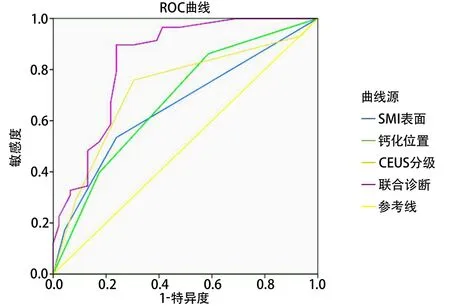
图1 联合诊断与单因素诊断ROC曲线
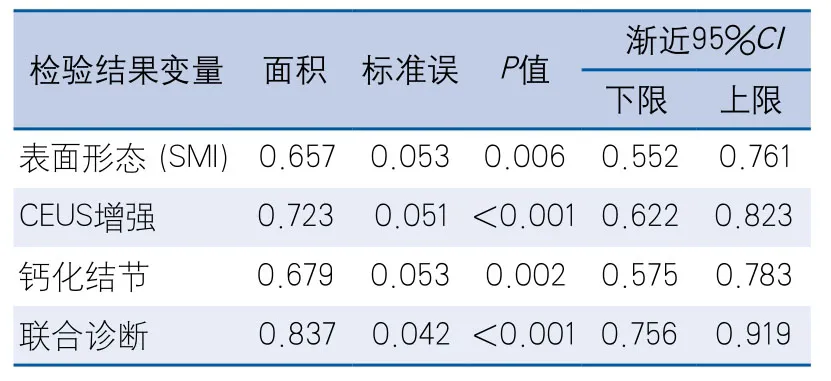
表3 各声像图参数级联合诊断ROC曲线分析
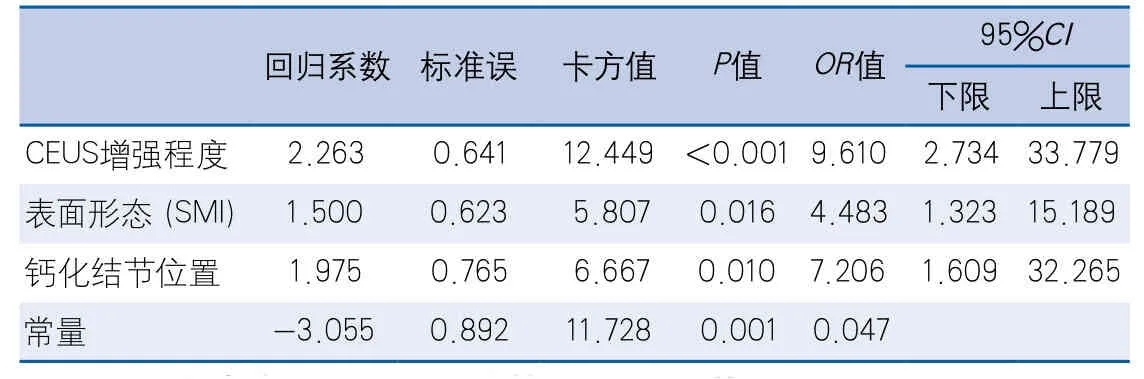
表2 症状性颈动脉斑块声像图特征Logistic多因素回归分析
超声造影高增强、SMI斑块表面形态、表面钙化结节识别易损斑块,预测缺血性卒中的灵敏度分别是75.8%、50.1%和40.7%,特异度分别为67.4%、76.1%和82.6%。应用上述3项声像图特征进行联合诊断,超声造影低/无增强的斑块,伴有溃疡或裂隙,或表面形态不规则同时含表面钙化结节的,联合诊断灵敏度达90.5%,特异度为62.0%。
3 讨论
本研究中,单因素分析显示临床卒中危险因素中血清总胆固醇、LDL-C、载脂蛋白B、吸烟指数在缺血性卒中症状组和非症状组中有显著差异,但是在多因素Logistic回归分析中,均与卒中症状无相关性。可能由于血糖、血压等临床因素动态变化,稳定性差,且长期作用才可能对动脉粥样硬化斑块易损性产生影响。不过上述卒中相关的血管危险因素仍可作为辅助指标和筛查人群选择的依据。
本研究中,CEUS增强程度0~3级的颈动脉粥样硬化斑块中,卒中发生率有逐渐增加的趋势。Huang等[13]对20项超声造影的定性与定量研究进行了Mata分析,认为超声造影是一项可靠的诊断斑块内新生血管的非侵入方式,合并比值比(odds ratio,OR)为7.06,与本研究相一致。目前CEUS尚未有统一的诊断标准,定量分析和视觉分级需进行标准化,以提高可靠性并减少技术异质性。
本研究SMI对斑块内新生血管的显示在单因素分析中与症状性斑块有相关性,但Logistic回归中无统计学意义。SMI显示新生血管特异性与CEUS相似,但敏感性显著低于CEUS,对新生血管较少的病例检出率相对较低。可能由于其受血管搏动影响较大,新生血管与动脉粥样硬化斑块内细小钙化不易区分,对操作者要求更高有关。尽管CEUS诊断斑块内新生血管效能优于SMI,但作为有创检查,造影技术的应用具有一定的局限性,而SMI可作为补充方法。
既往有研究者把低回声斑块称为软斑,把高/强回声斑块称为硬斑,低回声斑块表现出较高程度的增强[14]。但灰阶超声以斑块回声强弱评价斑块的稳定性有一定局限性。前期研究发现,脂质核心、胶原、纤维帽均可显示为低回声,说明回声不能真正反映斑块的成分。在本研究中,低回声斑块更倾向于与症状相关,但差异并无统计学意义,可能是由于分组方法不同及本研究排除了V型广泛钙化斑块导致。
动脉内不规则甚至溃疡斑块使血液产生小的涡流,血小板更容易聚集形成血栓,继而脱落形成栓子[15]。有研究表明斑块表面不规则是同侧缺血性卒中发生的独立预测因子,与本研究结果相一致[16]。缺血性卒中症状组中,SMI对斑块表面细微不规则的显示率为33.9%(20/59)及清晰度25.4%(15/59),较CEUS更好,原因可能是CEUS采用低机械指数(0.10~0.14),SMI条件采用最大机械指数(1.2),机械指数与图像分辨率正相关,SMI又可将低速血流信号从组织运动信号中分离,因此具有高分辨率和高敏感度。
以往认为钙化是动脉粥样硬化斑块稳定性的保护性因素[17]。但近期研究认为,斑块内接近纤维帽或通过纤维帽向管腔突出的钙化结节是易损斑块的特征之一,美国心脏协会也将斑块表面钙化结节作为判断易损斑块的一项标准[18]。本研究中,钙化结节与卒中症状有显著相关性。目前对钙化诱导斑块破裂的机制尚不明确,表面钙化可能造成斑块表面形态的改变,突出于斑块表面的钙化结节可增加局部组织的应力,提高斑块的不稳定性,也有学者认为,早期钙化的斑块在不同密度组织的交界最易破裂,而当钙化融合后交界面减少,破裂发生率也随之降低[19]。
本研究也存在一些不足,对颈动脉粥样硬化斑块采用卒中症状进行分组,混杂因素难以完全避免;对斑块部分特征的分析不够详细;并未对患者进行随访来验证其对卒中的风险预测能力。由于动脉粥样硬化斑块成分的多变性及其机制的复杂性,任何一项特征独立预测斑块易损性准确度有限,将颈动脉斑块的病理学、影像学表现与临床表现有机结合起来,必将推动卒中诊断和治疗的发展,对患者风险分层管理和个体化治疗具有重大意义。
【点睛】利用超声微血管成像和造影技术联合诊断颈动脉粥样硬化斑块,可以更精确地分析斑块不稳定的特点,评估其引起缺血性卒中的风险。
