基于组合色谱技术的蓝莓果实中花色苷元制备
2018-10-08王二雷陈晶晶刘彦君刘静波
王二雷,陈晶晶,刘彦君,刘静波*
(吉林大学食品科学与工程学院,吉林 长春 130062)
花青素作为一种自然界中广泛存在的水溶性天然色素,安全、无毒,具有多种营养与保健作用,如增强视力、抗炎症、抗氧化、抗癌、预防心血管疾病等,在食品、医药、化妆品等领域有着巨大的应用潜力[1-3]。到目前为止,自然界中现已发现500余种的衍生物,多以糖苷或酰基化的花色苷形式存在[4],少以游离花色苷元形式存在。现已发现的花色苷元有23 种,而最常见的有6 种,即飞燕草素、矢车菊素、牵牛花素、芍药色素、天竺葵素、锦葵色素[5]。已有众多研究报道表明,黄酮苷元的抗氧化活性要强于黄酮苷[6],花青素作为一种类黄酮类化合物,理论上也应具备此种特点,但受花色苷元存在稳定性差、制备工艺不成熟性等因素影响,目前仅有少量关于此方面的报道,如已有研究证实花色苷元(而非糖苷形式)能够显著地抑制体内P-糖蛋白表达水平,从而起到治疗肿瘤的作用[7]。此外,前期研究也证实了花色苷元粗提物在诱导B16-F0肿瘤细胞凋亡方面明显强于花色苷形式[8]。为深入探明花色苷元更多潜在功能活性、阐明其化学结构与功效的关系、开发其多个领域的应用价值,研究花色苷元的制备技术具有重要的意义。
截止到目前为止,国内外已有大量关于花青素分离纯化技术方面研究,如大孔树脂层析技术、高效液相色谱技术、高速逆流色谱技术、膜过滤技术、毛细管电泳技术等[9-11],但大多局限于花色苷形式,针对花色苷元形式的研究报道则非常少见。由于蓝莓果实中不仅花青素含量非常丰富,而且包含5 种最常见的花色苷元单体[12-14](图1),因此,本实验以蓝莓果实为原料,采用液液萃取、大孔树脂层析、固相萃取、高效液相色谱等组合的色谱技术对花色苷元的分离纯化技术展开研究,以期为花色苷元的规模化制备提供新的数据依据和实验基础。

图1 蓝莓果实中常见的花色苷、花色苷元以及相关化学结构式Fig. 1 Representative anthocyanins and anthocyanidins in blueberries as well as their chemical structures
1 材料与方法
1.1 材料与试剂
野生蓝莓果实采自于吉林省长白山地区,果实于-20 ℃条件下冷冻保存,备用。
甲酸、甲醇(均为色谱级) 德国Merck公司;乙醇、乙酸乙酯、盐酸(均为分析级) 北京化工厂;Amberlite XAD-7HP大孔树脂(粒径20~60 目)、矢车菊素-3-O-葡萄糖苷(相对分子质量484.84,纯度≥98%)、矢车菊素(相对分子质量322.7,纯度≥97%) 美国Sigma公司;Sep-Pak C18固相萃取柱(500 mg) 美国Waters公司。
1.2 仪器与设备
LC-6AD半制备型高效液相色谱仪(配备半制备型C18色谱柱(20.0 mm×250 mm,5 μm)、手动进样器、5 mL定量环)、LC-30AD分析型高效液相色谱仪 日本岛津公司;2695高效液相色谱-质谱联用技术仪、Symmetry Shield C18色谱柱(4.6 mm×150 mm,5 μm) 美国Waters公司;Masslynx软件(4.1版本)。
1.3 方法
1.3.1 蓝莓花色苷粗提物的制备
取1 kg野生蓝莓果实置于组织捣碎机中粉碎,用2 L 70%乙醇溶液(含0.1%盐酸)浸提24 h,在避光、室温条件进行。将浸提液于3 000 r/min离心5 min,滤液部分进行回收,滤渣进行2 次浸提,合并收集到的滤液,利用旋转蒸发仪进行浓缩,温度50 ℃,浓缩至体积约300 mL。将花色苷浓缩液转移至分液漏斗,用等体积的乙酸乙酯萃取3 次,收集水层。取50 mL水层部分上大孔树脂柱(Amberlite XAD-7HP,2.6 cm×50 cm),先用2 L 0.01%盐酸溶液进行洗脱,再用500 mL 40%乙醇溶液(含0.01%盐酸)进行洗脱,收集乙醇洗脱液部分,浓缩,制得蓝莓花色苷浓缩液,避光保存、备用。
1.3.2 蓝莓花色苷元的酸水解
花色苷在强酸、高温条件下能够脱除糖苷,降解成花色苷元形式。花色苷的酸水解方法常用于辅助鉴定天然产物中花色苷的化学结构,但关于花色苷元的制备方面还较少见,本研究中花色苷水解方法建立在文献[15-16]已有水解方法基础上,并进行适当的调整。将蓝莓花色苷粗提物置于150 mL的带盖锥形瓶中,加入50 mL的2.5 mol/L盐酸溶液,并加入10 mL左右的乙醇用于提高花色苷元产物的溶解度,置于恒温水浴锅中,于95 ℃加热1.5 h,然后迅速冷却至常温。将花色苷元水解液进行旋转蒸发浓缩处理,除去少量的盐酸及乙醇,制得蓝莓花色苷元粗提液。分别将浓缩前后的花色苷元粗提液用70%乙醇溶液(含3%甲酸)稀释5 倍,从中取10 μL,过0.22 μm微孔滤膜,利用高效液相色谱法检测其单体构成。
1.3.3 蓝莓花色苷元的固相萃取
首先用3.0 mL乙醇、3.0 mL 0.01%盐酸溶液冲洗Sep-Pak C18固相萃取柱,完成柱体的活化过程。取1.5 mL蓝莓花色苷元粗提液上固相萃取柱,先用6.0 mL的0.01%盐酸溶液进行洗脱,除去大部分水溶性杂质,再用3 mL 70%乙醇溶液(含0.01%盐酸)进行洗脱,收集乙醇部分洗脱液。将洗脱液在不超过50 ℃条件下进行旋转蒸发浓缩,再进行真空冷冻干燥,制得蓝莓花色苷元提取物粉末。将一定量花色苷元提取物用70%乙醇溶液(含3%甲酸)溶解,从中取10 μL,过0.22 μm微孔滤膜后,利用高效液相色谱法检测其单体构成及纯度。
1.3.4 高纯度蓝莓花色苷元的制备
经固相萃取后,花色苷元提取物为几种花色苷元单体混合物的形式,普通的色谱纯化手段难以达到分离单体的目的,本实验采用半制备型高效液相色谱技术进行花色苷元单体的分离。半制备高效液相色谱的操作参数基于分析型高效液相色谱条件,并进行适当的调整。所用流动相构成为色谱级甲醇(A相)及3%甲酸溶液(B相),梯度洗脱程序:0 min,85% B;0~3 min,85%~80% B;3~10 min,80%~75% B;10~55 min,75%~30% B;55~60 min,30% B;60~65 min,30%~85% B;65~110 min,85% B。检测波长530 nm,流速2 mL/min,进样量5 mL。用3%甲酸溶液溶解蓝莓花色苷元提取物,配制成2 mg/mL的溶液,经0.45 μm微孔滤膜过滤后上样。根据每一种花色苷元单体在色谱图上的出峰时间,收集洗脱液,多次进样后,收集足量的花色苷元单体洗脱液。为进一步提高花色苷元单体的纯度,将花色苷元单体洗脱液再次进样,收集单体峰对应的洗脱液,浓缩、干燥,制得不同花色苷元单体。取1 mg花色苷元单体样品,用3%甲酸溶液配制成0.1 mg/mL的检测液,过0.22 μm微孔滤膜后,利用高效液相色谱法检测其单体构成及纯度。
1.3.5 花色苷元的高效液相色谱分析
花色苷元粗提物及单体样品中的苷元种类及结构需要借助分析型高效液相色谱手段进行检测。高效液相色谱的运行参数建立在实验室之前对蓝莓花色苷研究基础上[17],并略有所调整。流动相由A相(色谱级甲醇)和B相(3%甲酸溶液)组成。梯度洗脱度程序:0 min,85% B;0~5 min,85% B;5~10 min,85%~80% B;10~22 min,80%~75% B;22~32 min,75% B;32~39 min,75%~30% B;39~45 min,30% B;45~55 min,30%~85% B;55~60 min,85% B。检测波长530 nm,流速0.5 mL/min,进样体积10 μL。由于大部分的花色苷元单体在可见光区拥有近似的最大吸收峰,则样品中总花色苷元的含量均可折合成矢车菊素标准品的等价物。通过配制1~200 μg/mL的矢车菊素标准品梯度溶液,以不同质量浓度梯度标准品溶液色谱峰的峰面积为纵坐标,以质量浓度为横坐标,绘制标准曲线,再通过代入样品中花色苷元总峰面积计算其质量浓度,进而得出其含量或纯度。
1.3.6 花色苷元的质谱分析
花色苷元样品溶液经0.22 μm微孔滤膜过滤后,采用高效液相色谱-质谱联用技术进一步明确花色苷元的化学结构[18],采用矢车菊素苷元标准品进行仪器操作参数的优化及样品中苷元的定性分析。高效液相色谱部分的运行条件借鉴1.3.5节中的参数条件,但又有所区别,如其中流动相中B相的组成为0.5%甲酸溶液,其目的是为了提高碎片离子的电离度。质谱部分的主要参数条件:离子源为正离子模式,毛细管电压3.0 kV,锥孔电压10.0 V,锥孔气流量80 L/h,离子源温度110 ℃,脱溶剂化温度380 ℃,脱溶剂化流速600 L/h,离子扫描范围为m/z 200~1 000。
1.4 数据统计分析
2 结果与分析
2.1 蓝莓花色苷粗提物的纯化结果
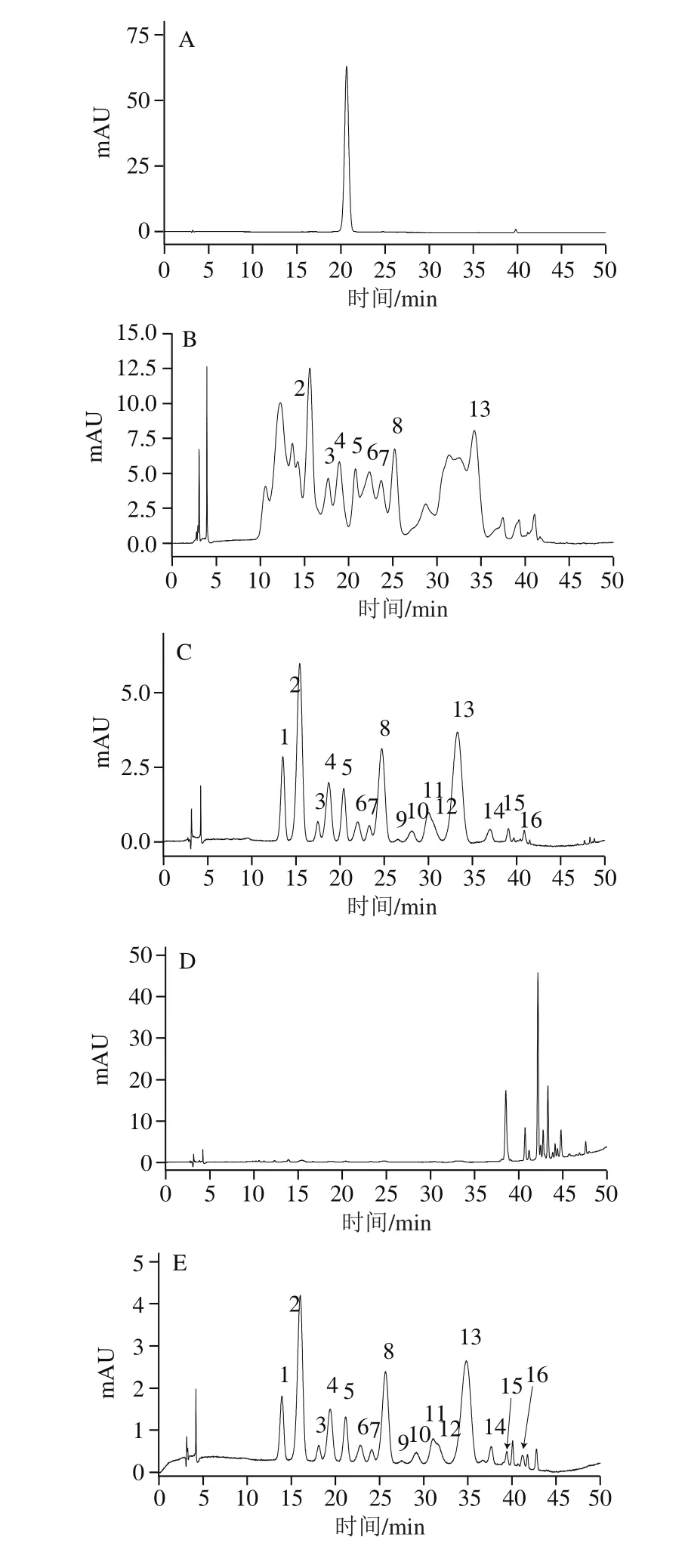

图2 花色苷标准品及蓝莓花色苷样品的高效液相色谱检测结果Fig. 2 HPLC profiles of anthocyanin standard and blueberry anthocyanin-rich extracts
野生蓝莓果实中除含花色苷类物质外,还含有大量的糖类、有机酸类、果胶、弱极性的黄酮类物质[19],这些杂质的存在会影响花色苷的纯度,必须通过纯化手段去除。未经纯化的蓝莓花色苷提取液的高效液相色谱分析结果如图2所示,每种花色苷的名称已在前期研究工作中进行了报道[20],所有花色苷单体的鉴定均基于其紫外-可见光谱特征、高效液相色谱中与标准品所对应的保留时间、高效液相色谱-质谱联用技术中的碎片离子的质荷比(m/z),以及已有文献[21]的相关报道。蓝莓果实中至少包括16 种糖基化形式的花色苷单体(图2C),且均由5 种基本的苷元(飞燕草素、矢车菊素、牵牛花素、芍药色素和锦葵色素)和4 种糖苷组成(半乳糖苷、葡萄糖苷、阿拉伯糖苷及木糖苷)组成。大体上,飞燕草素、锦葵色素和芍药色素为蓝莓果实中含量最丰富的3 种苷元形式,而矢车菊素和芍药色素则相对含量较少。图2B及2C分别比较了4 h和24 h时的提取结果,短时间(4 h)的提取并不能使聚合状态的花色苷转化成游离形式,延长提取时间(24 h)则能实现花色苷单体的分离,从而更好地发挥蓝莓果实的营养价值及潜在的健康益处[22]。
花色苷的纯化主要通过乙酸乙酯萃取及大孔树脂纯化实现[23]。在乙酸乙酯萃取阶段,大部分弱极性的黄酮可留在乙酸乙酯层,在水层与乙酸乙酯层之间会聚集一定量的果胶类物质,通过萃取手段能有效地去除这两部分杂质。在大孔树脂的水洗脱阶段,花色苷粗提物中水溶性还原糖类、蛋白类、有机酸类等都能被洗脱下来,在40%乙醇溶液的洗脱阶段,大部分的花色苷类都能被洗脱下来,但柱体中仍然残留少量的弱极性黄酮类物质,这部分杂质虽然不会对已经洗脱出来的花色苷造成影响,但会对再次上样的花色苷的纯化产生影响,因此,本实验采用80%~100%乙醇溶液洗脱出这部分残留的黄酮类物质。通过比较纯化前(图2B)与纯化后(图2E)的花色苷单体构成得出,仅有少量花色苷单体的峰面积比例产生了波动(表1),说明此阶段的纯化过程未破坏果实中花色苷的原有构成。通过对比纯化前(图2D)与纯化后(图2F)花色苷样品(360 nm)中黄酮类杂质的变化情况得出,经过纯化的花色苷提取物中已经不含有黄酮类杂质。以上结果表明,乙酸乙酯萃取及Amberlite XAD-7HP大孔树脂层析步骤能有效分离蓝莓花色苷样品。

表1 蓝莓花色苷提取物大孔树脂纯化前与纯化后的高效液相色谱鉴定结果(530 nm)Table 1 Anthocyanins identified by HPLC-DAD at 530 nm in crude and purified extracts
2.2 蓝莓花色苷元提取物的纯化结果
采用强酸水解花色苷,能够使花色苷的苷元部分与糖苷部分分离,从而释放出花色苷元。由于花色苷的种类繁多,导致其结构鉴定过程较为繁琐,而经过酸水解制备出的花色苷元种类非常有限,通过早期对花色苷元种类的鉴定能够大大简化花色苷的鉴定过程。常见的花色苷元有6 种,分别为飞燕草素、矢车菊素、牵牛花素、芍药色素、天竺葵素、锦葵色素[24-25]。因此,酸水解方法常用于天然产物中花色苷种类的初步鉴定,到目前为止,国内外除将酸水解方法用于辅助鉴定花色苷种类的报道外,开展花色苷元分离纯化方面的研究报道并不多见,本研究在酸水解工艺的基础上,开展花色苷元的深入纯化工作。花色苷元标准品矢车菊素的液相色谱检测结果见图3A,其保留时间为40.7 min。蓝莓花色苷酸水解液的液相图谱如图3B所示,共得到5 个色谱峰。通过比较5 个色谱峰对应的紫外-可见光谱曲线(图4)可知,5 种单体在280 nm及530 nm波长均有最大吸收峰,与花青素类化合物特征图谱相吻合[26],说明这5 种单体均属于花青素类物质。通过对比标准品保留时间(40.7 min)及前期已有的蓝莓花色苷元方面的研究报道[27],图3B中5 种单体分别对应飞燕草素、矢车菊素、牵牛花素、芍药色素及锦葵色素。通过对比5 种单体在色谱图上的峰面积比例(图5)得出,3 种主要的单体(飞燕草素、牵牛花素及锦葵色素)占总花色苷元构成的83.8%,这3 种单体可作为后期分离纯化的重点。此外,由图3B可知,蓝莓中16 种花色苷均已经彻底转化成苷元形式,表明当前水解条件的可操作性较强。

图3 花色苷元标准品及蓝莓样品的高效液相色谱检测结果(530 nm)Fig. 3 HPLC profiles of anthocyanidin standard and blueberry anthocyanidin-rich extracts at 530 nm


图4 花色苷元标准品及蓝莓花色苷酸水解后得到的5 种单体的紫外-可见光谱图Fig. 4 UV-visible spectra of mixed anthocyanidin standards and five anthocyanidins from acid hydrolysis of blueberry anthocyanin extract
蓝莓花色苷的酸水解过程不仅产生了花色苷元,而且引入了其他杂质,如生成的还原糖类、盐酸残留物及其他反应副产物。为除去这些杂质,本实验先后采用旋转蒸发仪浓缩步骤及固相萃取步骤。旋转蒸发过程既能浓缩花色苷元溶液,又能导致部分盐酸的挥发,从而制得较纯的花色苷元浓缩液(图3C)。固相萃取技术为一种快速脱除样品中杂质的前处理方法[28-29],本实验中采用C18固相萃取小柱进行花色苷元的除杂操作[30]。花色苷元浓缩液上样后,采用0.01%盐酸溶液能够有效地脱除苷元样品中残留的还原糖类及其他水溶性杂质,花色苷元则通过70%乙醇溶液(含0.01%盐酸)洗脱下来,苷元洗脱液的液相图谱如图3D所示,通过比较酸水解后、浓缩后及经固相萃取柱纯化后的花色苷元构成(图5)得出,此纯化过程对花色苷元的整体构成影响不大,仅飞燕草素及锦葵色素的比例构成略有变化。将收集到的花色苷元洗脱液浓缩、冷冻干燥后,采用高效液相色谱法,在530 nm波长处对花色苷元的纯度进行分析,测得其纯度为70.2%。鉴于大孔树脂Amberlite XAD-7HP与固相萃取柱C18同属于柱色谱分离范畴,后期比较2 种柱色谱分离花色苷元的差异得出,大孔树脂的载样量大、分离时间长,而固相萃取柱载样量小、分离时间短,从整体上来说,固相萃取更简单、高效,能在数分钟内达到纯化花色苷元的目的。

图5 不同蓝莓花色苷元样品中5 种单体的高效液相色谱中峰面积比例结果Fig. 5 Comparison of HPLC-DAD peak area ratios between five anthocyanidin monomers in different blueberry anthocyanidin samples
2.3 蓝莓花色苷元的单体制备结果
大孔树脂层析及固相萃取技术能使花色苷元与其他杂质得到很好的分离,但却不能使不同花色苷元单体间分离,这是由于花色苷元单体间的化学结构及极性非常相似[31]。通过比较蓝莓花色苷元5 种单体在液相色谱图上的差别(图3D)可知,除芍药色素与锦葵色素保留时间相近外,其他3 种花色苷元均有较好的分离度,因此,本实验进一步采用半制备型高效液相色谱分离花色苷元单体[32-33]。半制备液相色谱参数在分析型液相色谱参数基础上进行适当调整,优化了梯度洗脱程序、总运行时间、流速等参数。将经过固相萃取的花色苷元样品进行半制备液相色谱分离后,所得结果如图6A0所示,在68~80 min内共得到4 种花色苷元组分,每种色谱峰均出现了平顶现象,这是由于色谱柱载样量过高所导致,但并不影响不同苷元单体间的分离与洗脱液的收集。在制备花色苷元单体的过程中发现,花色苷元单体的纯度越高,其化学结构受周围环境的影响越敏感,推测其出现化学构型发生了转变或降解,此部分实验内容尚需后续深入研究加以证实。因此选择适宜的花色苷元单体制备条件非常关键,如操作过程中需要全程控制在低pH值、低温、避光环境等条件下进行。


图6 蓝莓花色苷元提取物的半制备级和分析级高效液相色谱的分离结果(530 nm)Fig. 6 Semi-preparative and analytical HPLC profiles of fractions 1 to 4 of blueberry anthocyanidin extract at 530 nm
为提高花色苷元的纯度,将每种花色苷元单体的洗脱液进行再次进样(图6B0~6E0),将收集到的4 种苷元组分洗脱液浓缩、冻干,再用分析型高效液相色谱(图6B1~6E1)及高效液相色谱-质谱联用技术检测单体的种类及纯度(图7)。经鉴定,采用半制备液相色谱分离后,所得组分一为飞燕草素,对应图6B1中36.2 min色谱峰及图7A中质谱离子[M+](m/z)303.2;组分二为矢车菊素,对应图6C1中40.7 min色谱峰及图7B中质谱离子[M+](m/z)287.2;组分三为牵牛花素,对应图6D1中色谱峰(40.7 min及图7C中质谱离子[M+](m/z)317.2;组分四由芍药色素及锦葵色素两种单体成分构成,其中芍药色素对应图6E1中色谱峰43.2 min及图7D中质谱离子[M+](m/z)301.3,锦葵色素对应图6E1中色谱峰43.5 min及图7D中质谱离子[M+](m/z)331.2。经过浓缩、冻干处理后,最终从1 kg蓝莓果实原料中制得飞燕草素单体24.2 mg(纯度98.2%)、矢车菊素单体6.6 mg(纯度96.3%)、牵牛花素单体8.9 mg(纯度92.6%)、锦葵色素单体17.4 mg(纯度90.5%)。鉴于本实验所制得的花色苷元纯度均高于90%,且制备过程中所用的试剂均属常规材料,所用纯化技术以常用色谱手段为主,所用工艺参数较为温和,由此表明,当前的苷元单体制备方法具备较高的可行性,能够为花色苷元产品的规模化生产提供一定的参考依据。

图7 半制备高效液相色谱制得的4 种蓝莓花色苷元组分的质谱检测结果Fig. 7 Mass spectra of four blueberry anthocyanidin fractions from semi-preparative HPLC
3 结 论
以长白山野生蓝莓果实为原料,运用组合色谱手段进行花色苷元的制备技术研究。首先运用液液萃取及Amberlite XAD-7HP大孔树脂层析技术分离出蓝莓花色苷粗提液,再利用酸水解技术制得蓝莓花色苷元水解液,经旋转蒸发浓缩后,运用固相萃取技术制得纯度为70.2%的蓝莓花色苷元提取物。采用半制备型高效液相色谱技术从蓝莓花色苷元提取物中成功分离得到4 种纯度为90%~99%的花色苷元单体。本研究中制备花色苷元的工艺可操作性强,能够为花色苷元的规模化生产提供一定的参考依据。考虑到花色苷元今后的应用领域主要在功能食品、药品、化妆品等领域,花色苷元的生产成本、产品得率、溶剂残留、安全性等方面的要求,本研究还需进一步优化工艺方法,以便拓宽花色苷元的应用领域,发挥其最大应用价值。
