柱前衍生化HPLC法分析枸杞多糖中单糖组成
2018-10-08符梦凡赵一帆阎卫东
符梦凡,赵一帆,阎卫东*
(浙江大学化学系,浙江 杭州 310027)
枸杞(Lycium barbarum L.)又名枸杞子、西方雪果,是茄族植物枸杞的成熟果实,是一种传统的药食同源植物。枸杞主要产于我国新疆、青海、宁夏等地,国外主要分布于日本、朝鲜、欧洲以及北美等地。《本草纲目》中记载,枸杞有坚筋骨、补精气诸不足、明目安神等功效。枸杞内含有丰富的有益健康的物质,如维生素、多糖、生物碱类、有机酸类、黄酮类、玉米黄质、酸浆果红素、甾醇类、酚类、内酯类等[1-3]。其中枸杞多糖是一种重要的生物活性物质,具有促进身体健康的医疗功效,如降血脂[4]、降血糖[5]、清除活性氧自由基[6-7]、激发树突细胞的免疫原性[8]、激发巨噬细胞的抗氧化性[9]、抑制肝癌细胞QGC7703的增殖[10]。近年来对多糖的探索研究也成为了医学界和营养学界的研究热点[11-13]。多糖的结构分析主要以一级结构为主,即多糖的单糖残基组成、相邻糖基之间糖苷键的连接方式、糖链的分支情况以及异头物的构型等[14-16]。Liu Wei等[17]研究了枸杞多糖p-LBP的结构表征、化学降解、酶解以及链构象。Tang Huali等[18]研究了枸杞多糖LBP3a和LBP3b的分子质量、单糖物质的量比和降糖作用。Gong Guiping等[19]研究了枸杞多糖LBLP5-A的结构表征和抗氧化作用。但是对枸杞多糖整体的单糖组成分析鲜见报道。
枸杞多糖是一种健康食品原料,常被制成胶囊、压片进行售卖。然而市售枸杞多糖提取物质量良莠不齐,一些厂家可能会通过非法添加一些不含功能成分的其他来源多糖来降低生产成本,导致其保健功效降低,阻碍了枸杞多糖产业的发展,同时也损害了消费者的利益。多糖化合物种类众多、性质相似,常采用硫酸-苯酚、硫酸-咔唑、硫酸-蒽酮等显色体系经反应显色后,使用分光光度法测定其总多糖含量[20-22]。采用凝胶色谱法[23]和离子色谱法[24]通过示差检测器、蒸发光检测器和电化学检测器进行检测,以获得其分子质量和含量。紫外检测器是高效液相色谱(high performance liquid chromatography,HPLC)中应用最广泛的检测器之一,但糖类物质无紫外吸收基团,无法用HPLC法直接进行定量分析,柱前衍生化HPLC方法中的1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)可以在温和条件下与糖链进行定量反应,使其带上发色基团、能够被紫外检测[25-27],降低了糖类检测对仪器的要求,同时与柱前衍生化气相色谱法相比较则更为便捷[28-30]。本研究采用水提醇沉法从枸杞中提取枸杞多糖,经酸水解和PMP衍生化后,进行HPLC分析,该方法经过验证,可用于分析枸杞多糖中单糖组成的测定和枸杞多糖提取物及相关产品的质量控制。
1 材料与方法
1.1 材料与试剂
枸杞干果来源见表1;乙腈(色谱纯) 美国Sigma公司;葡萄糖、木糖、甘露糖、阿拉伯糖、鼠李糖、半乳糖、半乳糖醛酸、氢氧化钠(NaOH)、磷酸二氢钠(NaH2PO4·2H2O)、磷酸氢二钠(Na2HPO4·12H2O)、PMP、三氯甲烷、正丁醇、浓硫酸、苯酚(均为分析纯) 国药集团化学试剂有限公司;实验用水为纯净水。
1.2 仪器与设备
LC-100 HPLC仪 上海伍丰科学仪器有限公司;OOG-4252-EO C18色谱柱(250 mm×4.60 mm,5 μm)美国Phenomenex公司;DNG-9070A烘箱 上海精宏科教仪器有限公司;CP225D电子分析天平(精密度为0.01 mg) 德国Sartorius公司;FD-1A-50真空冷冻干燥机 北京博医康科技有限公司;HH-4Y数显式电热恒温水浴锅 上海启前电子科技有限公司;350Y万能粉碎机西厨电器公司;SHB-III-A循环水式真空泵 杭州大卫科技仪器有限公司;RV05旋转蒸发仪 德国IKA公司。
1.3 方法
1.3.1 枸杞多糖的提取[30]
将枸杞干果药材于烘箱60 ℃烘干,粉碎,称取适量药材粉末置于索氏提取器中,加入3 倍体积的氯仿-甲醇(2∶1,V/V)混合溶剂,于80 ℃回流脱脂2 h,过滤后弃去滤液。再加入3 倍体积的80%乙醇溶液于80 ℃回流2 h除去单糖,过滤后弃去滤液。再加入5 倍体积热水于80 ℃回流提取3 h,重复2 次合并过滤后的滤液。滤液采用Sevag法[31-32]脱去蛋白后,加入4 倍体积的乙醇使多糖沉淀,依次用乙醇、丙酮淋洗,真空冷冻干燥后得枸杞粗多糖。将10 个不同产地的枸杞干果按上述方法提取,即制得10 批自制枸杞多糖。
1.3.2 枸杞多糖总糖含量的测定[33-34]
准确称取无水葡萄糖标准品制成质量浓度为64.89 μg/mL的溶液,精密量取0.2、0.4、0.6、0.8、1.0 mL,分别置于10 mL具塞试管,加水补至1.0 mL,各精密加入1.0 mL 5%苯酚溶液(临用配制)摇匀,竖直悬空缓慢滴加5.0 mL浓硫酸,摇匀后于70 ℃恒温水浴30 min,取出,迅速冷却至室温,以水作为空白,在490 nm波长处测吸光度,以吸光度为纵坐标,质量浓度为横坐标,绘制标准曲线。
精密称取100 mg枸杞多糖样品,用水定容至100 mL,精密量取10 mL置于100 mL容量瓶,用水稀释至刻度,摇匀,精密量取1 mL,重复上述步骤,测定吸光度,平行测定3 次。将测得的吸光度代入标准曲线计算得样品质量浓度。
1.3.3 枸杞多糖的水解
准确称取10 mg枸杞多糖样品置于10 mL螺纹顶空瓶中,加入2 mol/L盐酸溶液5 mL,密封,混匀,90 ℃水解3 h,冷却后于40 ℃旋干,加甲醇旋干至中性,残渣溶于1 mL 50%乙醇溶液待衍生化。
1.3.4 PMP衍生化[25-26]
准确称取10.20 mg甘露糖、10.68 mg鼠李糖、10.40 mg半乳糖醛酸、11.34 mg半乳糖、10.38 mg阿拉伯糖,分别置于5 mL容量瓶,加水溶解、定容并混匀。移取上述溶液(0.5 mL甘露糖、0.5 mL鼠李糖、1.0 mL半乳糖醛酸、0.5 mL半乳糖、0.5 mL阿拉伯糖),置于10 mL容量瓶中,精密称取21.40 mg葡萄糖加入其中,加水至刻度,制成混合标准品溶液。移取上述混合标准品溶液200 μL,置于7 mL离心管中,加入0.5 mol/L PMP-甲醇溶液200 μL、0.3 mol/L NaOH溶液200 μL,充分摇匀,70 ℃水浴反应30 min,冷却至室温,加0.3 mol/L HCl溶液200 μL,混匀,加入1 mL氯仿萃取过量的PMP,弃去下层溶液,重复3 次,8 000 r/min离心10 min后收集上清液,经0.45 μm滤膜过滤待测,衍生化过程如图1所示;精密吸取枸杞多糖水解液,重复上述步骤,处理后待测。

图1 单糖的PMP衍生化过程Fig. 1 PMP derivatization process of monosaccharide
1.3.5 HPLC条件
将PMP衍生化后的标准品及样品处理液进行HPLC分析。HPLC条件:Phenomenex OOG-4252-EO C18色谱柱(250 mm×4.60 mm,5 μm);流动相为乙腈-0.05 mol/mL磷酸缓冲液(pH 6.8)(18∶82,V/V);流速1.0 mL/min;柱温40 ℃;紫外检测波长250 nm;进样量20 μL。
1.3.6 枸杞多糖提取率
枸杞多糖提取率按公式(1)计算:
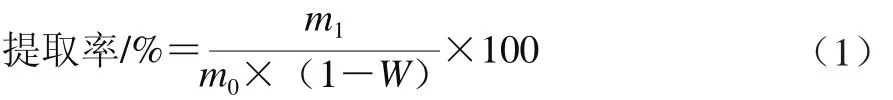
式中:m0为枸杞干果质量/g;m1为粗多糖质量/g;W为枸杞原料的失水率/%。
1.3.7 枸杞多糖中单糖的含量
枸杞多糖中单糖质量浓度及含量按公式(2)、(3)计算:

式中:Cx为多糖样品中某单糖的质量浓度/(μg/mL);Ax为多糖样品中某单糖的峰面积/(mAU·s);a为标准曲线的斜率;b为标准曲线的截距。

式中:wx为多糖样品中某单糖的含量/(mg/g);V为样品溶液的体积/mL;mx为样品的质量/mg。
2 结果与分析
2.1 枸杞多糖提取率及其总糖含量的测定

表1 不同产地枸杞的多糖提取率及枸杞多糖总糖含量测定结果(n=3)Table 1 Comparison of extraction efficiencies and contents of polysaccharides from Lycium barbarum L. from different geographical origins (n= 3)
如表1所示,不同产地的枸杞在相同提取条件下得到的枸杞多糖提取率有所不同,但大多数枸杞多糖的提取率均在3%以内。其中7号枸杞样品的多糖提取率最高,为3.13%,而5号枸杞样品的提取率最低,为1.19%。10批枸杞多糖中多糖质量分数均在33%~60%之间。
2.2 方法学考察结果
线性关系和检出限的考察及结果:将6 种单糖标准品混合溶液按照葡萄糖质量浓度配制为0.053 5、0.107、0.214、0.428、0.856、1.284、1.712、2.14 mg/mL的溶液,按1.3.4~1.3.5节方法进行柱前衍生化HPLC分析,每个质量浓度测定3 次。根据峰面积(y)与进样质量浓度(x)建立回归方程来确定线性范围。将标准单糖溶液逐级稀释,依次进样,记录各组分的信号强度与空白样品的噪音强度,以3 倍信噪比时相应质量浓度作为该组分的检出限,结果见表2。
仪器精密度的考察及结果:将1.284 mg/mL的标准单糖混合溶液衍生化后连续进样6 针,计算其相对标准偏差。甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖的进样相对标准偏差分别为1.96%、1.97%、2.05%、0.83%、2.23%、1.84%。
溶液稳定性的考察及结果:将衍生化后的样品于4 ℃保存,每隔2 h进一针,共6 针,计算相对标准偏差。甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖的进样相对标准偏差分别为2.65%、3.15%、2.56%、3.18%、2.85%、2.23%。
方法重复性的考察及结果:平行配制同一批样品(编号9)6 份,水解衍生化后测定,每一个样品连续进样3 针,由公式(3)计算6 种单糖的含量,见表3。

表3 枸杞多糖样品(编号9)水解产物中单糖含量的测定结果(n= 6)Table 3 Repeatabilty of the method for monosaccharide composition analysis of polysaccharides extracted from Lycium barbarum L. (sample 9)
回收率的考察及结果:精密称定枸杞多糖样品(编号9)38.28 mg,加水定容至5 mL,制得样品溶液。准确称取14.55 mg甘露糖、14.28 mg鼠李糖、16.77 mg半乳糖醛酸、10.29 mg半乳糖、8.43 mg阿拉伯糖,置于10 mL容量瓶中,加水定容。取1 mL上述溶液和107.7 mg葡萄糖于100 mL容量瓶,加水定容混匀,即得高质量浓度混合标准品溶液。精密量取6.67 mL高质量浓度混合标准品溶液,置于10 mL容量瓶中,加水定容,即得中质量浓度混合标准品溶液。精密量取3.33 mL高质量浓度混合标准品溶液,置于10 mL容量瓶中,加水定容,即得低质量浓度混合标准品溶液。精密吸取0.5 mL样品溶液3 份,分别加入0.5 mL高、中、低质量浓度混合标准品溶液,按1.3.3~1.3.5节方法进行水解、衍生化后测定。重复测定3 次,计算回收率见表4。

表4 加标回收率测定结果Table 4 Recoveries of monosaccharides from spiked sample
从上述考察结果可以看出,仪器精密度与方法重复性的相对标准偏差均小于3%,稳定性的相对标准偏差小于5%,不同质量浓度的加标回收率在98%~102%之间,说明PMP柱前衍生化方法适用于枸杞多糖水解液中单糖分析。
2.3 枸杞多糖水解物的衍生化HPLC分析

图2 混合标准单糖(A)、自制枸杞多糖水解物(B)的PMP衍生物色谱图Fig. 2 HPLC chromatograms of mixed monosaccharide standards (A)and hydrolyzed polysaccharides (B) from Lycium barbarum L. by PMP derivatization
由图2可知,枸杞多糖的水解产物中,葡萄糖的含量最高,枸杞多糖的单糖含量及物质的量比见表5、6。

表5 枸杞多糖水解产物中单糖含量的测定结果(n=3)Table 5 Monosaccharide contents of ten laboratory prepared polysaccharide samples (n= 3)
由表5、6可以看出,单糖组分的含量在1.0~280.0 mg/g之间,各批次自制枸杞多糖均含有甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖6 种单糖组分,其中葡萄糖的含量最高,在50~300 mg/g之间,占总糖含量的70.62%~94.74%,阿拉伯糖、半乳糖次之。6 种组分的平均物质的量比为:甘露糖∶鼠李糖∶半乳糖醛酸∶葡萄糖∶半乳糖∶阿拉伯糖=1.00∶1.38∶0.63∶92.37∶1.18∶3.55。单糖的含量和组成比例有一定差异,说明药材的产地对枸杞多糖的单糖组成有一定影响。

表6 枸杞多糖中单糖的物质的量比(n=3)Table 6 Molar ratios of monosaccharides in ten laboratory prepared polysaccharide samples (n= 3)
2.4 市售枸杞多糖的鉴别分析

表7 市售枸杞多糖中多糖含量及单糖的物质的量比Table 7 Monosaccharide composition of commercial samples
将8 种市售枸杞多糖按1.3节方法测定总糖含量,再水解、PMP衍生化后,采用HPLC法测定多糖水解产物中单糖组分的含量及其物质的量比,并与10 批自制枸杞多糖的物质的量比进行比较,结果见表7。市售枸杞多糖水解产物的单糖组分出峰顺序与自制枸杞多糖一致、葡萄糖含量最高,半乳糖醛酸、半乳糖、阿拉伯糖含量较低。市售样品1、2、3、4、7、8的多糖质量分数在35%~60%之间,葡萄糖的物质的量比例在87~139(自制枸杞多糖的0.95~1.5 倍)之间,属于正常枸杞多糖提取物。而市售样品5的多糖质量分数为67.97%,略高于均值,但葡萄糖的物质的量比例为236.05(自制枸杞多糖的2.55 倍);市售样品6的多糖质量分数接近100%,远高于均值,葡萄糖的物质的量比例为258.14(自制枸杞多糖的2.80 倍),半乳糖和阿拉伯糖未检出,因此样品5、样品6较可能添加了以葡萄糖为单体的其他多糖。
3 讨 论
本实验相比于《中国药典》(2015版)中枸杞项下的测定方法[35]增加了脱蛋白的步骤。枸杞多糖是一种酸性杂多糖同多肽或蛋白质构成的复合多糖,药典中的方法为490 nm波长处测定吸光度从而得出总糖含量,蛋白质(最大吸收波长在280 nm)对其没有影响。而PMP衍生化后检测波长为250 nm,蛋白质对其影响较大,因此将多糖脱去蛋白后进行分析。
实验定量分析了6 种单糖(鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸)。依据文献中对枸杞多糖中单糖组成的报道[18,29-30],检测了9 种单糖(鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸、木糖、岩藻糖、核糖),未检测到木糖、岩藻糖、核糖,故只选取前6 种单糖进行测定。
4 结 论
本研究采用柱前衍生化HPLC法分析了不同产地枸杞多糖的单糖组成,经方法学验证,该方法可靠、适用性强。通过测定自制的10 批不同产地的枸杞多糖中6 种单糖含量,得到了枸杞多糖中6 种单糖的平均物质的量比。并测定了8 批次不同厂家的枸杞多糖中6 种单糖的物质的量比,发现其中有2 批可能添加了以葡萄糖为单体的其他多糖。本方法为枸杞多糖的质量控制提供了依据,可有效防止非法添加的行为。
