1 株产γ-氨基丁酸植物乳杆菌谷氨酸脱羧酶基因的克隆与表达
2018-10-08赵婷婷谭金龙向文良
谭 霄,孙 擎,曾 林,赵婷婷,谭金龙,张 庆,*,向文良
(1.西华大学食品与生物工程学院,四川省食品生物技术重点实验室,四川 成都 610039;2.西华大学古法发酵(酿造)生物技术研究所,四川 成都 610039)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是广泛存在于植物、动物和微生物中的一种非蛋白质氨基酸[1]。在哺乳动物脑组织中,GABA是一种重要的抑制性递质,具有降血压、镇静神经、利尿、改善脑机能、增进脑活力等功能[2-3]。此外,GABA还具有抗热应激和提高饲料的利用率等作用[4]。因此GABA被广泛应用到食品、医药、保健品及农业等行业[5]。目前,合成GABA主要有化学合成法、植物富集法和微生物合成法,相比而言,微生物合成法具有条件温和、安全性好、耗能低等优点[6-10],因此,近年来微生物合成法制备GABA受到国内外广泛关注,其中对红曲霉、酿酒酵母、乳酸菌等[11]研究较为深入,特别是具有保健作用的乳酸菌用于合成GABA受到人们的青睐。
乳酸菌合成GABA是通过谷氨酸脱羧酶(glutamate decarboxylase,GAD)专一性、不可逆地催化L-谷氨酸或钠盐α-脱羧而成[12]。GAD在野生乳酸菌中受到菌体自身代谢水平的控制,导致GAD的表达量不高[13]。同时,乳酸菌是兼性厌氧微生物,发酵周期较长,培养条件较难控制,而大肠杆菌(Escherichia coli)生长迅速、易于高密度发酵,易借助基因工程手段实现GABA的高效率生产[14-16]。目前,Park[17]、李杰[18]及Somasundaram[19]等分别将短杆菌、酿酒酵母、嗜热古菌的GAD转入到E. coli BL21(DE3)实现了异源表达;Mazzoli等[20]研究了短杆菌发酵产GABA转录组和蛋白质组的相互关系;李理等[21]研究植物乳杆菌(Lactobacillus plantarum)发酵不同时间点GABA产量和GAD相对表达量之间的关系;齐育平等[22]对短乳杆菌GAD的基因进行了生物信息学分析。而对L. plantarum GAD进行原核表达,并对基因工程菌的GAD相对表达量和GABA产量相互关系的探讨及生物信息学的综合分析鲜有报道。
本实验以1 株从四川泡菜中筛选的产GABA的L. plantarum BC114[3]为出发菌株,通过克隆其GAD基因gad,生物信息学分析,并将gad转入E. coli BL21(DE3)进行诱导表达,同时对gad表达量、蛋白表达量和GABA产量进行评估,探究gad在转录、翻译和表达上的相互关联,为gad改造和发酵提高GABA产量提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
E. coli BL21(DE3)、E. coli JM109、pGEM-T Simple Vector 普洛麦格(北京)生物技术有限公司;L. plantarum BC114、pET-28a(+)由本实验室保存。
限制性内切酶EcoRI和BamHI 美国Thermo公司;质粒小量抽提试剂盒、胶回收试剂盒、细菌总RNA提取试剂盒 天根生化科技有限公司;T4 DNA连接酶、Pfu DNA聚合酶 Promega(北京)生物技术有限公司;RT EasyTMI(For first-strand cDNA synthesis)试剂盒 福际生物技术(成都)有限公司。
1.2 仪器与设备
Biometra聚合酶链式反应(polymerase chain reaction,PCR)仪、qTOWER2 2.2荧光定量PCR德国耶拿分析仪器有限公司;2695高效液相色谱(high performance liquid chromatography,HPLC)仪(配有Waters2998紫外检测器) 美国Waters公司;凝胶成像系统、DYCP-31琼脂糖水平电泳系统、垂直电泳系统美国Bio-Rad公司;BHC-1300A2冷冻离心机 美国贝克曼库尔特有限公司。
1.3 方法
1.3.1 gad的克隆及测序
将L. plantarum BC114在MRS液体培养基过夜培养,利用细菌DNA提取试剂盒提取其基因组DNA,以此为模板进行PCR扩增gad基因,引物[23]见表1,下划线为EcoRI和BamHI限制性内切酶位点。PCR体系(50 μL):40.5 μL ddH2O,5 μL 10×Buffer with MgSO4,1 μL dNTP(10 mmol/L),1 μL upstream primer(20 μmol/L),1 μL downstream primer(20 μmol/L),0.5 μL Pfu DNA Polymerase,1 μL DNA template(100 ng/μL);反应条件如下:95 ℃预变性5 min,94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸2 min,循环30 次,最后72 ℃ 10 min。

表1 克隆目的基因gad和荧光定量PCR引物Table 1 Primers used for cloning of target genes and real-time PCR
以1%琼脂糖凝胶电泳检测PCR产物是否正确,并进行胶回收。目的片段与pGEM-T载体通过T4 DNA连接酶,25 ℃过夜连接,热激转入E. coli JM109感受态细胞中。在含100 μg/mL氨苄青霉素(ampicillin,Amp)平板上培养过夜,挑取单克隆在含100 μg/mL Amp液体LB培养基中培养8~10 h,抽提质粒得到pGEM-T-gad,并采用酶切电泳和测序鉴定,序列测定由成都擎科梓熙生物技术有限公司完成。
1.3.2 GAD的生物信息学分析
使用ExPASY的Protparam工具对gad编码的蛋白质的理化性质进行预测和分析;应用TMHMM Server v. 2.0在线工具预测基因编码蛋白的跨膜结构域,同时,利用PSIPED V3.3在线分析工具分析蛋白质的二级结构;利用MEGA 5.0软件构建蛋白的系统进化树;应用Swiss-Model在线工具进行同源建模,并用PROCHECK软件进行模型评估。
1.3.3 重组菌的构建
将克隆载体pGEM-T-gad经EcoRI和BamHI双酶切,产物进行琼脂糖核酸电泳,胶回收获得目的片段,并连接至同样经过EcoRI和BamHI双酶切的表达载体pET-28a(+),热激转入到感受态细胞E. coli BL21(DE3)中,经菌落和酶切鉴定,获得E. coli BL21(DE3)/pET-28a-gad。
1.3.4 重组蛋白在E. coli BL21(DE3)中的诱导表达
将E. coli BL21(DE3)/pET-28a-gad转入到卡那平板上,通过菌落PCR筛选出阳性克隆子,并将其接种至含50 μg/mL卡那霉素的10 mL LB培养基中37 ℃、150 r/min活化8~10 h,以2%接种量转到含50 mg/L卡那霉素的100 mL LB培养基,37 ℃、200 r/min培养到OD600nm为0.6后加入1 mmol/L IPTG和0.05 mmol/L磷酸吡哆醛(pyridoxal phosphate,PLP),降温至28 ℃,180 r/min进行蛋白诱导表达,在诱导期间取2、4、6、8、10 h的发酵液于后续分析。
1.3.5 基因表达水平的测定
1.3.5.1 重组菌发酵过程中gad相对表达量的测定
取不同时间菌液,并按RNA提取试剂盒(天根)操作说明书步骤进行,并加入DNaseI酶(37 ℃,15 min;65 ℃,10 min)以去除RNA样品中残留的基因组DNA。按照试剂盒说明书(福际)进行反转录成cDNA第1链。以反转录成的cDNA为模板进行实时荧光定量PCR。利用软件Primer 5.0对目的基因core of gad和内参基因16S rRNA设计特异性引物(表1)。
PCR体系(20 μL):荧光混合染料10 μL、正反向引物各0.4 μL、cDNA模板0.5 μL,加无菌双蒸水至20 μL。反应条件:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 34 s,循环40 次;溶解曲线分析:95 ℃ 15 s,60 ℃ 34 s,95 ℃ 15 s。
基因表达量的定量以16S rRNA为内参基因,发酵时间10 h的gad表达量为参比样本,以无菌双蒸水代替cDNA模板作为阳性对照,分析各基因Ct值(每个样品设置3次平行实验)。利用2-ΔΔCt法对GAD表达量进行相对定量(其中,Ct是扩增基因达到阈值时的循环数,ΔCt是目的基因与内参基因Ct值的差值,ΔΔCt是实验各时间点与实验结束时间点ΔCt值的差值)[24]。
1.3.5.2 重组菌发酵过程中十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
将菌液离心收集菌体,并用生理盐水进行洗涤,加入2×样品缓冲液煮沸10 min,然后13 000 r/min离心10 min,取上清液进行10%的SDS-PAGE分析。
1.3.5.3 重组菌产GABA表达能力评估
根据陈琳等[11]报道,以5 mL质量浓度为5 g/L的L-谷氨酸钠为底物,以不同发酵时间的菌体4 mg,乙酸-乙酸钠缓冲液(含2.5 mmol/L Ca2+、3.5 mmol/L Mg2+)调pH值为4.5,45 ℃条件下反应4 h。参照并结合Diana等[25]利用DNS-Cl衍生化的方法测定重组菌不同时间发酵液的GABA产量,HPLC分析条件:色谱柱为岛津-GL INERTSIL ODS-3(4.6 mm×150 mm,5 µm);紫外检测波长254 nm;柱温30 ℃;进样量20 μL;流动相A为甲醇,流动相B为醋酸钠(pH 6.2)-甲醇-四氢呋喃(84∶25∶1,V/V);流速1 mL/min;梯度洗脱时,流动相B比例:0~6 min,维持80%;6~20 min,80%~20%;20~27 min,20%~0%;27~30 min,返回80%。
2 结果与分析
2.1 L. plantarum BC114中gad的克隆

图1 重组质粒pGEM-T-gad的酶切结果Fig. 1 Identification of recombinant vector pGEM-T-gad by restriction enzyme digestion
以L. plantarum BC114基因组DNA为模板,经PCR扩增得到目的片段,胶回收该片段与pGEM-T Simple Vector连接,并转入E.coli JM109,筛选阳性克隆子,重组质粒酶切结果见图1。由EcoRI酶切结果可知,酶切后得到2 条明显分离的条带,其中1 条在大约3 000 bp处,另1 条在大约1 400 bp处,片段大小与李杰[18]报道的一致,表明该菌株可能有gad的存在,随后测序并对序列进行分析。
2.2 L. plantarum BC114中GAD的生物信息学分析
通过ExPASY的protparam在线工具结果表明:L. plantarum GAD蛋白由469 个氨基酸编码而成(GenBank登录号MF418590),其中带正电荷氨基酸残基(Arg+Lys)共40 个,带负电荷的氨基酸残基(Asp+Glu)总数为60 个,蛋白质理论分子等电点为5.58,分子式为C2412H3652N648O693S2,脂溶性指数为84.65。GAD蛋白在溶液中不稳定指数为30.53(<40),说明该蛋白在溶液中性质稳定。克隆的GAD所编码的蛋白的二级结构由α-螺旋、β-折叠、无规则卷曲构成,分别占32.2%、11.5%、56.3%。同时,采用TMHMM Server v. 2.0预测显示,GAD蛋白中无跨膜结构域,为非跨膜蛋白。
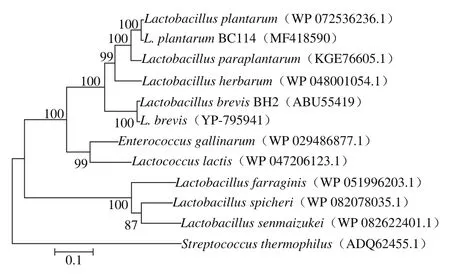
图2 GAD氨基酸序列系统发育树Fig. 2 Phylogenetic analysis of amino acid sequence of GAD
Grone等[26]分析了脊椎动物中3 种GAD的差异,并用氨基酸序列构建系统发育树分析亲缘关系,表明GAD3与GAD1和GAD2具有同源性,但是对于L. plantarum的GAD的亲缘关系鲜见报道。本研究基于GAD氨基酸序列,采用邻位相接法(Neighbor-Joining)对其进行系统发育树的构建,结果见图2。L. plantarum BC114的GAD聚类在同一类群,同时,短乳杆菌的GAD也聚为一类,而其他Enterococcus gallinarum和Lactococcus lactis不同属的聚为一类,Lactobacillus spicheri和Lactobacillus senmaizukei不同种也聚为一类。因此,GAD在细菌中既有物种之内的保守性,又有物种之间相对变异性,较真实地反映了不同物种间的自然演化过程[19]。
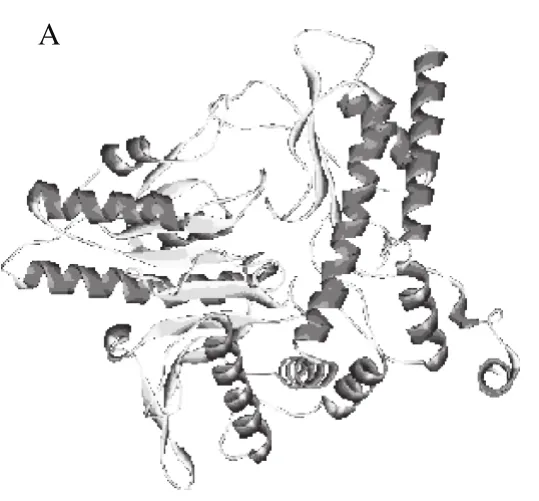

图3 GAD的三级结构(A)和拉氏构象图(B)Fig. 3 Predicted tertiary structure (A) and Ramachandran plot (B) of GAD
采用Swiss-Model在线预测工具进行同源建模构建未知蛋白质三维结构,对于序列相似性大于30%的蛋白序列能够建立准确性较高的模型。对L. plantarum BC114的GAD进行同源建模,选择与PDB数据库中GAD蛋白同源最高的蛋白E. coli gad(3fz6.1),相似度45.50%,模拟GAD蛋白的三级结构,结果如图3A所示,GAD的折叠方式符合二级结构的分析结果。
采用PROCHECK工具对预测结果进行评估,结果见图3B。拉氏图中的每个区域的颜色由深到浅排列的次序依次为最佳合理区、额外合理区、一般合理区以及不合理区。结果显示,有85.9%处于最佳合理区,说明这些氨基酸残基之间不存在重叠和不合理接触,而额外合理区、一般不合理和不合理区分别占11.4%、2.2%、0.5%,此评估结果与郁凯[27]报道的大体一致。
2.3 重组表达载体pET-28a-gad的构建
随机挑取平板上菌落进行PCR,扩增产物经琼脂糖凝胶电泳分析在约1 400 bp出现条带,与预期的条带大小一致,结果见图4A,挑取该菌落培养并抽提质粒,进行EcoRI和BamHI双酶切,酶切结果见图4B。在5 000 bp处为pET-28a(+)质粒(5 369 bp),1 400 bp左右为gad片段。表明目的基因已成功连接到载体上,随后的测序结果准确无误,可用于后续的异源表达。


图4 菌落PCR(A)和重组质粒pET-28a-gad的双酶切验证(B)Fig. 4 PCR analysis of positive monoclonal colonies (A) identification of recombinant vector pET-28a-gad by double restriction enzyme digestion (B)
2.4 gad表达水平的测定
2.4.1 重组菌gad相对表达量的测定结果

图5 不同发酵时间点gad相对表达量Fig. 5 Relative expression levels of gad at different fermentation times
实时荧光定量PCR应用荧光信号的强弱与扩增物的量呈正比来实现定量,已广泛应用于基因突变检测、微生物学检测、基因表达的研究等领域[28-29]。图5结果表明,在不同发酵时间均检测到gad的mRNA,表明转入的gad在转录水平上已表达。gad表达量随着诱导时间的延长大体呈先升高后降低的趋势,与发酵相同时间点GABA产量趋势总体上一致(图5和图8)。发酵2~4 h,GABA产量已有显著增加,而此时的GAD基因gad相对表达量变化并不显著;6 h相对表达量达到最高值,为10 h的4.23倍;8 h相对表达量较6 h有所降低,而GABA产量有所推迟并在8 h达到最大值。本实验与基因表达相比,相关产物的合成具有一定的滞后性,但又不是单纯的滞后关系,Mazzoli等[20]报道GABA产量在基因或者转录水平上与GAD编码基因的关系不是非常紧密,可能受到其他基因的调控。
2.4.2 重组菌GAD表达蛋白SDS-PAGE分析

图6 pET-28a-gad表 达蛋白SDS-PAGE图Fig. 6 SDS-PAGE analysis of expressed product from pET-28a-gad
将重组的pET-28a-gad转入表达型E. coli BL21(DE3)加入IPTG和PLP进行诱导表达,经过垂直电泳并染色再脱色,结果见图6。与E. coli BL21(DE3)相比,重组菌均在54 kDa附近出现特异性条带,与Park等[17]报道的GAD大小一致。随着诱导时间的延长,蛋白表达量相应的增多,在诱导8 h时蛋白表达量达到最大,随后有所减低。这与田灵芝[29]的研究结果相同,即用E. coli BL21(DE3)作为宿主细胞时,宿主菌本身的蛋白酶能降解异源蛋白,在诱导末期时较为明显,因此最佳诱导表达时间为8 h。
2.4.3 重组菌产GABA表达能力评估


图7 不同发酵时间点GABA色谱图Fig. 7 Chromatograms of GABA produced at different fermentation times
利用HPLC对不同诱导发酵时间重组菌产GABA能力进行评估,其标准曲线为Y=106X-246 533(R2=0.999 9),可用于发酵液中GABA定量分析,结果见图7、8。结果表明,重组菌产GABA的最大值为2 387 mg/L,相比原始菌株L. plantarum BC114 GABA产量1 720 mg/L[3],提高了38.7%。GABA产量随着发酵时间的延长呈现增加趋势,随后有所降低,与对应的发酵时间蛋白表达量趋势变化一致。GABA产量在2~4 h显著增加,而此刻对应的蛋白量也增加,两者都在发酵8 h达到最大值,在发酵合成GABA主要受到GAD的影响[30],因此酶含量越高更利于将L-谷氨酸钠转化为GABA。随着发酵时间的继续延长酶含量有所降低,可能是因为E. coli BL21(DE3)本身的蛋白酶能降解异源GAD从而导致GABA含量降低。
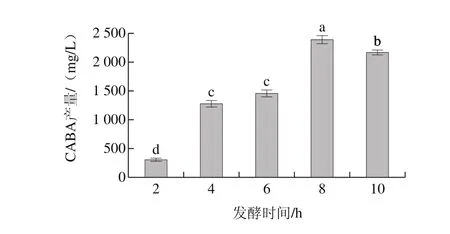
图8 不同发酵时间点GABA产量Fig. 8 GABA accumulation levels at different time points of fermentation
3 结 论
本研究利用前期实验室筛选的L. plantarum BC114 GAD进行克隆,并对其进行生物信息学分析,GAD核酸序列长度1 410 bp,编码469 个氨基酸,等电点为5.58,蛋白的二级结构由α-螺旋、β-折叠、无规则卷曲构成,分别占32.2%、11.5%、56.3%,实现酶蛋白三级结构的建模预测;成功构建了基因工程菌E.coli BL21(DE3)/pET-28a-gad,在IPTG和PLP的诱导下,该重组菌表达了一个特异性的分子质量约为54 kDa的融合蛋白。重组菌生物合成GABA量最高达到2 387 mg/L,相比L. plantarum BC114提高了38.7%。GABA代谢物的生成与gad的转录、表达不是同步进行,而是具有一定滞后性。本实验为进一步进行GAD分子改造和提高GABA产量提高提供一定的理论依据。
