中药白芍亲缘性分析及分子鉴定标记的筛选
2018-10-08,,
, ,
(浙江工业大学 药学院,浙江 杭州 310014)
中药白芍(RadixpaeoniaeAlba)来源于毛茛科植物芍药(PaeonialactifloraPall.)的干燥根[1].芍药有益血调经、平肝敛阴的功效,在我国用药历史悠久.浙白芍主产于浙江磐安,是著名的“浙八味”,安徽亳州为亳白芍,四川中江为川白芍,皆为道地药材.在中药市场上白芍没有明确的产地划分,市场上也出现充次乱真的现象[2-3].因此,需要对白芍品种做出准确鉴定,以保证药材质量.RAPD(Random amplified polymorphic DNA)随机扩增多态性技术可直接分析药用植物基因组DNA的多态性,筛选得到DNA分子鉴定标记,实现中药材在基因组的分子水平鉴定的研究[4].
陈丙銮等[5]应用RAPD技术揭示白芍原植物居群间具有丰富的遗传多样性.周红涛等[6]应用该技术首次揭示芍药种群的遗传分化.本实验以4种中药白芍为研究对象,选用随机引物,采用PCR技术扩增多态性条带,旨在揭示白芍遗传多样性,并且寻找不同产地白芍的DNA特异性条带,为今后进一步研究白芍的分类地位、种质保护提供在分子水平上的技术依据和实践基础.
1 材料与方法
1.1 实验材料
1.1.1 药 材
实验室于2015年3月—2015年4月分别向浙江磐安、安徽亳州、山东菏泽和四川中江4个白芍主产地购买新鲜的芍药植株.新鲜嫩叶经硅胶快速干燥,保存于-70 ℃冰箱备用.以上芍药品种经浙江工业大学药学院华允芬副教授鉴定为正品.药材信息详见表1.

表1 4 种白芍的产地Table 1 Origins of four kinds of Paeonia lactiflora Pall.
1.1.2 仪器与试剂
PCR相关试剂,快速植物基因组提取试剂盒购自生工®生物工程(上海)有限公司;RAPD随机引物由生工®生物工程(上海)有限公司合成.实验中的仪器包括PCR扩增仪MyCycleTMThermal Cycler,电泳仪Power PacTMBasic和凝胶成像系统Molecular Imager®Gel DocTMXR+System,均为Bio-Rad公司产品.
1.2 实验方法
1.2.1 白芍DNA的提取
用电子天平分别称取110 mg的芍药新鲜嫩叶(叶片必须事先经过饥饿过夜且充分剪碎处理);置于研钵中,倒入液氮进行充分研磨,研磨至样品呈粉末;用药匙迅速转移到1.5 mL的EP管,用移液枪先后加入400 μL Buffer PCL Solution和8 μL β-巯基乙醇,充分混匀;于65 ℃的水浴锅中放置45 min,每隔10 min摇匀1次,第2次摇匀前加入20 μL的RNase A;室温向离心管中加入200 μL的Buffer PP Solution,混匀后再放置-20 ℃冰箱静置5 min;室温10 000 r/min离心5 min,取上清液移入新的1.5 mL的EP管中;分别向每管中加入与上清液等体积的异丙醇(-20 ℃预冷),颠倒混匀后放入4 ℃冰箱里过夜;室温10 000 r/min离心5 min,留沉淀,加入1 mL的75 %乙醇漂洗;室温10 000 r/min离心2 min,弃上清,此步骤重复一次;留沉淀倒置使EP管中的乙醇完全挥发为止;向每管加入50 μL的TE Buffer溶解DNA,放入-20 ℃冰箱保存备用.
1.2.2 白芍DNA质量检测
制备质量分数为1.2%的琼脂糖凝胶,将DNA样品与上样液混合后加入加样孔中,凝胶在TAE缓冲液中电泳55 min.电泳结束后将胶块浸没于EB染色液中染色10 min,取出后用清水漂洗数次,在凝胶成像系统中观察结果,拍照留存.通过电泳结果可以初步估计DNA的质量,使用紫外-可见光分光光度法可以获得DNA的纯度.DNA样品经过稀释后,放入紫外-可见光分光光度计中测定260 nm和280 nm波长处的吸光度,计算基因组DNA样品的纯度,计算式为DNA质量浓度=A260×稀释倍数×50.
1.2.3 PCR扩增
以4种白芍基因组DNA为模板,选用随机寡核苷酸引物进行RAPD扩增[7-9].RAPD扩增体系参考文献报道[10-12],体系为10×PCR buffer 2 μL,MgCl2(25 mmol/L) 1.2 μL, dNTPs(10 mmol/L) 0.5 μL,模板DNA(50 ng/μL) 1.2 μL,引物 (20 μmol/L) 0.5 μL,Taq plus DNA polymerase(5 U/μL) 1.5 U,最后加已灭菌的ddH2O至20 μL.PCR程序设置为94 ℃预变性4 min,94 ℃ 45 s,40 ℃ 45 s,72 ℃ 2 min,44个循环,72 ℃ 10 min,4 ℃保存.PCR扩增产物经质量分数为1.2%的琼脂糖凝胶电泳分离,再经溴化乙锭染色,在紫外凝胶成像系统下观察电泳结果并拍照留存.
1.2.4 统计学方法
根据PCR扩增条带的迁移程度,确定4种白芍RAPD扩增条带的位置和相对分子质量大小.同一引物的扩增产物在电泳中迁移相同距离,即认为是有同源性,按条带的有无分别赋值,有带(包括弱带)记为“1”,无带记为“0”,形成二元数据矩阵.利用 NTsys2.10e 软件计算出4 种白芍之间的遗传相似性系数.
2 实验结果
2.1 白芍DNA提取及质量检测
植物基因组提取按快速植物基因组提取试剂盒说明书操作,基因组DNA的琼脂凝胶电泳鉴定结果,见图1.从图1中可知:白芍基因组DNA片段长度完整,条带清晰,无拖尾现象,说明提取获得的白芍基因组DNA纯度较高,杂质含量较少,且DNA分子完整无降解,质量较高.由紫外-可见光分光光度法测定白芍基因组DNA的相关数据见表2.表2的数据显示了4种白芍基因组DNA的OD260/OD280值均在1.8~1.9,DNA质量浓度在100~250 μg/mL,说明白芍基因组的质量较好,纯度较高,为实验研究提供较优质量的模板.

1—Marker;2—浙白芍基因组DNA;3—亳白芍基因组DNA;4—山白芍基因组DNA;5—川白芍基因组DNA图1 4种白芍基因组DNA电泳图Fig.1 Genomic DNA isolated from four kinds of Paeonia lactiflora Pall.
Table2TheconcentrationofgenomicDNAofPaeonialactifloraPall.
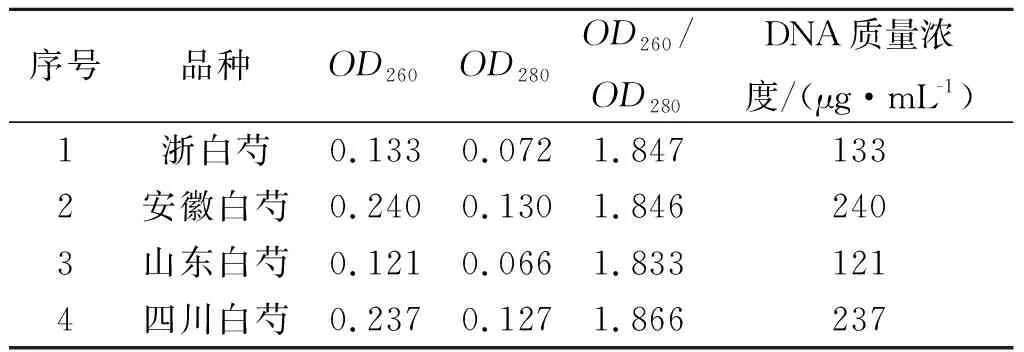
序号品种OD260OD280OD260/OD280DNA质量浓度/(μg·mL-1)1浙白芍0.1330.0721.8471332安徽白芍0.2400.1301.8462403山东白芍0.1210.0661.8331214四川白芍0.2370.1271.866237
2.2 随机引物的筛选
从实验室大量引物中筛选出比较好的26条随机寡核苷酸引物,这些引物能扩增出重复性较好,条带清晰且多态性丰富的条带.筛选出来的引物碱基序列及扩增出来的条带数量如表3所示,4种白芍共扩增出385条带,其中多态性条带345条,多态性比率为89%,说明4个产地的白芍间保存着丰富的遗传多样性.
表3用于白芍RAPD实验的引物序列及扩增结果
Table3PrimersproducedRAPDpolymorphicbandsandtheresultofamplificationofPaeonialactifloraPall.
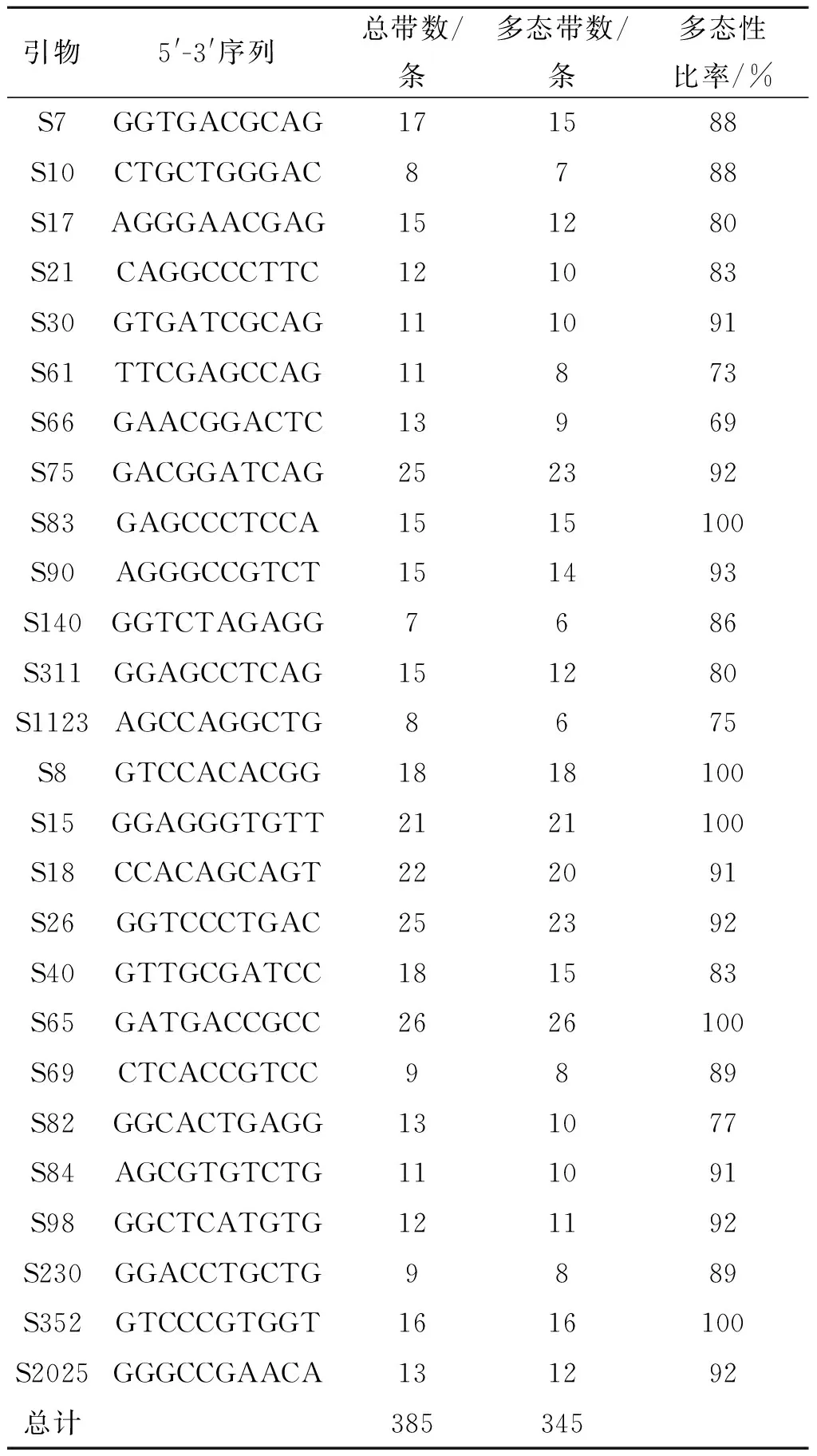
引物5'-3'序列总带数/条多态带数/条多态性比率/%S7GGTGACGCAG171588S10CTGCTGGGAC8788S17AGGGAACGAG151280S21CAGGCCCTTC121083S30GTGATCGCAG111091S61TTCGAGCCAG11873S66GAACGGACTC13969S75GACGGATCAG252392S83GAGCCCTCCA1515100S90AGGGCCGTCT151493S140GGTCTAGAGG7686S311GGAGCCTCAG151280S1123AGCCAGGCTG8675S8GTCCACACGG1818100S15GGAGGGTGTT2121100S18CCACAGCAGT222091S26GGTCCCTGAC252392S40GTTGCGATCC181583S65GATGACCGCC2626100S69CTCACCGTCC9889S82GGCACTGAGG131077S84AGCGTGTCTG111091S98GGCTCATGTG121192S230GGACCTGCTG9889S352GTCCCGTGGT1616100S2025GGGCCGAACA131292总计385345
2.3 聚类分析
用NTsys 2.10e软件对4 种白芍扩增条带的二元数据进行遗传相似性分析,数据如表4所示.4 种白芍两两遗传相似性系数在0.520 2~0.723 7,其中山东荷泽白芍与安徽亳州白芍遗传相似性系数最高,达0.723 7;其次是与四川中江遗传相似性系数高达 0.678 3,而与浙江磐安的遗传相似性系数较低,只有0.520 2.由遗传相似系数越小,两物种的亲缘关系越远的理论,山东白芍和安徽白芍的亲缘关系最近,山东白芍和浙江白芍的亲缘性关系最远.数据分析,浙江白芍和安徽白芍的亲缘性并不是最近的,说明地理位置不是亲缘关系的主要原因.各地中药材在种质资源的交流,以及同种药材植株为了适应不同气候环境而产生的遗传分化都是导致亲缘性远近差异的原因.
表44种白芍遗传相似性系数表
Table4GeneticsimilaritycoefficientofPaeonialactifloraPall.

品种浙江磐安安徽亳州山东菏泽四川中江浙江磐安1.000 00.657 20.520 20.559 2安徽亳州0.657 21.000 00.723 70.668 0山东菏泽0.520 20.723 71.000 00.678 3四川中江0.559 20.668 00.678 31.000 0
2.4 分子鉴定标记的筛选
图4为引物S17,S7,S61,S98对浙白芍、安徽白芍、山东白芍和四川白芍的RAPD扩增图谱.引物S17筛选到一条浙白芍的在900 bp的特异性条带;引物S7筛选一条安徽白芍的在1 800 bp的特异性条带;引物S61筛选到一条山东白芍的在1 200 bp的特异性条带;引物S98筛选到一条山东白芍在1 500 bp的特异性条带.不同产地白芍的扩增存在差异,反映了白芍基因组有一定的差别,可以将这些特异性条带筛选作为各地的分子标记,说明RAPD技术可以从DNA水平上检测不同产地白芍的遗传变异.
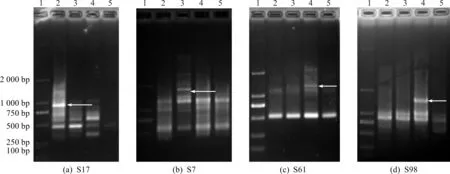
1—Marker;2—浙白芍基因组DNA;3—亳白芍基因组DNA;4—山白芍基因组DNA;5—川基因组DNA图2 白芍基因组RAPD实验中的4种引物的扩增结果Fig.2 Bands produced by four primers in RAPD of amplification of Paeonia lactiflora Pall.
3 结 论
白芍在中国有大量的栽培种植,分布广阔,由于不同的地理环境、气候条件,逐渐产生遗传变异.本实验通过26条引物的扩增图谱,研究白芍遗传相似性系数,结果表明了4个产地的白芍具有较高的遗传多样性.山东荷泽白芍与安徽亳州白芍遗传相似性系数最高,而与浙江磐安的遗传相似性系数较低,说明药材交流、长期进化都能成为白芍遗传分化的原因,这为白芍的遗传分化提供实践基础.实验成功筛选到浙白芍、安徽白芍和山东白芍的分子鉴定标记.目前,将筛选到的分子标记进行下一步的测序工作,实验可为各地白芍特异性PCR引物的设计打下基础,也为其他中药材品种的分子水平的鉴定研究提供参考.
