Smad7在脂溢性角化病、日光性角化病及基底细胞癌中的表达
2018-10-08和义敏章宏峰梁小芳姜小丽
和义敏 章宏峰 李 芃 梁小芳 姜小丽 高 英
脂溢性角化病(Seborrheic Keratosis, SK)、日光性角化病(Actinic Keratosis, AK)及基底细胞癌(Basal Cell Carcinoma, BCC)是与慢性日光损伤、紫外线辐射有关的皮肤肿瘤性疾病。三者生物学行为虽有所不同,但却有某些共同特点:好发于老年人,曝光部位多见,病理均表现为上皮细胞异常过度增生[1-3]。目前表皮肿瘤的发病率全球范围内增长[4],其发病机制的研究显得尤为重要。
转化生长因子β(Transforming Growth Factor β, TGFβ)对细胞生长、分化、凋亡、迁移、细胞粘附和免疫反应等发挥重要作用,参与皮肤老化、紫外线照射损伤及表皮肿瘤的发生[5]。经典TGFβ信号通过激活Smad蛋白发挥生理作用。Smads蛋白分为受体活化型Smad(R-SMADs)、共同通路型Smad(Co-Smad)以及抑制型Smad(I-Smad)。Smad7及Smad6属于抑制性Smad蛋白[6]。人类Smad7基因位于18号染色体,其通过与活化TGFβ受体I结合以及使R-Smads与Co-Smad复合物形成等来抑制TGFβ信号。研究表明,Smad7可对抗TGF-β介导的纤维化、致癌和炎症,提示Smad7有治疗这些疾病的潜力[7]。本文旨在探讨Smad7在脂溢性角化病、日光性角化病以及基底细胞癌中的表达并探讨其临床意义。
1 材料及方法
1.1 组织标本 SK标本,AK标本,BCC标本及正常标本(NS)各30例,均来自本院。临床和人口资料取自患者档案,所有病例都经两位皮肤科医师在未知皮损部位、年龄和性别情况下重新评估。石蜡包埋的组织经常规HE染色分别确诊为SK, AK, BCC及正常标本。正常对照取自整形科手术切除的正常皮肤。所有患者均无炎症系统性疾病或伴有内脏肿瘤,术前均未进行放、化疗。各组年龄及性别均无统计学差异(表 1)。
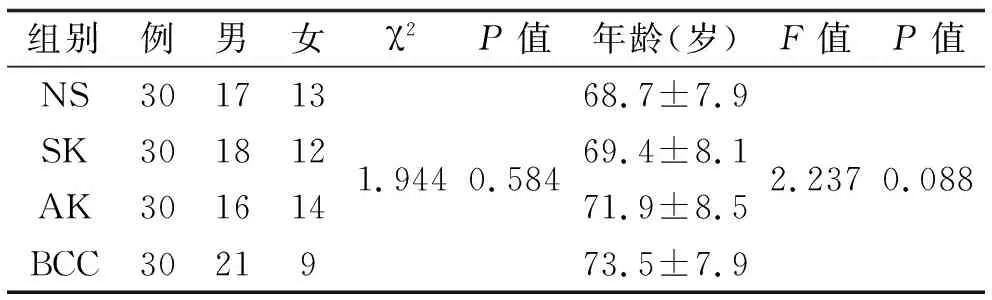
表1 标本的性别及年龄分布
1.2 试剂 Smad7抗体购自美国Santa Cruz公司(sc-11392),稀释浓度为1∶300;免疫组化试剂盒(封闭液、二抗、SAB复合物以及DAB显色试剂)购自武汉博士德生物有限公司。
1.3 免疫组化 将石蜡包埋组织块切成4 μm厚的组织片,贴于硅烷涂布的载玻片上。采用SABC法进行免疫组化染色。步骤如下:二甲苯脱蜡20 min,经过梯度酒精溶液水化,用3% H2O2溶液封闭内源性过氧化物酶20 min。组织切片置于PH值为6.0的10 mmol/L的枸橼酸盐缓冲液中用微波炉加热法抗原修复10 min,10%正常山羊血清封闭非特异性结合30 min。组织切片上加Smad7抗体后4℃过夜孵育。辣根过氧化物酶标记的抗兔免疫球蛋白作为二抗室温孵育20 min,SABC复合物37℃孵育20 min。DAB作为显色剂,苏木精作为复染剂,依次加入。依照试剂说明,在以上每一步操作后用PBS清洗玻片。除了特殊说明外,所有孵育均在常温下进行。胃癌组织作为阳性对照,PBS用作空白对照。
1.4 结果判定 Smad7染色后,每个标本随机选择三个高倍视野 (HPFs,×200) ,每个视野都数出100个角质细胞,计算出三个视野中的平均阳性细胞率。采用半定量评估方法将染色分为四个等级:阴性(-)、弱阳性(+)、阳性(++)以及强阳性(+++)[8],见表 2。
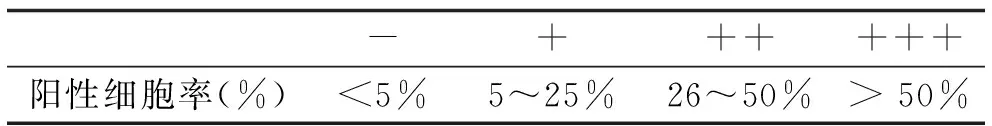
表2 半定量评估方法
1.5 统计学方法 采用SPSS 16.0软件分析结果。计数资料采用卡方检验,多组之间阳性细胞率的比较使用方差分析,其中两两比较采用方差分析LSD法。P<0.05为有统计学意义。
2 结果
2.1 Smad7在正常皮肤的表达 在正常皮肤标本中,Smad7弱阳性或阴性表达,少量表达于表皮基底层的细胞质(图1)。
2.2 Smad7在SK中的表达 在30例SK中,23例(77%)阳性表达(见表3);大部分SK标本中,Smad7中等阳性染色,主要表达于表皮基底层及棘层的细胞质(图2);SK标本中Smad7的阳性细胞率明显高于正常标本(见表4)。根据病理分型[9],在30例SK中,角化过度型8例,棘层肥厚型11例,腺样型5例,克隆型6例,其阳性细胞率无统计学差异(F=0.043,P>0.05)。
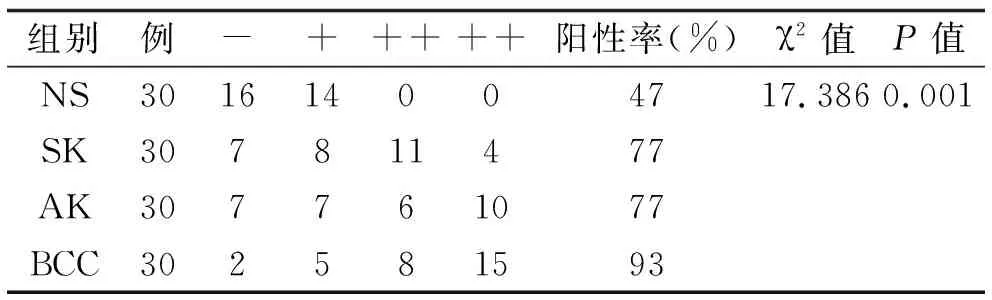
表3 Smad7的表达 例
2.3 Smad7在AK中的表达 在30例AK中,23例(77%)阳性表达(见表3);大部分AK标本中,Smad7中等阳性和强阳性染色,表达于表皮全层的细胞质(图3);AK标本中Smad7的阳性细胞率明显高于正常标本(见表5)。根据病理分型[9],在30例AK中,萎缩型8例,肥厚型6例,原位癌样型6例,棘层松解型10例,其阳性细胞率无统计学差异(F=0.962,P>0.05)。

表4 SK,AK,BCC与正常组织中Smad7阳性率的比较
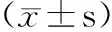
表5 Smad7表达的阳性细胞率
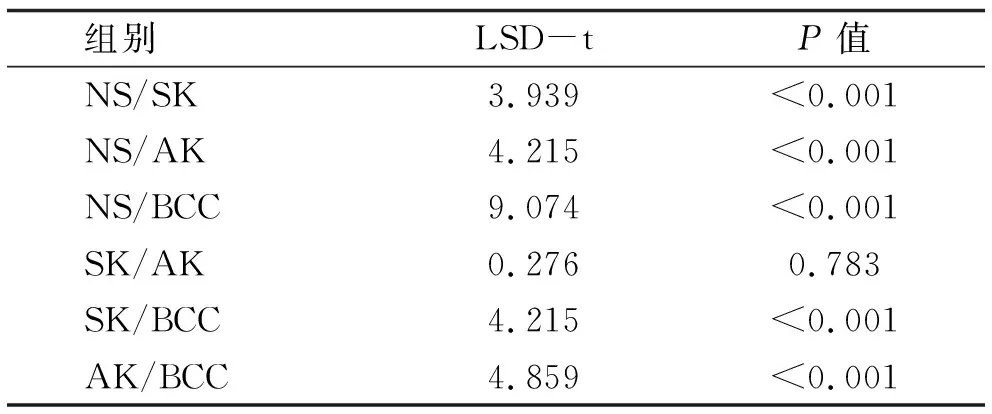
表6 Smad7阳性细胞率的两两比较

图1 1a:PBS阴性对照在正常组织中阴性表达(免疫组化,×200);1b、1c:Smad7在正常皮肤组织中弱阳性表达(免疫组化,×200,×400)图2 2a:PBS阴性对照在SK中阴性表达(免疫组化,×200);2b、2c:Smad7在SK组织中等阳性表达(免疫组化,×200,×400)图3 3a:PBS阴性对照在AK中阴性表达(免疫组化,×200);3b、3c:Smad7在AK组织强阳性表达(免疫组化,×200,×400)图4 4a:PBS阴性对照在BCC中阴性表达(免疫组化,×200);4b、4c:Smad7在BCC组织中强阳性表达(免疫组化,×200,×400)
2.4 Smad7在BCC中的表达 在30例BCC中,28例(93%)阳性表达(表3);大部分BCC标本中,Smad7强阳性染色,表达于表皮全层及肿瘤细胞的细胞质(图4);BCC标本中Smad7的阳性细胞率明显高于正常标本(表5)。根据病理分型[9],在30例BCC中,结节型10例,浅表型9例,纤维上皮瘤样型8例,腺样型3例,其阳性细胞率无统计学差异(F=0.394,P>0.05)。
2.5 统计分析结果 SK,AK,BCC中Smad7的阳性率明显高于正常组织,差异有统计学意义,而SK、AK、BCC三者的阳性率比较无统计学差异(χ2=3.801,P=0.15)(见表4,5)。SK、AK、BCC中Smad7的阳性细胞率明显高于正常组织,差异有统计学意义;BCC的阳性细胞率明显高于SK与AK,差异有统计学意义;SK与AK的阳性细胞率比较无统计学差异(见表6)。
3 讨论
TGFβ信号在肿瘤不同时期发挥不同作用。在肿瘤早期,TGFβ是抑制因子,抑制细胞增殖,促进细胞凋亡;在肿瘤晚期,TGFβ促进上皮间质转化(Epithelial-Mesenchymal Transition, EMT),参与恶性肿瘤的侵袭及转移。此外,TGFβ还可通过促进血管生成等参与肿瘤侵袭。Smad7作为TGFβ信号的拮抗剂,比Smad6拥有更多的 TβRI结合位点,因此Smad7比Smad6发挥更重要的拮抗作用。Smad7在许多恶性肿瘤中高表达,其表达程度与恶性程度呈正相关,并且对肿瘤不同时期的转换起到“开关”作用。此外,高表达的Smad7可以增强表皮生长因子(Epidermal growth factor, EGF)受体信号的稳定性,从而增强由EGF介导的细胞增殖,进而调控肿瘤病程[10]。基于这些机制,研究发现Smad7在许多恶性肿瘤中高表达,例如乳腺癌、结直肠癌、前列腺癌、胆汁癌、甲状腺癌、B细胞淋巴瘤、黑素瘤等[11]。Liu等人利用化学诱导方法制造小鼠皮肤肿瘤模型,使用原癌基因转染的角质细胞Smad7高表达,进而导致良性肿瘤上皮细胞的转化和鳞状细胞癌的迅速发展[12]。
本实验中, SK,AK及BCC的Smad7阳性细胞率均明显高于正常标本,并且BCC的阳性细胞率又明显高于SK与AK。我们推测,Smad7的高表达,导致TGFβ、EGF等信号紊乱,进而导致SK,AK以及BCC发病,并且Smad7有可能是致癌因子,甚至影响其预后。有研究表明,被不同剂量的紫外线辐射后的AK组织中Smad7的含量明显升高,而Smad7在鳞状细胞癌中高表达[13],这进一步说明Smad7促进了皮肤肿瘤的发展。而Javelaudl等[14,15]的研究发现Smad7在转移性黑素瘤细胞中有肿瘤抑制作用。故Smad7在皮肤中有促进肿瘤及抑制肿瘤两种作用。由此可见,Smad7不仅仅是TGFβ信号的拮抗剂,它可能还是许多肿瘤侵袭和转移的启动子[16],其在AK,SK,BCC等非色素细胞肿瘤与色素性肿瘤中的致病机制可能有所不同。
Smad7的这种矛盾的双重角色在肿瘤性疾病的研究中异常重要。但是这两种角色切换的具体机制还不明确,可能与疾病种类以及Smad7基因突变等有关,Smad7有希望成为表皮肿瘤疾病的理想靶点。
