核酸适配体在胰腺癌中的应用研究进展
2018-09-28韩冬梅邓堂刚
韩冬梅,邓堂刚,叶 茂
(湖南大学生物学院,中国湖南长沙410082)
胰腺位于腹后壁,主要功能是消化糖、脂肪和蛋白质,体积虽小,却是人体最重要的器官之一。胰腺癌(pancreatic adenocarcinoma,PAC)是常见的消化系统恶性肿瘤之一,因其早期症状不明显不易察觉,目前没有很好的诊断指标,早期诊断非常困难。近年来,核酸适配体(aptamer,Apt)因其良好的特性成为研究热点,并已筛选出多个识别胰腺癌的核酸适配体,有望实现胰腺癌的早期诊断和靶向治疗。本文对核酸适配体在胰腺癌中的应用做一总结。
1PAC的现状
PAC是一种较为常见的消化系统肿瘤,恶性程度和死亡率极高,且发病率呈现逐年上升趋势。在西方国家,PAC死亡率逐渐升高,预计到2030年,将超过乳腺癌、前列腺癌和直肠癌,成为继肺癌之后的第二大癌症[1]。据美国癌症协会估计,2017年约有53 670人(27 970名男性和25 700名女性)患PAC,仅美国就有约43 090人(22 300名男性和20 790名女性)死于该病(http://www.cancer.org/cancer/pancreatic-cancer/about/key-statistics.html,accessed on October 1,2017)。据流行病学和最终结果(The Surveillance,Epidemiology,and End Results,SEER)数据库统计,PAC患者的五年存活率仅为8.2%(2013-2017年),是所有实体瘤中死亡率最高的癌症(https://seer.cancer.gov/statfacts/html/pancreas.html,accessed on October 1,2017)。尽管数十年来,癌症的诊断技术发展迅速,在外科手术和化疗方面取得重要进步,但是PAC患者预后仍然极差[2]。研究表明,PAC从癌前病变到浸润这个过程中,基因突变数目不断增加[3]。几乎所有的胰腺导管腺癌(pancreatic ductal adenocarcinomas,PDAC)确诊患者都携带有4种已知频繁突变的驱动基因(癌基因K-RAS和抑癌基因CDKN2A、TP53、SMAD4/DPC4)中的一种或几种[3]。PAC病变早期几乎没有明显症状,所以缺乏有效的早期诊断方法,一经发现确诊基本上为PAC晚期,且大多数的PDAC患者对化疗药物不敏感,缺乏有效的治疗药物[4]。即使有15%~20%的PAC患者经过手术可将肿瘤切除,但大多数患者在一年内会复发[4]。因此,开发新的有效的PAC诊断和治疗方法具有重要意义。
2 核酸适配体
核酸适配体是通过SELEX技术得到的一种可以高特异性、高亲和性识别靶标物质的单链DNA或RNA,可以作为靶向性治疗的分子探针[5]。1990年,Tuerk和Gold[6]首次从体外随机RNA文库中筛选出对T4 DNA聚合酶具有结合亲和力的两个RNA序列,并创建了指数富集配体系统进化的技术方法。与此同时,Ellington和Szostak[7]从1010个随机序列RNA分子的大文库中分离出可以特异性结合多种有机染料的RNA,并创造了术语“aptamer”,同时将筛选到核酸适配体的过程命名为“SELEX”。SELEX程序通常包括:1)随机单链DNA或RNA文库设计和合成;2)对照筛选(负筛选);3)靶分子筛选(正筛选);4)洗脱;5)聚合酶链式反应(PCR)扩增;6)制备单链寡核苷酸文库;7)多轮筛选;8)克隆和测序;9)核酸适配体识别(图1)[8]。DNA和RNA适配体的筛选存在一些差异。获得DNA适配体,可通过常规PCR进行结合序列的扩增,随后进行单链DNA制备以产生次级文库;若筛选对象为RNA,则需先反转录为DNA,然后扩增成为双链DNA(double stranded DNA,dsDNA)并进行体外转录然后进行下一轮筛选。在SELEX过程中,一般通过8~20轮筛选富集,就能得到与靶分子高亲和的核苷酸文库,最后进化后的文库经高通量测序和挑选鉴定,即可得到最终的一条核苷酸序列。SELEX筛选技术发展迅速,针对筛选的靶标不同,有蛋白质 SELEX[9]、cell-SELEX[10]、亲和层析 SELEX[11]、组织切片 SELEX[12]、MSD-SELEX[13]、活体SELEX[14],其中以cell-SELEX最为经典。
核酸适配体通过形成特定的二级结构如发夹、环形、凸起、G4聚体等来识别不同的靶标分子[15]。相比于单克隆抗体,核酸适配体除了具有高特异性、高亲和性、稳定性和无免疫源性等特点,还有相对分子质量小、易进行化学修饰、生产成本低、识别范围广等优点。由于核酸适配体具有以上多种优点,在过去的数十年中,将其与多种纳米材料相偶联,被广泛应用在生物学检测[16]、分子诊断[17]、生物成像[18]、肿瘤分子分类[19]、药物靶向[20,21]等领域。
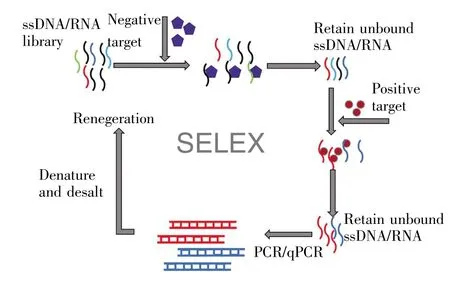
图1 核酸适配体的筛选进程模式图[8]Fig.1 Schematic of the aptamer selection[8]
3 核酸适配体在PAC中的应用
近年来,核酸适配体和核酸适配体-纳米材料偶联体在癌症检测和治疗中的应用已经引起越来越多的关注。靶向PAC的适配体在细胞、组织和动物水平的研究中已取得重大进展。筛选出的一系列靶向PAC的适配体(表1)[22~29],为PAC的诊断和靶向治疗提供了一种新的策略。
3.1 与PAC蛋白质相关的适配体
3.1.1 EGFR
表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种单体跨膜蛋白质,其与配体表皮生长因子(epidermal growth factor,EGF)结合,引起受体二聚化,导致自体磷酸化,从而激活细胞内下游信号传导。EGFR家族包括4个不同的受体:EGFR/ErbB-1、HER2/ErbB-2、HER3/ErbB-3、HER4/ErbB-4。它们在多种组织中表达,且过表达会促进细胞增殖,与多种癌症的发展和恶化相关[30,31]。30%~89%的PDAC患者会过表达EGFR,且在癌细胞和组织中均为高表达[32~34]。多项研究表明,EGFR与PDAC肿瘤大小、临床分期分级、高死亡率、预后不良[35~37]密切相关。利用EGFR抗体和小分子抑制剂可以有效抑制PAC细胞的生长和转移[38],因此,以EGFR为靶点,为治疗PAC提供了新的思路。
Li等[28]为了得到在体内具有高稳定性的适配体,设计合成了2′-氟修饰的核酸酶抗性随机文库,以纯化的EGFR蛋白为靶标,通过SELEX技术,经过9轮筛选富集,最终得到1条特异性识别EGFR的核酸酶抗性RNA核酸适配体2′-氟E07。E07本身具有一定的生物学功能,与EGF竞争结合EGFR的胞外区域,阻断受体自磷酸化,抑制肿瘤细胞的增殖。
吉西他滨(Gemzar,Gem,dFdC)是核苷类似物,和阿糖胞苷类似,都是通过影响DNA复制来抑制细胞增殖。Gem单药已被美国食品和药品监督管理局(U.S.Food and Drug Administration,FDA)批准治疗晚期和转移性PAC以及辅助治疗切除的PAC,是目前多种实体瘤治疗效果最好的单药化疗药物[39]。然而,由于其无特异性识别能力,因此无法将足够的药物运送到癌细胞中,功效受到限制。靶向递送Gem进入癌细胞在将药物功效最大化的同时也降低了对正常细胞的毒副作用。Ray等[27]开发了一种基于衍生物的合成策略,将E07与Gem相偶联。首先使Gem通过化学磷酸化形成三磷酸腺苷类似物(dFdCTP),随后聚合形成一条单链。E07 3′端延长后与Gem三磷酸化形成的单链通过碱基互补形成E07-dFdCTP聚合物。经流式和共聚焦数据证明,聚合物具有与E07同等的识别能力和内化效果,可特异性识别高表达EGFR的PAC细胞MiaPaCa-2,而不识别低表达EGFR的PAC细胞HPAF-2。聚合物进入细胞后,随着溶酶体pH下降,E07与dFdCTP双链解开,药物以单磷酸形式dFdCMP被释放到细胞质中,发挥功效,引起细胞死亡(图2)。核酸适配体E07靶向EGFR,且易内化,在PAC靶向治疗中具有很大的应用价值。将来可以将其应用在组织活体实验中,观察其在活体中的治疗效果,从而进一步推动E07在PAC诊断和治疗的临床应用。
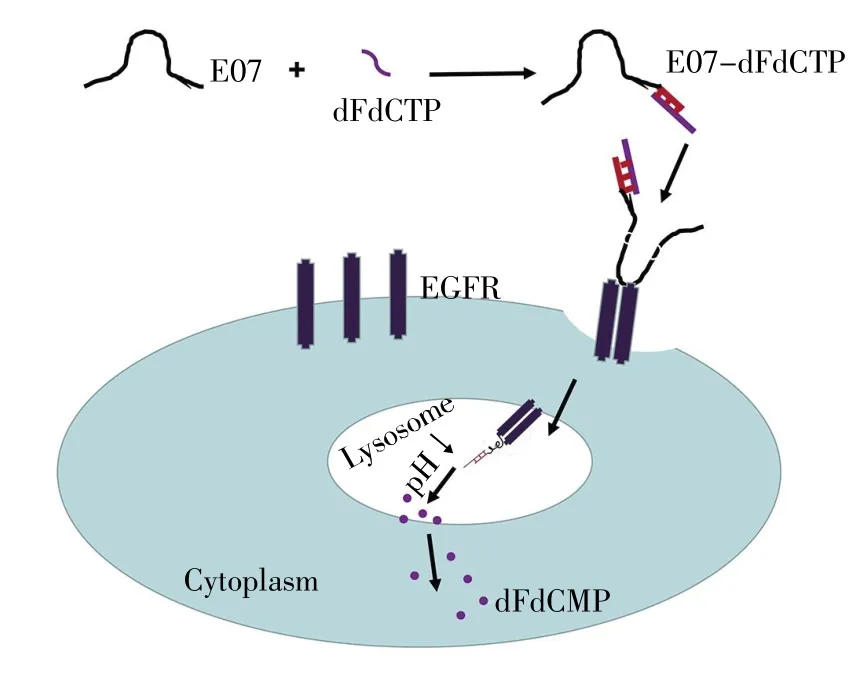
图2 E07-dFdCTP药物靶向释放模式图[27]Fig.2 Model for the E07 mediated delivery of the dFd-CTP[27]
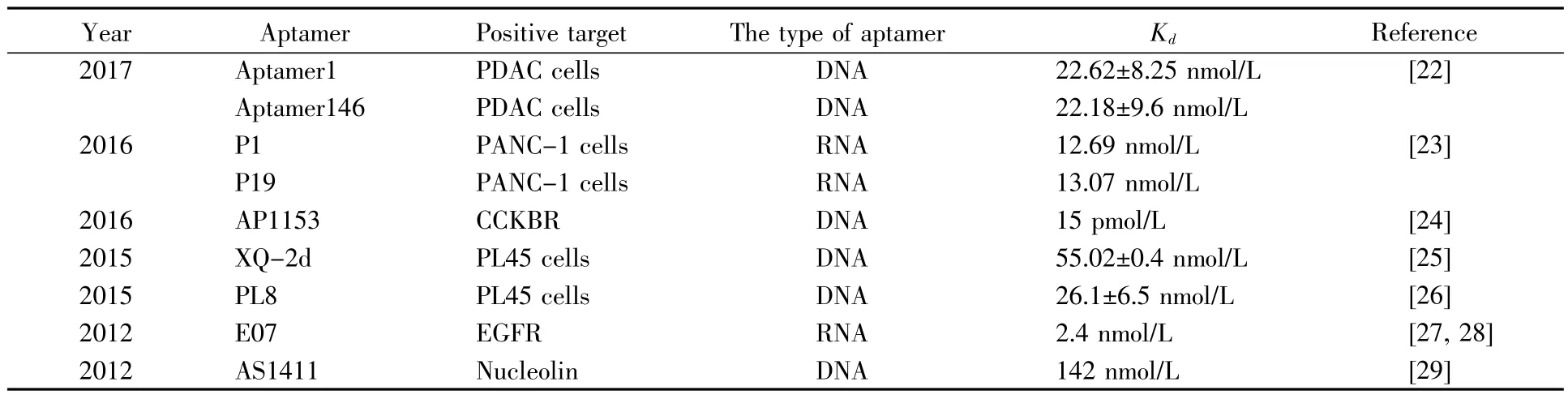
表1 靶向PAC的核酸适配体Table1 The aptamers for pancreatic cells
3.1.2 Nucleolin
核仁素(nucleolin)是一种重要的质膜蛋白质,过表达于包括PAC在内的多种肿瘤细胞膜上及其细胞质中[40],与DNA复制和核糖体组装密切相关。核仁素在人PDAC过表达,且可调控促癌因子VEGF和Ang-2水平上调,与PDAC转移性强、致死率高、预后不佳相关[41]。研究表明抑制核仁素与抗凋亡因子Bcl-2 mRNA的结合,导致Bcl-2 mRNA表达水平降低,进而诱导肿瘤细胞凋亡[42]。核仁素拮抗剂N6L是一种多肽,在PDAC小鼠模型中可明显抑制原发性肿瘤的生长和肝转移,同时也可以抑制胰腺肿瘤的血管生成[41]。核仁素抑制剂的应用是一种新的PAC治疗策略,具有很好的临床应用前景。
AS1411是一种富含鸟嘌呤核苷酸的DNA适配体,可以特异性结合细胞表面的核仁素,导致复合物内化。高剂量时,AS1411与核仁素结合,通过抑制NF-κB信号通路导致细胞周期停滞和细胞凋亡[43]。核酸适配体AS1411目前正处于复发或难治性急性髓系白血病(NCT00512083,NCT01034410)和肾细胞癌(NCT00740441)的 II期临床试验中[44],未来有望用于PAC的临床治疗。
雷公藤内酯(triptolide,TP)可抑制化疗耐药性PAC细胞系(chemo-resistant pancreatic cancer,CPC)的增殖,与Gem相比表现出更加优越的抗癌效果。但是,TP没有特异性,对正常细胞具有毒副作用。Wang等[45]成功实现了AS1411介导的纳米聚合物载体靶向CPC细胞,并尽量避免了由TP对正常细胞造成的毒性。首先将AS1411适配体与羧基封端的聚乙二醇-丙交酯偶联(HOOC-PEG-PDLLA),然后制备AS1411-PEG-PDLLA负载TP(ASPPT)。体外实验结果显示,AS-PPT具有与AS1441同等的靶向能力,以及比TP更佳的抗肿瘤效果。此外,使用生物光子成像技术观察AS-PPT(Cy3-labed TP)在组织和细胞水平上的分布,结果显示AS1411促进了TP在肿瘤组织和CPC细胞中的选择性积累。进一步构建PAC小鼠模型,对小鼠给药AS-PPT(实验组)和临床抗癌药Gemzar® (对照组),结果显示实验组小鼠生存周期更长。这项工作为攻克耐药性PAC提供了一种新的策略。
除了EGFR和nucleolin之外,胎盘样碱性磷酸酶2 (alkaline phosphatase placental-like 2,ALP PL2)、G蛋白偶联的缩胆囊肽B受体(G-proteincoupled cholecystokinin B receptor,CCKBR)、转铁蛋白受体(transferrin receptor,TfR)等均被发现在PAC细胞高表达。Dua等[46]通过cell-SELEX技术筛选得到了靶标为ALPPL2且具有核酸酶抗性的RNA适配体SQ2。Clawson等[24]得到了高亲和力、靶标为CCKBR的DNA适配体AP1153。这些核酸适配体有望提高PAC的早期诊断以及靶向治疗效果。
3.2 与PAC细胞相关的适配体
为了增强适配体对PAC细胞的特异性,Wu等[25]直接以PDAC细胞系PL45为正筛靶细胞,胰腺正常细胞系hTERT-HPNE为负筛细胞,通过cell-SELEX技术,15轮后得到信号富集,进一步通过高通量测序和挑选最终成功得到一条可以特异性识别PL45的DNA适配体XQ-2,经序列删减得到XQ-2d。适配体对PL45细胞具有高亲和力(Kd=55.02±0.4 nmol/L),靶标蛋白质初步确定为细胞表面的膜蛋白,小鼠体内成像和临床组织实验表明XQ-2d具有对PDAC诊断和分子成像的潜力,这可能有助于研究肿瘤发生的分子机制。
Champanhac等[26]同样以PL45为靶细胞,以胰腺正常细胞系TOV-21G为负筛细胞,得到8条可以识别PL45,而不识别TOV-21G的DNA适配体(PL1,PL2,PL3,PL4,PL5,PL6,PL7,PL8)。其中PL8在37℃具有更佳的内吞效果和更好的亲和性,可将其设计构建纳米系统进行靶向治疗研究。研究人员进一步用PL8构建纳米系统的识别组分(将一端碱基延长形成Tr8t),随后将其与部分互补的短DNA链(M1和M2)通过碱基互补配对自组装杂交形成NT8。NT8富含GC碱基对以便嵌入更多的阿霉素(doxorubicin,DOX)。实验结果显示,一个NT8至少可以装载50个阿霉素,大大增加了载药量(图3)。NT8靶向PL45,经内化将装载的阿霉素释放到细胞质中,特异性增加PAC细胞中的药物浓度,最终实现PAC的靶向治疗。
4 核酸适配体应用在PAC中面临的问题及展望
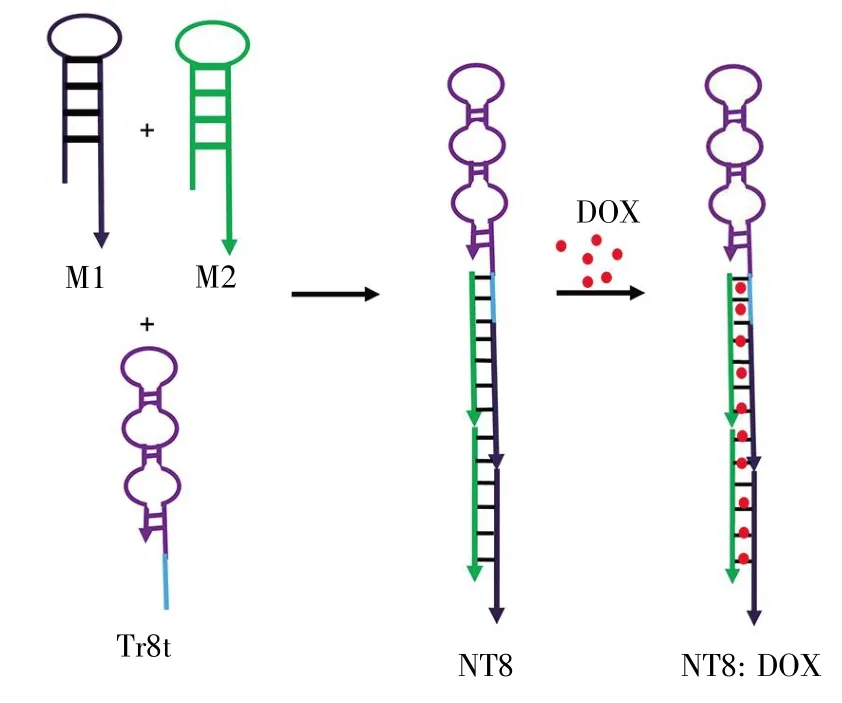
图3 NT8的形成及药物装载模式图[26]Fig.3 Schematics of the self-assembly of aptamer-tethered DNA nanotrains(NT8)and drug loading[26]
近年来,PAC发病率呈逐年上升趋势,已成为我国常见的十大恶性肿瘤之一[47]。核酸适配体的靶向特异性、高亲和性、良好稳定性、无免疫源性、易修饰、生产成本低等优势,使其成为PAC诊断与治疗相关研究的热点。核酸适配体易进行化学修饰,利用其特异性识别能力,通过与纳米材料、siRNA、CRISPR-Cas9等相偶联,可经多种方式改善PAC的靶向治疗效果。靶向PAC细胞的DNA适配体可以被开发成传感器,用于快速、高效和更加灵敏地检测PAC,有希望用于早期PAC诊断。此外,适配体可以用于构建PAC的靶向药物递送系统。迄今为止,人们已经开发了各种基于适配体的药物运送系统,其中,因为适配体偶联纳米材料可以提高载药量和控制药物释放效率成为研究热点。在这些系统中,适配体作为特定的靶向识别配体,将纳米材料装载的大量药物靶向运送到癌细胞中,发挥药物最大功效。然而,目前只有一种基于适配体的药物Macugen被FDA批准[48]。虽然有几种适配体药物已进入临床试验阶段,但是临床应用尚没有推广开来,究其原因主要是:1)适配体在体内稳定性差,体外筛选得到的适配体很容易在血清中被核酸酶降解[49];2)适配体带有负电荷,在体内容易非特异性结合具有正电荷的分子或离子;3)适配体体积小,相对分子质量小,易被肾脏快速过滤,且易非特异性积累在肝脏、脾脏等非靶器官,可能引起严重的免疫激活和聚阴离子效应,降低治疗效果;4)尽管体外适配体的毒性较低,但其体内毒性仍存在争议,需要更详细的研究。适配体的上述问题和挑战大大限制了它们在PAC的临床应用。
核酸适配体的发展为肿瘤靶向治疗提供了一种新的方法,在PAC的早期诊断和治疗中有很好的应用前景。为了推动适配体在PAC临床应用的发展,主要可从以下几个方面来解决上述问题:1)应用高效SELEX技术筛选具有高特异性、亲和力、生理稳定性及体内低副作用的适配体;2)为了改善适配体在生理环境中的稳定性,通常采用氟、氨基、甲氧基等基团进行化学修饰;3)作为野生型RNA适体(D-适配体)的镜像异构体(L-适配体)也已经被广泛应用于PAC治疗中,它们具有极好的体内核酸酶降解抗性[50,51];4)多功能纳米材料具有诸如单分散性、良好的生物相容性、低毒性、高包封率、药物可控释放等优点,将核酸适配体构建到纳米系统,可以设计合成符合临床应用要求的新型纳米材料;5)适配体的相对分子质量通常在5~15 kD范围内,虽然经过化学修饰的适配体在体内对核酸酶降解具有良好的抗性,但是易被肾代谢。偶联纳米材料增加适配体的相对分子质量可以很好地解决此问题。因此,应开发更多的适配体纳米材料偶联物来降低肾脏过滤量,从而提高适配体在PAC患者体内的浓度,改善治疗效果。
