两种试剂盒提取大鼠容受期少量宫腔液胞外囊泡的比较
2018-09-28李艳萍
黄 曦,李艳萍*
(1.中南大学湘雅医院生殖医学中心,中国湖南长沙410008;2.湖南省女性生殖健康临床研究中心,中国湖南长沙410008)
胞外囊泡(extracellular vesicles,EVs)是一种具有双层膜结构,内含蛋白质、核酸分子、脂质等丰富生物信息分子的纳米级囊泡。按照形成的方式和颗粒大小,EVs大致分为三类[1]:外泌体(exosome)、微囊泡(microvesicle,MV)和凋亡小体(apoptotic body)。其中外泌体和微囊泡都被证实可以运载生物信息并在细胞间传递,从而参与调控生物过程[2,3],比如癌细胞的迁移侵袭[4]和机体的免疫反应[5]。因此胞外囊泡具有极大的临床应用价值,除了将其自身的生物效能应用于临床治疗[6],还可以开发为疾病液体活检标志物[7]、靶向药物的载体[8]等。EVs存在于几乎所有的细胞培养上清和生物体液中。在生殖系统中,人们陆续在精液[9]、卵泡液[10]、输卵管液[11]、胚胎培养液[12]、体外培养的子宫内膜上皮细胞培养液[13]以及本研究讨论的宫腔液(uterine luminal fluid,ULF)中,都分离得到了EVs,且其中的内容物比如蛋白质、miRNA、脂质分子等都表现出和源细胞一致的特异性改变。例如,在子宫内膜不同时期(增殖期和分泌期),子宫内膜上皮细胞来源的EVs内容物也会出现相应的变化[14]。
人类的整个生殖过程极其复杂,需要多方面的协调与同步。在辅助生殖治疗过程中,一个发育良好的胚胎遇到的第一个关卡便是成功在母体子宫内膜上皮种植。因此,宫腔液作为胚胎与内膜接触之前所处的微环境,对于妊娠的早期建立十分重要。宫腔液主要由子宫内膜的分泌物、血浆渗出物和输卵管液混合而成。在胚胎种植动物模型中,子宫内膜可以通过离子通道的吸收和分泌作用调节宫腔液的水分子和离子成分,在容受期会形成宫腔液的“吸收峰”,从而调控胚胎种植[15]。2013年,Ng等[13]首次在人类宫腔液中分离得到EVs,并且发现宫腔液EVs与子宫内膜上皮细胞分泌的EVs均表达细胞表面蛋白质CD9和CD63,由此推论,宫腔液EVs可能大部分由子宫内膜上皮细胞分泌的EVs组成,从而能够实时反映子宫内膜的容受状态。2015年,Vilella等[16]发现,人类子宫内膜上皮细胞中的miR-30d在容受期表达量增加,且该miRNA可以通过EVs的形式释放到外环境,携带了miR-30d的EVs被老鼠胚胎的滋养细胞摄取后,间接激活Itgb3、Itga7和Cdh5,从而提高胚胎的黏附能力。
与常规研究的血清和细胞培养上清不同,子宫腔体积有限,可获得的宫腔液样本量往往较少,不能满足EVs传统梯度超速离心提取方法对样本量的要求。因此,如何更高效地从少量宫腔液样本中获得高纯度的EVs是首先要攻克的难题。随着EVs的研究热度逐年提升,商业化的提取试剂盒应势而生。PEG沉淀法具有操作方便、对样本量和设备要求低的优点,是目前广泛使用的主流试剂盒之一,然而该法容易产生难以去除的聚合物,导致EVs的提取纯度较低。亲和膜离心柱法是近年来推出的年轻产品,提取效能与传统离心方法接近。其利用囊泡通用生化特性进行分离,有效避免了额外的物质污染。然而作为年轻产品,亲和膜离心柱法被运用于提取少量体液样本时是否存在缺陷尚未明确。在本文中,我们分别使用PEG沉淀法和亲和膜离心柱法两款试剂盒对同一份大鼠宫腔液EVs进行提取,从形态、表面特征蛋白质和粒径分布对EVs进行多维度鉴定比较,通过进一步分析比较内含RNA的特性,最终优选出针对少量样本的EVs提取和后续EV miRNA机制研究的试剂盒。
1 材料和方法
1.1 材料
1.1.1 实验动物
从中南大学动物实验学部购入7周龄健康、性成熟、未孕的SPF级SD雌性大鼠36只,体质量(237±1.7 g),SPF级成熟雄性SD大鼠30只,动物质量合格许可证号:SCXK(湘)2016-0002。实验动物寄养于中南大学动物实验学部清洁屏障环境中,温度24℃,相对湿度50%±5%,光照12 h,充分给水,普通饲料饲养,自由摄食,每笼3~4只。新购入大鼠均饲养5~7 d适应环境后用于实验。实验员具有实验动物从业人员岗位证书,编号:7031号。
1.1.2 主要设备和试剂
水合氯醛(分析纯,安徽酷尔生物工程有限公司),低温超速离心机(Eppendorf 5424R,德国Eppen-dorf公司),超滤浓缩管-100 kD、过滤器-0.22 μm(Millipore公司,美国),RiboTMExosome Isolation Reagent(for other body fluids)(C10120-1,广州市锐博生物科技有限公司),exoRNeasy Serum/Plasma Maxi Kit(77064,德国QIAGEN公司),透射电子显微镜 (Tecnai G2 Spirit 120 kV,美国FEI公司),纳米粒度电位仪(Zetasizer Nano ZSP,英国Malvern公司),超微量分光光度计(NanoDrop2000,美国Thermo公司),生物芯片分析系统(Agilent 2200,美国 Agilent公司)。
1.2 方法
1.2.1 容受期宫腔液样本的准备
使用阴道涂片HE染色观察大鼠阴道脱落细胞,确定动情周期阶段。选择观察到两个完整动情周期的雌鼠进入实验,在动情期与雄鼠按1∶1比例合笼,第二日晨观察阴栓或精子,有则记为Pd1。
Pd5收取宫腔液。用10%水合氯醛按0.3 mL/300 g麻醉大鼠后,腹部剃毛,在耻骨联合上约1~2 cm处沿腹部正中线向上剪开约3~4 cm的创口。在膀胱后方寻找双侧宫颈汇合处,沿此向上小心分离出双侧子宫及卵巢,轻柔分离周边的结缔组织及血管,尽量减少组织碎片及血流对宫腔液的污染。温盐水浸湿无菌纱布,垫铺在子宫与大鼠躯干之间,动脉夹沿着双侧宫颈汇合处夹闭子宫下端,用1 mL注射器抽取0.5 mL PBS,换4号针头沿子宫下端穿刺进入宫腔,灌注约0.5 mL后子宫明显充盈,等待片刻后用无菌显微眼科剪沿输卵管远端,在子宫上端剪开创口,同时以1.5 mL无菌离心管收集宫腔灌洗液。宫腔液收集后,0.22 μm过滤器滤去组织碎片及细菌,4℃下2 500 g离心30 min,取上清。
合并6只大鼠宫腔液为一个样本进行分析。使用超滤浓缩管4℃、4 000 g离心10 min,保留滤液作为后续Western-blot阴性对照,收集浓缩液(约300~500 μL),混匀后平均分配成两份样本进行EVs提取实验。
1.2.2 子宫内膜胞饮突表达情况的扫描电镜观察
随机剪取约1 cm子宫,沿中线剖开,展平后用生理盐水冲洗,浸泡于2.5%戊二醛电镜固定液,使用扫描电镜(scanning electron microscope,SEM)观察内膜上皮的超微结构,通过胞饮突表达情况确定其处于容受期(图1)。
1.2.3 沉淀法分离ULF-EVs
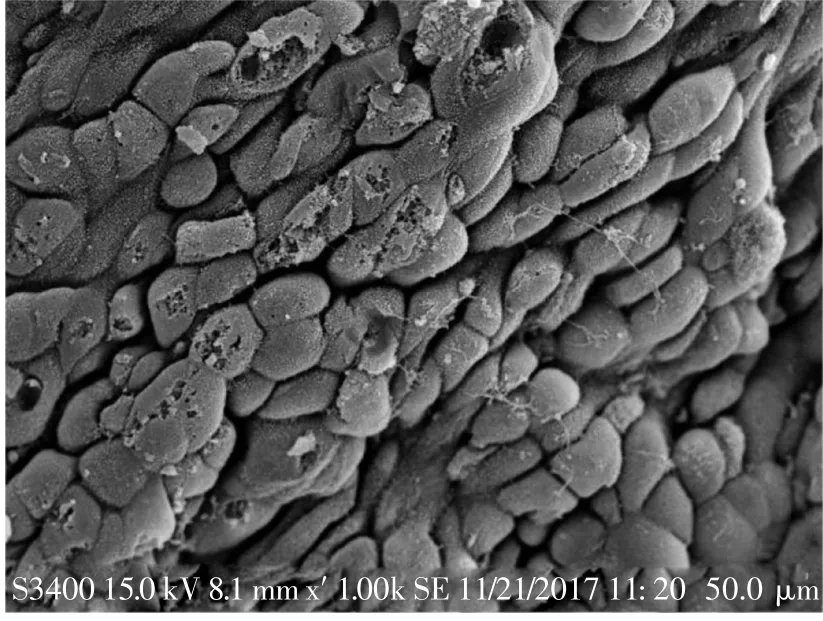
图1 容受期可见子宫内膜胞饮突发育Fig.1 Fully developed pinopode can be observed during the phase of receptivity
按照RiboTMExosome Isolation Reagent(广州市锐博生物科技有限公司)使用说明提取宫腔液EVs。将上述浓缩液转移至新的1.5 mL离心管,置于冰上,加入1/3体积的RiboTM试剂,混匀后,4℃静置过夜;第二日对混合液进行4℃、1 500 g离心30 min,弃上清液,保存沉淀。需要进行后续实验时,将PBS使用0.22 μm过滤器过滤后,重悬EVs沉淀,标记为R。
1.2.4 亲和膜离心柱提取ULF-EVs
按照exoRNeasy Serum/Plasma Maxi Kit-77064(QIAGEN公司,德国)使用说明提取宫腔液EVs。往浓缩液加入1.5倍体积的binding buffer XBP,颠倒混匀后室温静置5 min,转换至离心柱,离心后弃洗脱液。往离心柱加入buffer XWP,离心洗去亲和膜中的杂质,保留部分洗脱液。最后,往离心柱内对着亲和膜加入buffer XE,孵育1 min后离心,将洗脱液滴进同一亲和膜,孵育1 min后离心,保存洗脱液,标记为Q。
1.2.5 EVs形态的透射电镜观察
该实验在中南大学高等医学中心生物医学电镜实验室进行,设备使用Tecnai G2 Spirit 120 kV透射电子显微镜(transmission electron microscopy,TEM)。大致步骤如下:1)PBS先后经过0.45 μm和0.22 μm过滤器备用。取上述宫腔液EVs洗脱液约20 μL,加入filtered-PBS稀释5倍,混匀;2)取10 μL宫腔液EVs悬液滴至电镜铜网状栅,保留至少 20 min;3)1×PBS 50 μL固定 1 min,重复2~3次;4)4%戊二醛10 μL固定5 min后,滤纸吸干,1×PBS洗涤1次,室温下自然晾干;5)将洗涤后的铜网置于电子显微镜下进行观察。
1.2.6 EVs表面特征蛋白质的Western-blot分析
R-重悬液和Q-洗脱液均使用BCA法测定蛋白质浓度。经过电泳、转膜、封闭后,使用CD63(#Rabbit 1∶500,Proteintech)、TAPA-1/CD81(#Rabbit 1∶1 000,Proteintech)和 β-actin(#Mouse 1∶5 000,Proteintech)4℃孵育过夜。次日使用HRP标记的二抗(Proteintech)(鼠抗稀释比例1∶5 000,兔抗稀释比例1∶6 000)与膜共同孵育120 min。洗膜后显色曝光。
1.2.7 粒径分布的动态光散射测量
事先将纯水经0.22 μm过滤器过滤后高温消毒备用并设为阴性对照,分别与20 μL R-重悬液和20 μL Q-洗脱液混合至检测所需的样本量(约1 mL),缓慢注入一次性干净粒径样品池,避免气泡,使用无尘纸擦拭管壁光路。所有操作按照设备Zetasizer Nano ZSP(Malvern公司,美国)的使用说明书进行。
1.2.8 RNA的分离提取及分析
使用miRNeasy Micro Handbook(QIAGEN公司,德国)提取R-沉淀,使用exoRNeasy Serum/Plasma Maxi Kit提取Q-膜结合EVs。前者将R-沉淀与QIAzol混匀碎膜,样本记为r,后者直接将QIAzol加入至亲和膜中(免除XE洗脱EVs),样本记为q。后续步骤大致相同,使用氯仿使裂解液液相分离,取上层液相利用亲和膜原理逐步分离剔除杂质,最终用无酶水洗脱得到total RNA。使用超微量分光光度计(NanoDrop2000,美国Thermo公司)分析其纯度(A260/280)及浓度。使用生物芯片分析系统-Agilent 2200(Agilent公司,美国)检测浓度和片段分布。
1.2.9 图像处理及统计分析
图像处理使用 GraphPad Prism 7.0、Image-Pro Plus 6.0及Origin Pro 2015软件包。统计分析使用SPSS 22.0软件包。计量资料结果用±s表示,若方差齐采用t检验;方差不齐则采用非参数检验。计数资料以百分率表示,采用卡方检验。P值均为双侧概率,检验水准α=0.05,必要时进行校准。本文的差异显著性采用字母标记法,同一图表的同行(列)中,不同肩标字母表示组间具有统计学差异,大写字母P<0.01,小写字母P<0.05,无肩标则无统计学差异。
2 结果
2.1 EVs的形态鉴定
利用TEM法观察两种试剂盒所提取EVs的形态(图2),图片分析使用Image-Pro Plus 6.0。我们发现,PEG沉淀法提取的EVs聚集成团,离心柱提取的EVs颗粒分散,背景更为干净(图2A)。从得到的EVs亚群来看,PEG沉淀法提取多为外泌体,大小均一,可见多个圆形囊泡结构聚集,离心柱提取的EVs则包含了外泌体和微囊泡两种囊泡结构(图2B)。此外,PEG沉淀法中的杂质表现为松散结合的粒子,结构模糊;离心柱提取的杂质大多表现为蛋白质样的矩形结晶(图2C)。

图2 EVs形态的TEM观察Fig.2 Morphological observation of EVs under TEM
2.2 EVs表面特征蛋白质鉴定结果
使用Western-blot鉴定EVs表面特征蛋白质,同时采用BCA法测量EVs表面蛋白质浓度,结果见图3。两种方法提取的EVs均表达CD63和TAPA-1(图3A),其中离心柱提取的Q-洗脱液中总蛋白质的量较高,间接表明EVs浓度更高(图3B),但Q-洗脱液中特征蛋白质CD63和TAPA-1相对于内参β-actin的表达量与R-重悬液中的表达量并无统计学差异(图3C),因此我们认为亲和膜离心柱得到的洗脱液中存在较多的蛋白质污染。
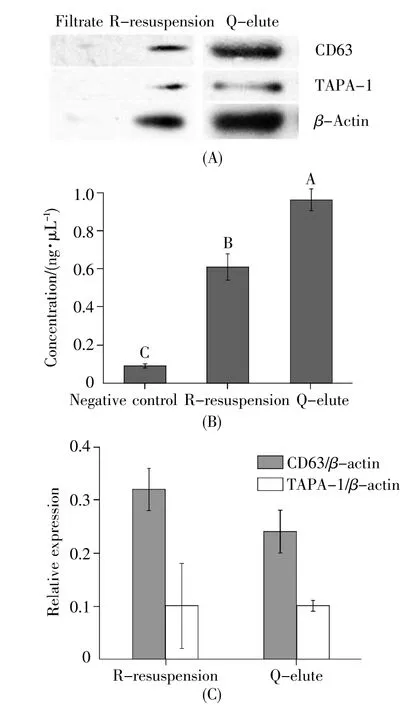
图3 EVs表面特征蛋白质检测Fig.3 Identification of specific surface proteins of EVs
2.3 EVs粒径分布
采用动态光散射(dynamic light scattering,DLS)对两种方法提取的EVs进行粒径分布分析,结果如图4所示。R-重悬液第一个峰的范围为4.8~15.69 nm,峰值8.7 nm,占比42.7%,第二个峰的范围为58.8~458.7 nm,峰值141.8 nm,占比57.3%。Q-洗脱液第一个峰的范围为46.12~73 nm,峰值59.56 nm,占比14.5%,第二个峰的范围为131.5~385.4 nm,峰值258.5 nm,占比85.5%。与电镜下的粒子分布相符合。
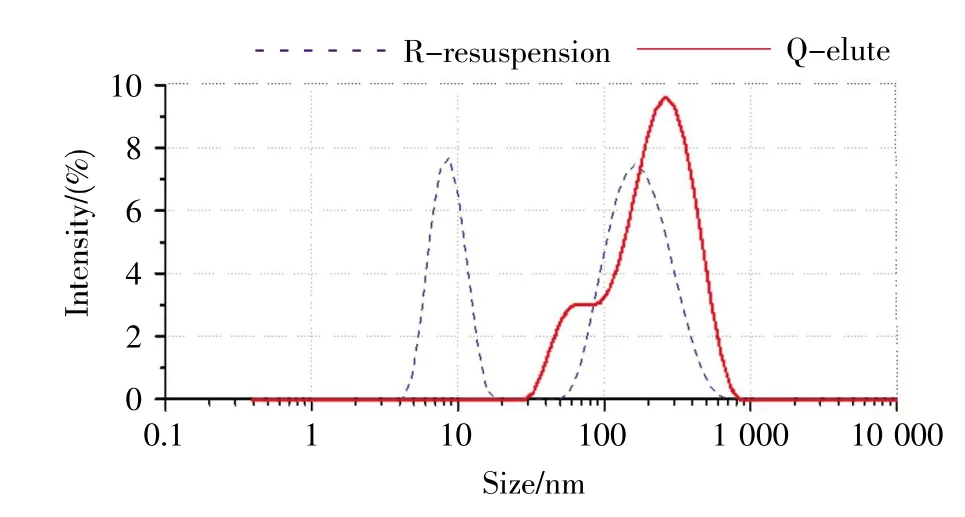
图4 EVs粒径分布Fig.4 Size distribution of EVs
2.4 两种方法对内含总RNA浓度和片段分布的影响
选取A260/2801.8~2.2间的样本,测量总RNA浓度(表1)。我们发现PEG沉淀法得到的ULF-EVs的总RNA浓度更高。进一步对两种方法提取的ULF-EVs总RNA进行片段分析,结果如图5所示。两种方法提取的EVs的RNA片段基本为小于200 nt的小片段峰,无明显长片段峰,提示小RNA含量相对较高,可以进行后续sRNA(small RNA)研究。同时,我们发现R-重悬液在100 nt左右出现一个明显高峰,Q-洗脱液的片段分布集中在20~40 nt,因此我们认为Q-洗脱液更适用于miRNA的建库测序分析。

表1 RNA浓度测定结果Table1 Concentration of total RNA measured by NanoDrop 2000
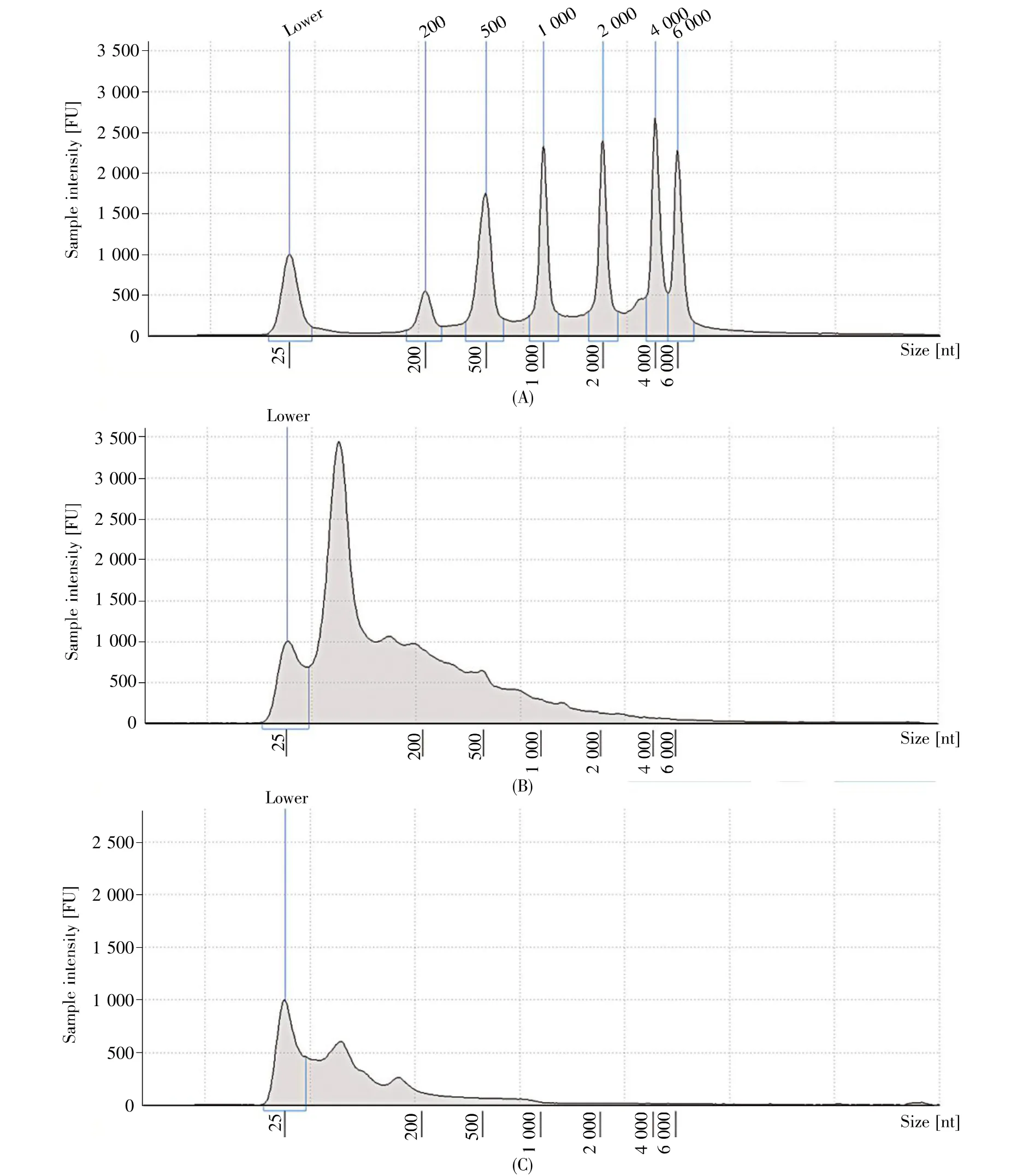
图5 RNA片段分布分析Fig.5 Analysis of RNA fragment distribution
3 讨论
1985年,人们首次在体外培养的绵羊红细胞上清液中使用电镜发现细胞正在向外释放胞外囊泡[17]。彼时,这小小囊泡被认为是细胞抛弃的“垃圾”,并未引起人们的重视。随着EVs调节免疫和癌症增殖转移作用的发现[18],人们逐渐认识到它可能是细胞间除了旁分泌、自分泌和远距分泌以外的一种新形式。EVs根据形成方式大致分为三类[19]:1)外泌体,直径30~100 nm,由细胞内多囊泡体(multivesicular body,MVB)与细胞膜融合后,通过胞吐作用向外释放至外环境,大小较为均一,经典的电镜图片可以看见茶托样结构;2)微囊泡,粒径偏大,直径100~1 000 nm,由细胞质膜直接出芽释放至外环境,大小欠均匀,电镜下可呈现不规则样形状的电子高密度影,由膜结构样低密度影包绕;3)凋亡小体,为细胞凋亡过程中形成的1~4 μm的电子囊泡。近年来人们对EVs的研究热度迅速上升,几乎所有的细胞都可以分泌EVs[20~23],几乎所有的生物体液都发现了 EVs[24~26],生殖系统也不例外[27~31]。
1986 年,Psychoyos[32]提出“容受期”(phase of receptivity)概念:在人类和哺乳动物存在一个共同现象,一次成功的种植要求母体和胚胎在时空上达到同步。这意味着,不仅胚胎需要发育至具有着床能力的囊胚阶段,子宫内膜也要进行相应转变进入容受状态。子宫内膜容受性(endometrial receptivity)指子宫内膜对胚胎的接受能力,呈现出一定的时间性和空间性,因此也称作胚胎植入的着床期或称“种植窗”(window of implantation,WOI),在这个短暂开放的窗口期内,子宫内膜的分泌能力及黏附分子的表达将发生一系列的改变,这样才能对胚胎呈现接受状态。活化的胚胎与容受状态的子宫内膜相互识别交流,共同完成种植。宫腔液主要由子宫内膜上皮分泌而来,其理化性质[15]和内含的生物活性分子[14]都会受到子宫内膜上皮的即时性调节,比如:胚胎种植期间高水平的雌激素会影响内膜上皮的“水通道”,从而形成过多的宫腔液[33]。母体的应激和营养状态都会影响宫腔液内含的蛋白质、脂质和游离的核酸等生物分子,其中,在宫腔液发现的胞外囊泡成为了后起之秀。
目前提取EVs的常见方法[34]有:1)梯度超速离心法[35]。此为经典提取方法,在梯度离心下层层剔除细胞碎片等杂质,但对设备要求高,提取时间长,且高速离心所产生的剪切力可能对囊泡结构产生破坏。另外,对样本量也有要求,无法对类似本研究的少量样本进行提取;2)免疫磁珠法。该方法可特异性地与靶物质结合,可以更有针对性地面向特定人群或者特定的细胞系提取EVs,但该方法效率低,EVs生物活性易受pH和盐浓度影响,不利于下游实验;3)色谱法[36]。其利用凝胶孔隙的孔径大小与囊泡尺寸的相对关系对样本进行分离,由此分离得到的囊泡在电镜下大小均一,但需要使用特定的色谱柱进行提取,价格较贵,耗材不易获得;4)沉淀法。该方法主要利用聚乙二醇可与疏水性蛋白质和脂质分子结合共沉淀的特性来沉淀EVs,但其纯度和回收率低,杂蛋白较多(假阳性),颗粒大小不均一,易产生难以去除的聚合物。随着对EVs理化性质认识的加深,现已有更多的提取方法面世,比如:哈佛医学院团队研发的新型微流体芯片装置[37],本实验中使用的QIAGEN公司研发的亲和膜离心柱。遗憾的是,到目前为止仍然没有一种方法能同时保证外泌体/微囊泡的含量、纯度、生物活性。
在早期宫腔液EVs的研究中,人们采用梯度超速离心法及PEG沉淀法(ExoQuick-TC)分离人和哺乳动物的宫腔液EVs[13,38],鉴定结果提示PEG沉淀法也能达到与经典超速离心法同样的EVs提取效果。在某些提取细胞上清外泌体的实验中甚至还发现,PEG沉淀法比传统离心法具有更高的产量和纯度[39],提取时间缩短至4~6 h(Exo-Quick-TC)。在本实验中,我们选取了一款年轻产品——亲和膜离心柱与PEG沉淀法进行比较。该方法通过将生物液体中的EVs结合在亲和膜中,利用生物流体特性将膜中杂质逐步洗脱达到纯化的目的,避免了添加物的污染,且操作大大简化,提取时间缩短至1 h。当需要进行RNA提取实验时,可以直接将裂解液加入至亲和膜中反应,大大节省了操作步骤。有研究者成功用该方法提取了血清[40]和卵泡液[41]中的EVs,基本上能达到传统离心法的提取效果。目前,该试剂盒从宫腔液样本中提取EVs的应用还鲜见报道。
在本实验中,超滤浓缩后的宫腔液样本量大约为300~500 μL,将其平均分配成两个样本后分别使用PEG沉淀法和亲和膜离心柱进行提取。TEM形态鉴定结果显示,两种方法都可观察到囊泡样结构,沉淀法的EVs聚集成团,颗粒大小分布平均,背景污染物较多;亲和膜法的EVs颗粒分散,可见外泌体及微囊泡样囊泡结构,背景干净,存在蛋白质晶体样矩形颗粒物污染。两种方法提取的EVs均表达外泌体表面特征蛋白质CD63、TAPA-1,其中亲和膜法的EVs浓度更高,但因为两组的表面特征蛋白质相对于β-actin的相对表达量并没有明显差异,结合电镜下对Q-洗脱液杂质的观察,我们认为亲和膜法获得的洗脱液中存在较多蛋白质污染的情况。粒径分析显示两种方法都不能准确分离外泌体和微囊泡,PEG沉淀法的重悬液中存在10 nm左右的粒子杂质。尽管EVs的研究在近年来成为一大热门,囊泡在细胞间的通讯、药物载体等临床应用潜能引人瞩目,但是其生物活性研究的前提在于保证提取的纯度,因此本实验的主要目的在于对比两款试剂盒在少量样本中提取EVs的效果,在生物活性方面简单探讨了两种提取方法对EVs内容物RNA的影响。结果显示,两款试剂盒提取的宫腔液EV RNA都可以满足后续sRNA的实验要求,其中沉淀法获得的RNA浓度虽然更高,但在100 nt左右出现一个明显高峰,而亲和膜法洗脱液的RNA片段分布集中在20~40 nt,因此我们认为亲和膜法更适用于miRNA的建库测序分析。另外需要指出的是,本研究中选购的PEG沉淀试剂盒价格较低,较离心法时间缩短,但仍需要4℃过夜;亲和膜离心柱试剂盒价格较高,需要特定的耗材,但无需过夜,提取时间极大缩短,从获得宫腔液到最终提取EV RNA只需要2~3 h。
得益于膜结构对运载分子的保护,EVs具有成为临床诊断标志物的潜力。随着人们对它们的理化性质、形成方式[42,43]、靶向运输机制[16]等各个生物过程研究的深入,利用EVs进行药物运输和靶向治疗也逐渐成为可能。但针对EVs生物活性的研究前提是保证其提取纯度,因此就目前来说,对EVs及其亚群的提取纯化仍然是首要克服的关键问题。在本研究中,我们选择大鼠容受期的少量宫腔液作为研究对象,使用PEG沉淀法和亲和膜离心柱两款试剂盒提取宫腔液胞外囊泡并进行比较。这两种方法相对于传统离心法来说,对样本量要求低,设备耗材容易获得,操作简单,耗时短。我们的实验证明了这两款试剂盒都可以成功从少量的宫腔液中分离得到EVs。其中,亲和膜离心柱提取法价格更高,耗时短,提取的EVs浓度更高,RNA片段集中在20~40 nt,更适用于miRNA的建库测序。
综上所述,本实验为后续进一步研究宫腔液EV miRNA对胚胎着床的调控机制提供了方法学基础。
