急性抗阻运动通过激活Notch信号通路增加Mighty基因的表达
2018-09-28陶昌勇
陶昌勇
(滁州城市职业学院,安徽 滁州 239000)
肌肉生长主要依赖于肌卫星细胞增殖分化,导致肌纤维长度和周径增加.研究证实生肌过程主要由生肌决定因子家族(MRFs)、心肌细胞增强子家族(MEF2s)和肌肉生长抑制蛋白myostatin(MSTN)调控.MSTN作为转化生长因子β(transforming growth factor β,TGF-β)家族成员之一,具有此家族的典型结构特点.研究发现MSTN在骨骼肌内大量表达,可以负向调控肌肉发生[1].MSTN先与活化素受体蛋白ⅡB(ActRⅡB)结合,增加Smad2/3介导的基因转录,抑制肌肉生长[2].大量研究发现,抑制MSTN通路可以促进肌肉生长,如敲除基因MSTN或是注入MSTN抗体或抑制其与ActRⅡB结合等均可以诱导肌肉生长[3-4],而过表达MSTN则导致小鼠骨骼肌萎缩[5].MSTN通路表达异常会影响肌肉质量.
Mighty基因是Marshall等[6]在2008年通过小鼠消减抑制杂交文库筛选出的MSTN下游直接调控基因,填补了MSTN调控肌肉生成上下游基因的空缺,可以作为MSTN通路的标记因子.有研究发现急性抗阻运动可以抑制MSTN的转录[7],但目前为止,并无急性抗阻运动对Mighty基因影响的研究.在肌卫星细胞和骨骼肌重塑的研究中发现Notch信号通路可以通过抑制TGF-β通路调节肌肉生长[8].MSTN作为TGF-β成员之一,Mighty是MSTN调控肌肉生长的关键因子,急性抗阻运动是否也是通过Notch信号通路来抑制Mighty的转录呢?为此,本研究将检测急性抗阻运动后24 h内小鼠腓肠肌Notch信号通路和Mighty基因的动态变化,探讨急性抗阻运动对Mighty的影响及其可能的调节机制.
1 材料和方法
1.1 动物及分组
健康雄性5周龄C57BL/6小鼠30只,体重 19.53±2.06 g,购于西普尔-必凯实验动物中心,常规分笼饲养,每笼6只,自由饮食饮水,温度22±2 ℃,湿度40%~60%.随机分为5组:对照组(C)、运动后即刻组(E0)、运动后6 h组(E6)、运动后12 h组(E12)、运动后24 h组(E24),每组6只.
1.2 运动模型
运动组进行负重爬梯训练.将爬梯放置成80°的斜面,将小鼠置于爬梯底端,从轻摇爬梯促使小鼠爬梯,至其自愿连续爬梯至顶端,使小鼠熟悉爬梯.适应性训练时,小鼠尾部负重爬梯,从爬梯底端到顶端后休息1~2 min,然后将小鼠再次置于底端,促使其攀爬,每6次为一个单元,每天进行2个单元的训练,2个单元之间间隔20 min.负荷分别为小鼠自身体重的25%、50%、75%、100%,进行递增负荷的适应性训练,为期7 d.第1 d 2个单元训练均负重25%体重;第2 d第1单元负重25%体重,第2单元负重50%体重;第3 d 2个单元均负重50%体重;第4 d第1单元负重50%体重,第2单元负重75%体重.以此类推,负重直至达到100%体重(具体方案如表1所示).然后以自身体重100%负荷进行正式负重爬梯运动,方案与第7 d一致,为期1天.对照组置于爬梯上自由活动.
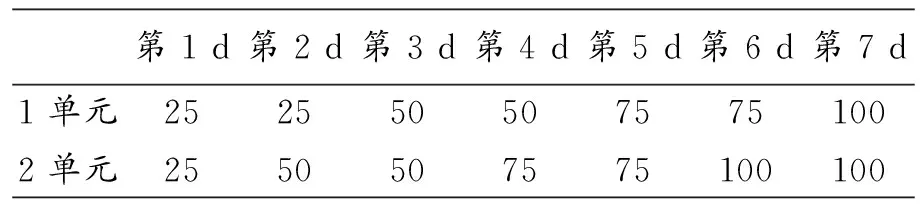
表1 小鼠负重爬梯运动适应性训练表/%
1.3 取材
小鼠进行1次正式负重爬梯运动后即刻、6 h、12 h、24 h,腹腔注射戊巴比妥钠麻醉小鼠,断头处死,取左右侧腓肠肌,标记后置于液氮中.取材完毕转移入-80 ℃冰箱,待测PCR及Western Blot.
1.4 RT-PCR检测腓肠肌内MSTN和Mighty mRNA的表达
取适量腓肠肌组织,使用Trizol法提取小鼠腓肠肌内总RNA,以20 μL逆转录反应体系,37 ℃,反转录反应15 min;98 ℃,酶失活反应5 min.得到的cDNA保存于-20 ℃.据RT-PCR试剂盒说明进行如下操作:加入10 μL SYBR green PCR Master Mix,ROX 0.4 μL,上下游引物各0.04 μL,2 μL cDNA,补充dH2O至20 μL.MSTN上游引物:5'-TAGCAGATTCAATAGTGGTC-3';下游引物:5'-ATTGAAATTTGACTGGGAGC-3';Mighty上游引物:5'-TGAAGCGGCCCATGGAGTTC-3';下游引物:5'-TTGGCCTTGTCCCGTATCGC-3';β-actin上游引物:5'-CTCTTTTCCAGCCTTCCTTCT-3';下游引物:5'-TGGAAGGTGGACAGTGAGG-3'.按RT-PCR扩增循环参数:预变性95 ℃,1 min;以95 ℃,15 s;60 ℃,30 s;72 ℃,45 s为一循环,进行40个循环,记录Ct值,根据2-△△Ct法计算相对表达量.
1.5 Western Blot检测腓肠肌内NICD蛋白水平
以每20 mg组织加入100~200 uL的含PMSF的Western裂解液中混匀,置于瓷珠匀浆仪中匀浆,冰上静置10 min,重复2~4次.12 000 g离心3~5 min(4 ℃),取上清,置于-80 ℃冰箱待测.根据BCA蛋白浓度测定试剂盒步骤(碧云天),测定蛋白的含量.采用SDS-PAGE电泳将蛋白转移至PVDF膜上.2 h封闭后加入一抗(NICD,1∶500,c-23 307,santa),4 ℃下摇床孵育过夜.次日加入二抗(HRP,IgG,1∶1 000,碧云天),室温摇床孵育2 h.TBST摇床洗10 min×3次,使用ECL发光显影(避光),Alpha凝胶成像系统自动曝光,捕捉图像,Image J1.46进行灰度值分析,将NICD蛋白与内参蛋白的平均密度之比作为NICD的相对表达水平.
1.6 统计分析
使用SPSS进行统计学分析计算,数据处理使用单因素方差分析,p﹤0.05:显著性差异,p﹤0.01:极显著性差异.所有数据均用均数±标准差来表示.
2 实验结果
2.1 急性抗阻运动对小鼠腓肠肌Mighty和MSTN基因表达的影响
如图1所示,与对照组比较,运动组小鼠腓肠肌内Mighty mRNA表达在急性抗阻运动后即刻开始上升,但没有显著性差异(p>0.05),在运动后6 h时出现了显著性差异(p<0.05),运动后12 h Mighty mRNA达到峰值(p<0.05),随后开始下降,但在运动后24 h也有显著性差异(p<0.05).
如图2所示,与对照组比较,运动组小鼠腓肠肌内MSTN mRNA水平在急性抗阻运动后即刻开始下降,此时并无显著性差异(p>0.05),运动后6 h下降到最低并出现显著性差异(p<0.05),随后开始上升,在运动后12 h也出现显著性差异(p<0.05),但在运动后24 h无显著性差异(p>0.05).
2.2 急性抗阻运动对小鼠腓肠肌Notch信号通路的影响
与对照组比较,急性抗阻运动后即刻小鼠腓肠肌内NICD表达上调,并出现显著性差异(p<0.05),此现象一直持续到运动后6 h(p<0.05),在运动后12 h、24 h并无显著性差异(p>0.05)(见图3和图4).
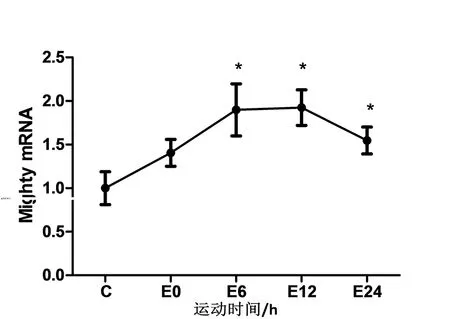
图1 急性抗阻运动对Mighty mRNA表达的影响
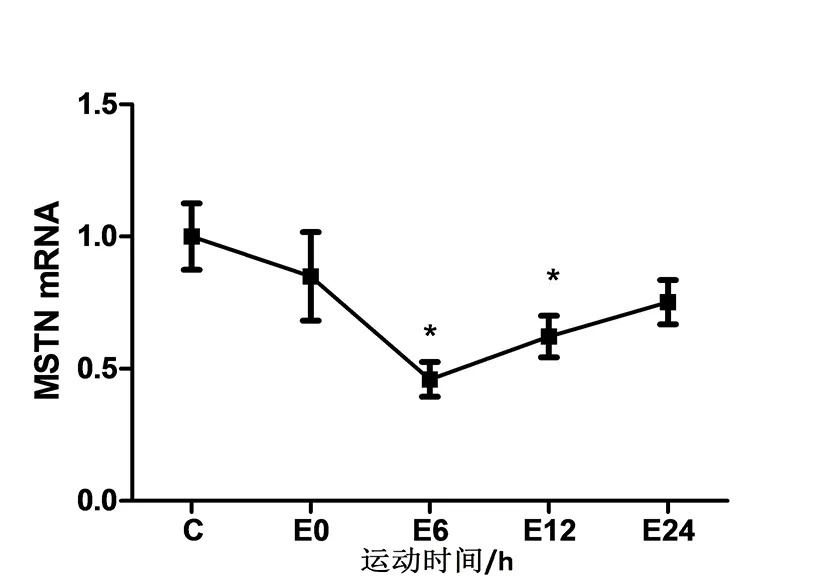
图2 急性抗阻运动对MSTN mRNA表达的影响

图3 NICD Western Blot 检测图
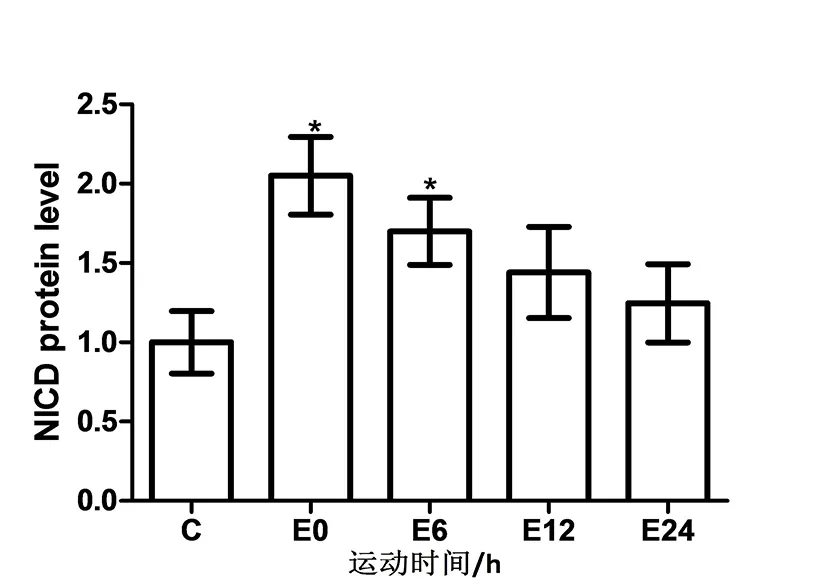
图4 急性抗阻运动对小鼠腓肠肌NICD蛋白水平的影响
3 分析和讨论
运动训练可以引起骨骼肌肌纤维体积增大,肌肉蛋白质代谢加强等适应性变化.本实验采用了急性抗阻运动,是据Troy[9]等的训练方法略作修改而得.Troy等发现8周的负重爬梯训练促进了肌纤维生长,诱导了肌肉肥大.而本实验采用了急性负重爬梯训练,虽然一次抗阻运动可能对肌肉蛋白质代谢的作用并不明显,但是长期运动也是急性运动累积的结果.本实验检测急性抗阻运动后即刻、6 h、12 h、24 h等时间点Mighty、MSTN以及Notch信号通路的变化,探讨了急性运动后骨骼肌内各因子的动态变化,为长期运动诱导肌肉肥大提供了理论基础.
Mighty是2008年由Marshall等发现的MSTN下游直接调控基因,可以反映MSTN信号通路的转录活性,但是目前国内并无研究人员进行运动后Mighty基因变化的研究.本研究发现急性抗阻运动后Mighty mRNA开始增加,在运动后6 h时出现了显著性差异,运动后12 h达到峰值,尽管随后有所下降,但运动后24 h仍具有显著性差异.提示,急性抗阻运动可以上调小鼠腓肠肌内Mighty基因的表达.在C2C12细胞中过表达Mighty可以导致细胞周期提前退出,p21、MyoD、MyoG、MyHC等肌肉分化标记因子增强,融合指数显著上升,形成肥大的肌管[10].而在mdx小鼠(肌营养不良小鼠模型)中过表达Mighty可以增加胫骨前肌纤维横截面积.提示,外源性补充Mighty可以促进肌细胞分化导致骨骼肌肥大.本实验通过负重爬梯训练,观察到小鼠骨骼肌内Mighty表达增加,说明抗阻运动可能通过提高Mighty表达来促进肌肉肥大,但是由于本实验采用急性抗阻运动,并没有从宏观上检测骨骼肌质量的变化,今后将继续进行长期抗阻运动对Mighty表达及骨骼肌质量的影响.
本研究同样检测了急性抗阻运动后24 h内MSTN基因表达的动态变化,发现运动后即刻MSTN表达开始减少,在运动后6 h降到最低,随后开始上升,12 h仍具显著性差异,但在24 h时MSTN表达与对照组无显著性差异,提示急性抗阻运动后MSTN表达受到抑制.贺道远等[11]研究了急性跑台运动对大鼠骨骼肌MSTN mRNA表达的影响,发现急性运动后大鼠骨骼肌MSTN表达下降.张靓等[12]研究发现长期跑台运动可以抑制腓肠肌内MSTN表达,但并不能改变比目鱼肌内MSTN表达水平.但是目前国内关于急性抗阻运动对骨骼肌内MSTN表达影响的研究较少见,本实验弥补了国内该方面研究的不足.此外,Haddad等[13]研究发现抗阻运动可以显著抑制骨骼肌内MSTN的表达,与本研究所得结果一致,但是Haddad采用了电刺激促使肌肉抗阻收缩的方式作为抗阻运动模型,而本研究采用的是负重爬梯训练.在C2C12细胞内加入MSTN可以抑制Mighty启动子活性,再向培养液中添加MSTN拮抗剂后Mighty启动子活性逐渐恢复,提示MSTN在转录水平上调控Mighty基因表达.MSTN先与活化素受体蛋白ⅡB(ActRⅡB)结合,增加Smad2/3介导的基因转录,实现其功能.本研究发现急性抗阻运动后24 h内MSTN mRNA的动态变化恰好与Mighty mRNA变化相反,提示急性抗阻运动通过抑制MSTN表达来增加Mighty基因的转录.
有研究发现Notch信号通路可抑制骨骼肌细胞内的TGF-β信号通路,促进骨骼肌肥大.在衰老过程中TGF-β信号通路和Notch信号通路平衡被破坏,抑制了骨骼肌的重塑[14].诱导睾酮素水平增加不仅可以激活Notch信号通路、抑制TGF-β通路[15],也可以激活肌卫星细胞,促进骨骼肌肥大[16].而且MSTN是TGF-β家族成员之一,提示MSTN信号通路和Notch信号通路相互作用,共同调控骨骼肌质量.本研究发现急性抗阻运动后即刻NICD蛋白表达显著上调,并持续到运动后6 h,NICD是由Notch受体和Notch配体结合后经由α分泌酶和γ分泌酶酶切产生的,是Notch信号通路的标记性蛋白,提示急性抗阻运动后即刻Notch信号通路即被激活.本研究还发现MSTN在运动后6 h表达显著性下调,Mighty基因在运动后6 h显著性上调,说明MSTN信号通路变化是在Notch信号通路被激活之后产生的.Mighty基因是MSTN通路下游直接转录因子,提示急性抗阻运动可能通过激活Notch信号通路增加了Mighty基因的转录.
4 结论
急性抗阻运动可以抑制MSTN通路表达,增加Mighty基因的转录,其分子机制可能与急性抗阻运动后Notch信号通路的激活有关.
