MEG3和腺苷对HepG2细胞自噬和增殖的影响*
2018-09-27蒲泽锦李国平詹浩炼周小涛郭益添项梦琦刘丽璇吴灵飞
蒲泽锦, 李国平, 詹浩炼, 周小涛, 郭益添, 项梦琦, 刘丽璇, 谭 辉, 吴灵飞△
(汕头大学医学院第二附属医院 1消化内科, 2放射科, 广东 汕头 515041)
长链非编码RNAs(long non-coding RNAs, lnc-RNAs)是长度超过200个核苷酸的非编码RNA家族。母系表达基因 3(maternal expressed gene 3, MEG3)是人体内lncRNAs之一,定位于人染色体14q32.3,在表观遗传、基因转录和蛋白水平等多方面调节细胞生理和病理过程[1-2]。MEG3活化后可诱导细胞凋亡,在卵巢癌[3]、神经胶质瘤[4]、肺癌[5]和食管癌[6]等多种肿瘤组织呈现低表达,与肿瘤的发生和进展关系密切。
腺苷(adenosine)由腺嘌呤和核糖组成,参与机体内ATP和第二信使cAMP的合成,对机体内能量代谢和信息传递起着重要作用。近年来发现腺苷参与细胞凋亡、细胞生长及衰老的调节,另外还参与细胞内自噬调节[7-8]。自噬是指一些需降解的蛋白质和受损的细胞器等胞浆成分被双层膜包裹,运送至溶酶体降解的过程[9-10]。自噬性降解产生的氨基酸和其它一些小分子物质可被再利用或产生能量[9]。现已明确,自噬的主要功能之一实际上是在细胞受到应激性死亡威胁时保持细胞的存活,这是真核细胞维持稳态、实现更新的一种重要的进化保守机制。当细胞内有害物质过多,自噬被过度激活的时候,细胞死亡就会通过线粒体中的前凋亡因子的诱导而发生(也称之为自噬性死亡)[10]。多种肿瘤细胞内MEG3表达降低,肝癌细胞中MEG3也呈现低水平表达[11]。MEG3在细胞内表达水平的差异与多种肿瘤的发生、发展密切相关,揭示了其在细胞生长周期中增殖、分化和死亡等多个进程中的重要调控作用,为人类疾病的诊断及治疗提供了新的靶点。既往研究已显示出腺苷对肝癌细胞自噬具有调节作用;荟萃分析显示MEG3已成为预示肿瘤预后的一个临床生物学标志[12-13]。不同浓度的腺苷对肝癌自噬的影响是否有差别性,增加肝癌细胞MEG3表达对腺苷诱导肝癌细胞自噬的影响未见报道。
材 料 和 方 法
1 主要试剂
人肝细胞癌HepG2细胞购自中科院上海细胞库;DMEM培养基购自Gibco;腺苷、MDC和LC3B兔多抗购自Sigma;哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)兔单抗购自CST;β-tubulin鼠单抗购自Abcam;山羊抗兔IgG(H+L)和山羊抗小鼠IgG(H+L)购自Jackson;CCK-8试剂盒购自日本同仁;MEG3慢病毒购自上海生工。生物正置荧光显微镜购自OLYMPUS;Countess II全自动细胞计数仪购自Invitrogen。
2 主要方法
2.1细胞培养 用含10%胎牛血清的DMEM培养液,在37 ℃、5% CO2条件下培养HepG2细胞,0.25%的胰蛋白酶消化传代。取处于对数生长期的HepG2细胞,加入1 mmol/L腺苷处理,为腺苷组,加入相同体积的DMSO作为对照组,培养12 h。取对照组和腺苷组细胞并按每孔2×105个细胞数量接种于6孔板,分别在这2组中各选2孔并按MOI=100加入包装后的MEG3慢病毒,即分别为MEG3组和MEG3+腺苷组。以上4组细胞均继续在37 ℃、5% CO2条件下培养。
2.2Western blot检测LC3和mTOR蛋白的表达 将对照组、MEG3组、腺苷组和MEG3+腺苷组的HepG2细胞在37 ℃、5% CO2条件下培养,每隔24 h更换新鲜DMEM培养基,72 h后收集细胞。PBS洗涤2次,吸去PBS,每管加入100 μL的RIPA,重悬细胞,冰浴30 min后裂解细胞。4 ℃、13 000 r/min离心30 min,测定总蛋白浓度。配制5%的浓缩胶和8%或12%的分离胶,按每孔10 μg总蛋白量上样,SDS-PAGE,转膜后用3% BSA-TBST封闭,1∶2 000稀释LC3B兔多抗、mTOR兔单抗和β-tubulin鼠单抗等 I 抗在4 ℃摇晃孵育过夜,TBST洗膜,山羊抗兔/小鼠IgG(H+L)-HRP的II 抗孵育,TBST洗膜后ECL发光,胶片曝光,显影及定影。每组实验重复3次。
2.3MDC染色检测自噬体 将对照组、MEG3组、腺苷组和MEG3+腺苷组的HepG2细胞在37 ℃、5% CO2条件下培养,每隔24 h更换新鲜DMEM培养基,72 h后收集细胞。每孔加入500 μL(浓度为30 μmol/L)的MDC工作液,37 ℃避光孵育30 min。PBS漂洗,取载玻片并滴加少量抗荧光猝灭剂,将细胞爬片后倒扣于载玻片上,荧光显微镜观察拍照。每组实验重复3次。
2.4CCK-8法和活细胞计数检测腺苷对HepG2细胞增殖的影响 将对照组、MEG3组、腺苷组和MEG3+腺苷组的HepG2细胞分别接种于96孔板,在37 ℃、5% CO2的条件下培养。选择检测时点为0、12、24、48和72 h,每孔加入10 μL的CCK-8溶液,使用酶标仪测定450 nm波长处的吸光度(A)值,每组实验重复3次。取处于对数生长期的HepG2细胞,加入1 mmol/L腺苷处理(腺苷组),加入相同体积的DMSO作为对照(对照组),37 ℃、5% CO2条件下培养12 h。取对照组和腺苷处理组细胞并按每孔1×104个细胞数量接种于24孔板,分别在这2组中各选6孔并按MOI=100加入包装后的MEG3慢病毒(分别为MEG3组和MEG3+腺苷组)。以上4组在37 ℃、5% CO2条件下培养。选择检测时点为0、12、24、48、72 h,胰酶消化细胞后加入含10% FBS的DMEM中和胰酶,1 000 r/min,离心5 min,弃上清,加入1 mL含10% FBS的DMEM重悬细胞,吸取10 μL加入计数板中,使用Countess II全自动细胞计数仪进行活细胞计数。每组实验重复3次。
3 统计学处理
用SPSS 20.0统计软件进行数据的分析处理,数据均以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析(one-way ANOVA),每2组间均数比较采用Bonfferoni’st检验,以P<0.05为差异有统计学意义。
结 果
1 过表达的MEG3对HepG2细胞自噬的影响
与对照组比较,Western blot实验结果显示,MEG3组中HepG2细胞内的LC3-Ⅱ蛋白表达减少,LC3-Ⅱ/LC3-Ⅰ降低(P<0.05),见图1。MDC染色显示MEG3组中HepG2细胞内自噬体较对照组轻微减少,细胞浆和细胞核周围均可见自噬体,见图2。
2 腺苷对HepG2细胞自噬的影响
与对照组比较,Western blot实验结果显示,腺苷组中HepG2细胞内LC3-Ⅱ蛋白表达减少,LC3-Ⅱ/LC3-Ⅰ比值降低(P<0.05);与MEG3组比较,腺苷组中HepG2细胞内LC3-Ⅱ蛋白表达量和LC3-Ⅱ/LC3-Ⅰ比值均轻微降低,差异无统计学意义,见图1。MDC染色显示腺苷组中HepG2细胞核周围及细胞浆中自噬体较对照组和MEG3组减少,见图2。
3 过表达的MEG3对腺苷诱导的HepG2细胞自噬的影响
与对照组、MEG3组和腺苷组比较,Western blot实验结果显示,MEG3+腺苷组中HepG2细胞内LC3-Ⅱ蛋白表达被明显抑制,仅可见极少量LC3-Ⅱ蛋白表达,LC3-Ⅱ/LC3-Ⅰ比值显著降低(P<0.01),见图1。MDC染色显示MEG3+腺苷组中自噬体减少最为明显,自噬体主要位于细胞核周围,细胞浆中仅见散在自噬颗粒,见图2。
4 MEG3和腺苷作用于HepG2细胞后mTOR 的变化
为验证mTOR是否参与MEG3和腺苷诱导HepG2细胞自噬的调节过程,我们采用Western blot检测mTOR蛋白水平的变化,结果显示MEG3组和腺苷组中HepG2细胞内mTOR表达较对照组增加(P<0.05);MEG3+腺苷组中HepG2细胞内mTOR表达较腺苷组和MEG3组均进一步增加(P<0.05),见图3。
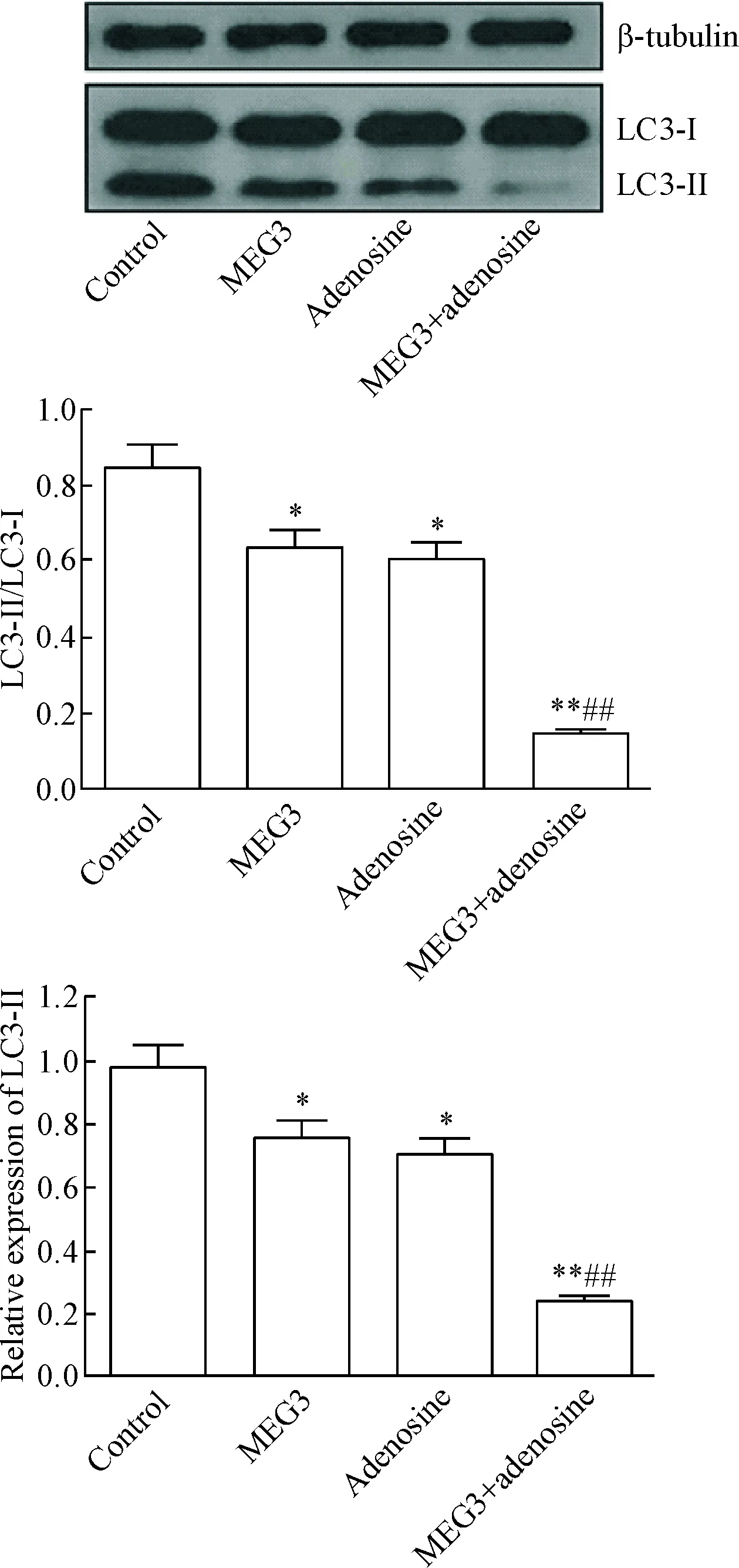
Figure 1. The autophagy of HepG2 cells was inhibited by MEG3 and adenosine. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;##P<0.01vsMEG3 or adenosine group.
图1MEG3和腺苷抑制了HepG2细胞内自噬

Figure 2. The numbers of autophagosomes in HepG2 cells were reduced after treated with MEG3 and adenosine.
图2MEG3和腺苷减少了HepG2内自噬体数量

Figure 3. The expression of mTOR in HepG2 cells was increased after treated with MEG3 and adenosine. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05vsMEG3 or adenosine group.
图3MEG3和腺苷促进HepG2细胞mTOR的表达
5 MEG3和腺苷对HepG2细胞增殖能力的影响
为验证MEG3和腺苷是否影响HepG2细胞的增殖,实验中采用CCK-8法和细胞计数仪检测,结果显示处理HepG2细胞24~72 h,MEG3组和腺苷组存活的HepG2细胞数量减少,较对照组有明显差异(P<0.01),HepG2细胞的活力降低;在48~72 h可观察到腺苷组中存活的HepG2细胞数均少于MEG3组(P<0.01)。MEG3+腺苷组存活的HepG2细胞数量明显减少,与对照组、MEG3组和腺苷组相比有明显差异(P<0.01),细胞活力较对照组、MEG3组和腺苷组更加降低,见图4、表1。

Figure 4. The viability of HepG2 cells was reduced by MEG3 and adenosine. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05vsMEG3 or adenosine group.
图4MEG3和腺苷抑制HepG2细胞的活力
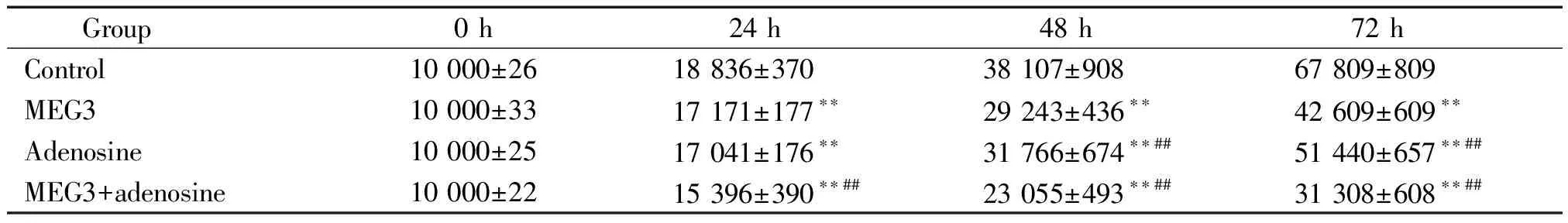
表1 MEG3和腺苷减少HepG2活细胞数
**P<0.01vscontrol group;##P<0.01vsMEG3 or adenosine group.
讨 论
肝癌在全世界范围内为最常见肿瘤之一,具有极高死亡率,发病后生存期短[13]。由于早期无症状,发现时间晚,肝癌患者能获得的手术机会少,因此化学药物治疗仍是目前保守治疗的主要手段。目前化疗药物或因毒性大,或肝癌细胞对药物产生耐药性,影响了化疗药物对肝癌的治疗效果,迄今为止,已有的化疗药物和方案效果均不理想。研究有效和毒副作用小的抗肝癌药物,提高肿瘤细胞对药物的敏感性成为研究者面对的一个难题。
腺苷是参与体内核苷酸代谢的物质。既往我们的研究显示较高浓度腺苷(4 mmol/L)诱导肝癌细胞凋亡,同时阻滞细胞周期,表明腺苷可以作为一种抗肝癌的药物[7]。在本研究中,我们适当降低腺苷的浓度至1 mmol/L,发现腺苷仍能有效减少肝癌细胞活力,抑制肝癌细胞增殖,降低肝癌细胞的生存能力。受到应激性死亡威胁时保持细胞的存活,这是细胞内自噬的主要功能之一。腺苷作用于肝癌细胞后自噬是否发生改变引起了我们的兴趣。已有研究显示,用自噬抑制剂3-甲基腺嘌呤抑制自噬可促进抗肿瘤药物对乳腺癌细胞的生长抑制[14]。在本研究中,以较低浓度的腺苷处理肝癌细胞,我们发现细胞内自噬反应明显减弱,同时细胞的增殖和活力均降低,提示腺苷也可以通过影响肝癌细胞自噬而发挥抗癌作用。
MEG3属于长链非编码RNAs家族成员,多种肿瘤中低水平表达的MEG3与肿瘤细胞增生、转移、肿瘤分期和预后密切相关,为肿瘤的预警标志物和病人预后评估的指标之一,提示MEG3也可成为肿瘤治疗的靶标之一[5, 13]。MEG3过表达已经显示出具有抑制结直肠癌[5]和卵巢癌[3]等肿瘤细胞增殖的作用,并且发现MEG3能抑制自噬而促进化疗药物诱导神经胶质瘤细胞凋亡[15]。肝癌细胞内MEG3表达减少[11],这可能是肝癌细胞生存所需的条件之一。我们在实验中发现MEG3过表达后同样可引起肝癌细胞活力下降,抑制肝癌细胞增殖,降低肝癌细胞内自噬等结果。MEG3是否影响腺苷的抗肝癌效果,目前尚无明确提示。实验中联合运用MEG3和较低浓度腺苷处理肝癌细胞,结果显示肝癌细胞增殖和活力明显降低,效果均强于单用腺苷或MEG3,同时发现自噬被明显抑制。本实验也发现腺苷在降低肝癌细胞内自噬和抑制肝癌细胞增殖的能力略强于MEG3,因此我们认为,自噬是腺苷发挥抗肝癌作用的环节之一,MEG3也能通过降低肝癌细胞内自噬而协同腺苷发挥抑制肝癌细胞增殖的作用。
mTOR属于丝氨酸苏氨酸蛋白激酶,具有调节细胞生长与增殖、抑制细胞自噬的功能,调节mTOR通路可影响细胞凋亡和自噬[10, 16],本研究发现在较低浓度腺苷和MEG3分别处理后,肝癌细胞内mTOR表达增多,自噬降低,联合MEG3和腺苷处理后引起自噬进一步降低,细胞内mTOR表达增多尤为明显,mTOR表达增多与自噬降低相一致,表明mTOR参与MEG3和腺苷降低肝癌细胞内自噬反应的调节过程。
总之,我们的研究结果提示,抗肿瘤药物腺苷在较低浓度下抑制肝癌细胞内自噬,抑制肝癌细胞的增殖和降低肝癌细胞的活力,MEG3通过调节mTOR通路而加强了腺苷对肝癌细胞内自噬反应的抑制,增强了腺苷治疗肝癌的效果。MEG3的作用研究任重而道远,联合运用MEG3和腺苷对未来肝癌治疗的化疗药物研究有实用价值。
致谢:本研究在汕头大学医学院中心实验室完成,在此致以由衷的感谢!
