持续静注小剂量纳洛酮对瑞芬太尼所致痛觉敏化的影响
2018-09-22高明龙李红芳刘晴晴赵红余杜朋爽马亚群刘永哲
高明龙,李红芳,孙 立,刘晴晴,赵红余,杜朋爽,马亚群,刘永哲
瑞芬太尼是一种μ-阿片受体激动药,因其镇痛作用强大、起效快、代谢迅速,广泛用于全身麻醉的维持[1]。近年来,瑞芬太尼所致的痛觉敏化(remifentanil-induced hyperalgesia,RIH)现象引起了众多临床麻醉医师的重视。纳洛酮为阿片受体拮抗药,主要用于阿片药中毒的急救处理,逆转阿片药的药理效应。研究表明,术后镇痛复合小剂量的纳洛酮可以增强阿片药的镇痛效能,减少阿片药的恶心呕吐等不良反应[2,3],全身麻醉使用瑞芬太尼维持时,术中持续静注小剂量的纳洛酮能否阻断RIH,尚未见报道。本研究旨在观察腹腔镜胆囊切除术中持续静注小剂量纳洛酮对RIH的影响。
1 对象与方法
1.1 对象 本研究经陆军总医院伦理委员会批准,选择陆军总医院2014-04至2017-11 在全身麻醉下行腹腔镜胆囊切除术的患者120例,年龄35~50岁,ASA Ⅰ ~Ⅱ。病例排除标准:手术时间或麻醉时间超过90 min者,长期服用镇痛药物、镇静药物、抗抑郁药物和精神药物者,患严重心脏疾患者,慢性疼痛症状者,药物成瘾者、药物过敏史者和不同意进行试验者,术中出现意外情况者。所有患者都签署知情同意书。
1.2 方法与监测
1.2.1 术前准备 术前1 d访视,告知患者如何进行VAS评分,如何配合医师进行痛阈测试。
1.2.2 痛阈测试方法 测试部位在左前臂内侧腕横纹中点近侧3 cm处。测试仪器为手持式压力测痛仪(SLY-HFM,北京恒瑞天创机电设备有限公司)。由同一人负责测定。开机后,选择测试单位为“g”,使用“峰值”功能,将显示屏的数据“置零”,并保持相同的测试角度进行测试,被测试者喊“痛”时,将测通仪撤离,记录显示数值,每个时间点测试3次,间隔1 min,3次的平均数值为本次的痛阈值。
1.2.3 分组方法 所有患者按就诊顺序进行编号,随机分为两组,每组60例。对照组,持续泵注生理盐水5 ml/h;纳洛酮组,持续泵注纳洛酮配置液5 ml/h。纳洛酮配置液为1 μg/kg的纳洛酮加生理盐水至20 ml,相当于纳洛酮0.25 μg/(kg·h)。
1.2.4 双盲控制 (1)患者随机号码由专人保管,并于手术日负责提供装有生理盐水的20 ml注射器或含有纳洛酮的20 ml注射器;(2)麻醉管理由另外一组人管理;(3)术后指标的观察由不同人员进行。
1.2.5 麻醉诱导 患者入室后,建立静脉通路,静脉滴注阿托品0.5 mg,快速静滴平衡液500 ml,常规监测心电图、心率、无创血压、呼气末二氧化碳(EtCO2,麻醉机自带监测系统)和七氟醚(ETsevo,麻醉机自带监测系统)、BIS(A-2000, Aspect Medical System, Natick, MA, USA)。在诱导前15 min,泵注配置好的20 ml药液5 ml/h。诱导前吸入纯氧(10 L/min)5 min,同时将麻醉机呼吸回路预存8%浓度的七氟醚,氧浓度为100%。开始诱导时,紧扣患者面罩,嘱咐患者作深呼吸,待BIS值下降到60时,静注顺式阿曲库铵0.15 mg/kg,静注瑞芬太尼1 μg/kg (静注时间1min),BIS值下降到50时,将七氟醚吸入浓度调整为3.0%,维持吸入2 min后,进行气管插管。
1.2.6 麻醉维持 在气管插管后,麻醉机控制呼吸(Drager Primus; Vt=8 ml/kg, RR =12~14次/min, I/E =1/1.8),维持EtCO2在35~40 mmHg。所有患者持续泵注瑞芬太尼0.4 μg/(kg·min),调节七氟醚吸入浓度(Et 1.5%~2.5%),维持BIS在45~55。手术结束前5 min,停止泵注瑞芬太尼、吸入七氟醚。手术结束后,将气体流量开到10 L/min,洗出七氟醚。
1.2.7 术后镇痛方案 镇痛泵(accufuser plus, made in Kores )参数:总容量100 ml,持续泵注2 ml/h,锁定时间为15 min,bolus 0.5 ml/次。配制方法:将3 μg/kg的舒芬太尼和200 μg/kg的托烷司琼加生理盐水至100 ml,手术前连接镇痛泵。
1.3 观察指标 Ramsay镇静评分[4]:1分,不安静、烦躁;2分,安静合作;3分,嗜睡,能听从指令;4分,睡眠状态,但可唤醒;5分,呼吸反应迟钝;6分,深睡状态,呼唤不醒。其中2~4分镇静满意,5~6分镇静过度。
痛阈测试时间:测定术前(T1)、术后0.5 h (T2)、1 h(T3)、2 h (T4)、8 h (T5)、12 h (T6)、24 h (T7)、48 h (T8) 痛阈,术后各时间点VAS评分、Ramsay’s评分及恶心呕吐等术后不良反应。

胰腺术后的患者由于胰腺原发病、胰腺组织切除、胃肠解剖位置变化、餐后刺激减少、胃排空与胰腺分泌不相协调等原因,使得胰酶分泌水平不足以维持正常消化。胰十二指肠切除术后PEI发生率高,可在60%以上,而中段或远端胰腺切除术后PEI发生率相对较低[11-12]。
2 结 果
2.1 一般情况 两组患者的年龄、体重、性别、手术时间及ASA分级比较,差异无统计学意义(表1)。

表1 两组胆囊切除术患者一般情况比较 (n=60)
2.2 不同时间痛阈、VAS评分、Ramsay评分 与对照组比较,纳洛酮组在T2、T3点的痛阈、Ramsay评分显著增高,VAS评分降低,差异有统计学意义(P<0.01);与T1点比较,对照组T2、T3两时间点的痛阈显著降低,差异有统计学意义(P<0.05),纳洛酮组T2-T8各时间点的痛阈显著高于T1点的痛阈,差异有统计学意义(P<0.01);对照组和纳洛酮组在T2、T3两时间点的痛阈、VAS评分、Ramsay评分差异没有统计学意义;与T2/T3点比较,对照组T4-T8点的痛阈、Ramsay评分显著增高,VAS评分降低,差异有统计学意义(P<0.01),纳洛酮组T4-T8点的痛阈、Ramsay评分和VAS评分变化不大,差异无统计学意义。见表2。
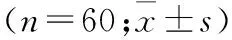

时间对照组痛阈VAS评分Ramsay评分纳洛酮组痛阈VAS评分Ramsay评分T1325.7±19.3321.3±20.8T2317.8±20.5②3.27±0.521.85±0.51340.6±21.5①③2.15±0.52①2.25±0.34①T3319.2±18.9②3.18±0.461.92±0.47344.5±18.6①③2.09±0.41①2.21±0.41①T4337.3±17.3③2.03±0.58④⑤2.33±0.45④⑤343.1±17.61.99±0.482.25±0.45T5340.1±15.7③1.98±0.61④⑤2.38±0.36④⑤342.6±18.41.96±0.562.31±0.42T6339.78±18.3③1.95±0.58④⑤2.42±0.36④⑤340.2±19.11.98±0.552.25±0.39T7341.5±19.1③1.94±0.48④⑤2.48±0.51④⑤343.1±22.31.97±0.582.23±0.48T8342.8±18.6③1.91±0.56④⑤2.41±0.46④⑤344.6±21.61.95±0.592.21±0.39
注:与对照组比较,①P<0.01;与T1点比较,②P<0.05,③P<0.01;与T2点比较,④P<0.01;与T3点比较,⑤P<0.01
2.3 不良反应 对照组发生恶心呕吐9例(15.00%),纳洛酮组发生恶心呕吐7例(11.67%),两组不良反应发生率比较,差异无统计学意义。
3 讨 论
众多因素参与了阿片药所致的痛觉敏化(opioid-induced hyperalgesia, OIH)形成[5-7]。本研究中,为了避免影响痛阈值、VAS评分、Ramsay’s评分的测定,麻醉诱导、麻醉维持中不使用咪达唑仑、丙泊酚和其他的镇静药、镇痛药。目前没有发现七氟醚能够引起OIH的报道;BIS监测则能够避免术中知晓的发生,为了避免患者术后OIH时出现剧烈疼痛等不适反应,术后应用长效的舒芬太尼进行镇痛。
RIH多在停药后短时间内出现[8]。本研究中对照组尽管应用舒芬太尼进行了术后镇痛,术后0.5 h、1 h两个时间点的痛阈仍然显著低于术前水平,术后2 h患者痛阈才升高。纳洛酮组术后各时间点的痛阈值显著高于术前值,在术后0.5 h、1 h两个时间点没有出现痛觉敏化。
文献[9]报道,RIH发生后,患者满意度下降,更易诱发一些心脑血管意外。为了减轻RIH,临床麻醉医师在手术结束前常常给予作用于不同靶点的镇痛药物,以期达到拮抗RIH的目的,如,长效μ-阿片受体激动药[10]、小剂量的氯胺酮[11,12]、非甾体类镇痛药[12]、α2-肾上腺素受体激动药等[13,14]。至于最终效果是这些药物的镇痛效应和RIH效应叠加的结果,还是从根本上阻止了RIH的发生,还需要进一步研究。
总之,全身麻醉中使用瑞芬太尼维持麻醉时,对术后RIH的发生应有足够的重视,要采取各种可靠的措施防止患者痛阈的降低。本研究结果表明,在腹腔镜下胆囊切除术的全身麻醉中,持续静注小剂量纳洛酮能够拮抗RIH。
