Circular RNAs:鉴定、表达和功能
2018-09-21曹修凯杨嘉蒙
李 辉,曹修凯,杨嘉蒙,陈 宏
(西北农林科技大学动物科技学院,陕西省农业分子生物学重点实验室,陕西杨凌712100)
1 circRNA的发现
1991年Nigro等利用RT-PCR和测序技术分析人DCC(deleted in colon cancer)基因外显子连接时偶然发现了4个潜在的circRNA[1]。1993年Capel等发现小鼠Sry(sex-determining region on the Y chromosome)基因可以产生circRNA,这是证实circRNA存在的另一个实例。在发育生殖脊中Sry基因可以转录成mRNA并翻译成Sry蛋白,在胚胎发育中起到性别决定的作用。但是,在成年小鼠睾丸组织中,Sry基因被特异转录成了1.23-kb的circRNA[2]。大量研究表明这一circRNA并没有被翻译,这使得人们不禁对它的功能意义产生了疑问。
之后又陆续发现了一些circRNA基因(circRNA-producing gene),包括人转录因子ETS-1、人/鼠细胞色素P450、鼠SHBG(sex hormone binding globulin)、人dystrophin。此外,猴子NCX1和果蝇mbl据信具有很高的丰度,并且可以调控异常RNA亚型(circRNA)[3]。最近,人ANRIL(一个非编码RNA,丰度较低)可以发生环化,并且CDR1位点的反义转录可以产生高丰度的circRNA。至此,人们普遍认为circRNA是一种罕见的RNA形式,具有有限的生物学意义。
2012年小儿急性淋巴细胞性白血病样本的RNA测序揭示了circRNA的全基因组表达属性,并且这种现象同样存在于健康个体的白细胞中[4]。此外,生物信息学分析也证实并拓展了这些发现。这些研究结果为一个新领域的快速发展奠定了基础。将这些研究结果整理,发现circRNA是很丰富的,数以千计的人类基因可以表达circRNA,并且有时它们的表达量要高于其同源线性亚型[5-6];circRNA具有表达特异性、序列保守性(人与小鼠),定位于胞质,稳定性强,半衰期超过48 h;天然存在的circRNA不会被翻译(人工合成的具有核糖体进入位点的circRNA在体内/外均可被翻译)[7];它们通常是由pre-mRNA的较长的外显子和较长的侧翼内含子构成(图1),侧翼内含子中富含互补的ALU元件,它们在许多circRNA合成中发挥功能。这些结论具有一般性,但不能排除特例的存在。
(a)套索驱动(lariat-driven)环化;(b)内含子配对驱动(intron-pairing-driven)环化;(c)环形内含子RNA(ciRNA);(d)RBP或反式作用因子驱动环化。
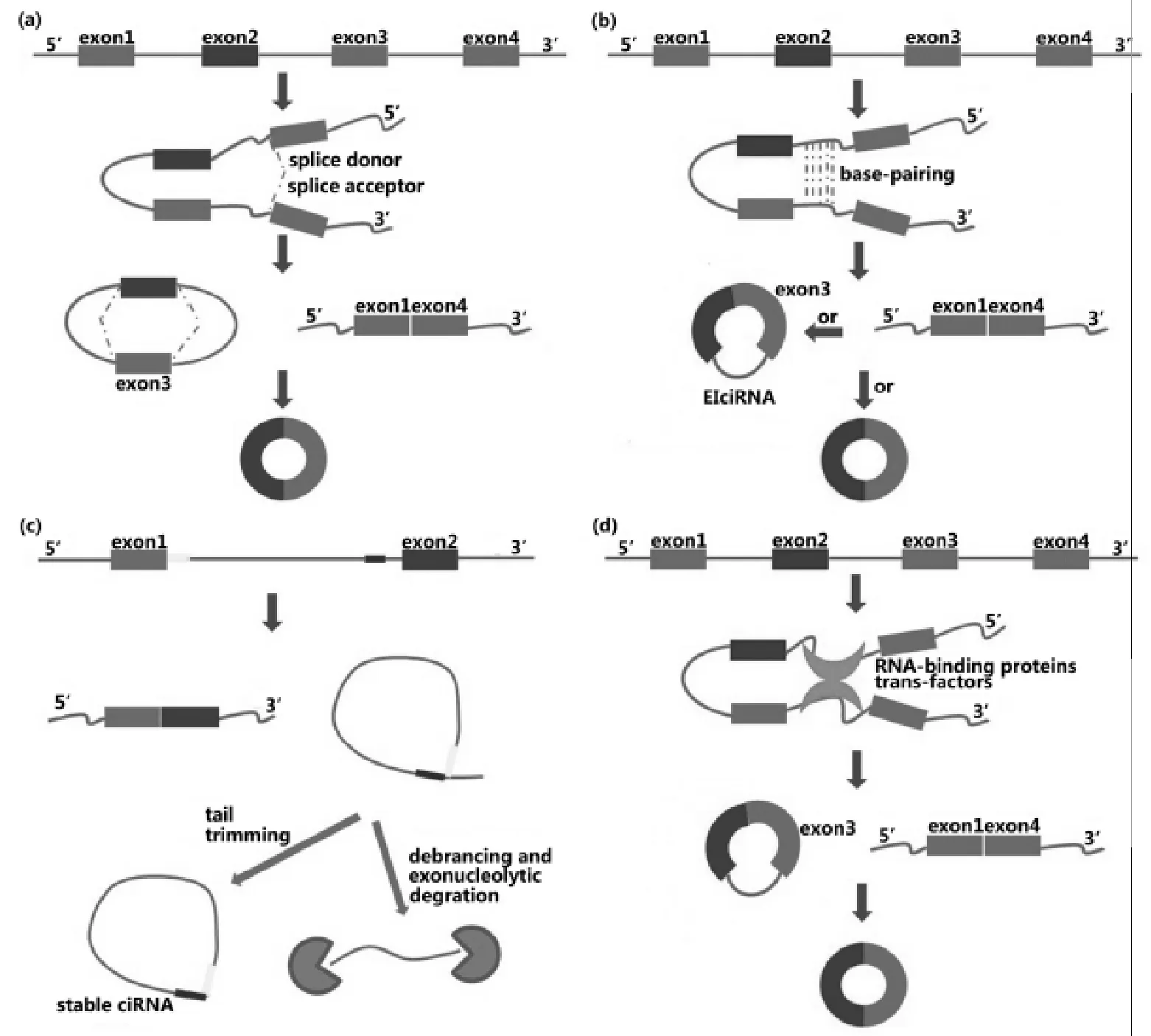
图1 circRNA的合成[8]
2 circRNA的鉴定与特性分析
生化方法和生物信息学分析是检测circRNA及其表达的主要手段.
(1)circRNA特性分析的生化方法
生化实验是鉴定和验证circRNA的重要方法,其中qRT-PCR是最基础的方法之一。 circRNA首先被反转录成cDNA,这一cDNA序列中含有标志性的外显子-外显子连接序列,而正常剪接得到的mRNA不含这种连接序列。因而在设计引物时可以特异扩增这个标志性的连接序列。这种引物称为反向(inverse or outward-facing primers)引物,因为当比对到基因组时,它们的3’端是相互远离的,这不同于标准PCP(3’端相互靠近)。这样就可以将mRNA和基因组DNA区分开来。qPCR可以快速检测circRNA的相对丰度。
尽管qPCR简单高效,但它存在一些缺陷。mRNA模板置换(template switching)、反式剪接(trans-splicing)、基因组重复均有可能在外显子-外显子连接序列处发生,进而导致线性转录本具备了circRNA特有的外显子-外显子连接序列。此外,对circRNA的反转录具有滚环反转录(rolling-circle)现象,导致外显子串联。凝胶电泳时条带呈梯度分布,这表明了circRNA的存在,但这也会导致对circRNA的过高估计[9-11]。
Northern blot也是一种简单、高效检测circRNA的方法。探针可以靶向到circRNA的外显子序列或特异性地靶向到外显子连接序列。与qPCR相比Northern blot在circRNA定性上更具有优势,因为目的circRNA具有特定的迁移率[2]。
核糖核酸酶R(RNase R)具有3’-5’核酸外切酶活性,它通常与上述方法结合使用,来判定circRNA的真实性或从测序文库中富集circRNA[12-13]。但是RNase R会导致技术噪音,因为RNase R也可以使一些circRNA降解(或许与RNA的内源性切口及核酸酶污染有关),一些3’端发生碱基配对的线性RNA不被降解。并且考虑到这种酶的效率,处理后的样品中或许仍然存在线性RNA的片段。正是由于这个原因,采用一个量化指标来衡量消化效率是很有必要的,例如Real-time quantitative PCR(qPCR)法。此外核酸酶XRN1(应用较少)具有5’-3’外切酶活性,与RNase R的使用方式相似,但在使用前需要利用烟酸焦磷酸酶(tobacco acid pyrophosphatase, TAP)对mRNA进行去帽处理。综上,qPCR+Northern blot +核酸外切酶是鉴定RNA环化的有力工具。
核糖核酸内切酶H(Rnase H)也可以用来检测RNA环化。RNase H可以将RNA-DNA杂交双链中的RNA切断,因此当1个DNA探针结合到目的RNA上后,该RNA会被RNase H切割。线性RNA的电泳结果呈现2条带,而circRNA呈现1条带。并且线性化会改变circRNA电泳迁移速度。此外,二维变性聚丙烯酰胺凝胶电泳也可以用来区分circRNA和线性RNA[14]。
对于circRNA的富集,除了核糖核酸外切酶处理法和二维电泳法外[15],rRNA消耗法(ribosomal RNA depletion)和polyA消耗法也是在构建circRNA测序文库时常用的富集方法。然而这两种方法都不能保证富集序列的特异性,因为其他一些类型的非编码RNA仍然会存在。尽管如此,RNA-seq 结合生物信息学分析可以在全基因组范围内检测circRNA的表达,并且原则上可以将伪circRNA(artifactual circRNA)与真实circRNA区分开。例如,将RNase R与rRNA消除处理后样本的circRNA检测率进行比较就可以检测出真实的circRNA。在进行这种分析前,需要对RNA-seq数据进行标准化。但是RNA-seq前的生化处理/纯化并不是基因组范围内鉴定circRNA的金标准。Jeck等发现由CDR1反义转录本形成的circRNA经过RNase R处理后发生了降解。
(2)外源circRNA的表达:circRNA的发生与功能
目前还不能针对内源circRNA的位点进行干扰或诱导表达。因此过表达载体是研究circRNA的常用工具。这种载体通常含有环化外显子、侧翼剪接信号、内含子(含有反向互补序列,促进剪接成环)。但是,这种载体会导致滚环转录本的形成。RNA聚合酶会绕过转录终止信号,转录整个质粒,导致环化外显子发生串联重复,这种pre-mRNA会按照传统剪接方式进行剪接,最终形成环化外显子串联的线性RNA。利用检测circRNA的方法无法将这种外显子串联的线性RNA与真实的circRNA区分开,因为前者也含有circRNA的标志性连接序列。
(3)circRNA的生物信息学鉴定
除了上述生化方法外,利用生物信息学对circRNA进行预测也被广泛采用。poly-A+RNA-seq是mRNA转录组分析常用的方法,而去除rRNA文库与总RNA文库是circRNA分析最常用的测序文库。通过在测序结果中搜索嵌合reads(与基因组相比read的5’序列位于3’序列的下游)就可以检测到circRNA。此外,还有其他一些检测circRNA的算法。但是研究表明不同算法在circRNA检测敏感性和特异性上存在很大差异,并且对假阳性率和假阴性率有显著影响[16]。因此需要一个评估这些算法的金标准。此外。基因间、基因内序列同源性会导致read与基因组的错误比对,因此对RNA线性或环形剪接的精确、敏感的检测仍然是生物信息学面临的一个难题。目前Rajewsky实验室已经构建了一个circRNA数据库(circbase.org)。
3 circRNA的表达
越来越多的证据表明circRNA在真核细胞中发挥功能。在多种发育背景和细胞类型中均检测到了circRNA,并且它们呈现动态表达,说明它们的表达是可调控的。
(1)circRNA表达的细胞及组织特异性
一些circRNA具有组织表达特异性,并且某一特定基因在不同细胞类型中产生的circRNA种类不同。例如来源于DCC基因的circRNA在人类不同组织中表达量存在很大差异。最近的许多研究也证实了这种现象,说明RNA环化调控的普遍性[17]。同时,其他研究也发现了circRNA的表达与mRNA水平并没有相关性。多个研究小组报道,在人、小鼠、猪脑组织中,circRNA具有很高的丰度。进一步研究发现,在果蝇、小鼠脑组织表达的circRNA被富集到了编码神经元蛋白和突触因子的基因,说明circRNA在中枢神经系统或许发挥功能[18-19]。
(2)circRNA表达的保守性
circRNA在哺乳动物中呈现出表达保守性。也就是说同源circRNA在不同哺乳中具有类似的表达(量/性)。有关circRNA保守性的研究主要是在人和小鼠circRNA表达的比较上。据估计大约5%~30%小鼠circRNA与人类具有同源性。最近研究发现大约15%~20%的小鼠脑组织circRNA与猪脑组织circRNA具有同源剪接位点。猪与人circRNA具有中度保守性,5%~10%的人类脑组织circRNA在猪脑组织中表达。这些结果间的差异极有肯能是由于测序深度(测序深度低就无法检测到低丰度circRNA的表达)、保守性的统计学定义、生物信息学参数设定、组织样本不同造成的。
circRNA在所有真核生物中均被检测到,包括在真核微生物。值得注意的是裂殖酵母菌(Schizosaccharomyces pombe)和发面酵母(Saccharomyces cerevisiae)也检测到了circRNA,但是这两种真菌仅具有有限的可变剪切事件[20]。这些发现表明circRNA是基因表达的一种古老特性或者是在真核进化过程中独立出现。
在发育过程中circRNA表达呈现了动态变化。例如,在人和果蝇胚胎发育过程中circRNA被诱导表达。circSYR是circRNA发育调控表达最经典的例子之一,此处不再详述。
(3)circRNA表达调控因子
在发育过程中circRNA的细胞特异剪接和动态表达使人们联想到了调控circRNA合成和降解的顺式作用元件。RNA结合蛋白(RBP)是调控pre-mRNA剪接的主要顺式作用元件,因此研究人员将重点放在了鉴定调控circRNA剪接的RBP上。
首个被鉴定出调控circRNA表达的RBP是果蝇Muscleblind protein(MBL)[21-22]。MBL是果蝇肌肉和光感受器发育所必须的,敲除该基因是胚胎致死的。作为circRNA的调控因子,MBL能够促进MBL pre-mRNA第二外显子剪接成circRNA(circMBL),circMBL是果蝇头部表达量最高的circRNA之一。据推测circMBL能竞争性地抑制MBL mRNA的产生,因而以一种负反馈样的调节机制降低MBL蛋白水平。circMBL上的MBL结合位点(具有高度保守性)可以吸附MBL蛋白,阻止其发挥功能。但是果蝇MBL并不能调控所有circRNA。最近对laccase2和PlexA基因的研究发现RNA环化是在hnRNP和SR蛋白共同作用下发生的。这些因子或许直接对pre-mRNA产生作用,或许通过其他因子间接作用。
人类ADAR家族成员与circRNA的产生有关。它们可以将配对的RNA中的腺嘌呤(A)转化为次黄嘌呤(I)[23]。环化外显子的内含子侧翼序列中富集的Alu元件及配对碱基间的相互作用对circRNA的合成具有重要作用, 因而推测ADAR或许可以调控circRNA的产生[24]。特别是ADAR高表达会降低碱基配对的稳定性,而这一稳定性对circRNA的合成是必须的,这就导致了circRNA产量的减少。通过shRNA干扰ADAR的表达证实了这一推论(部分circRNA的表达量下降,而其他circRNA表达未发生变化)。这或许是由于ADAR与pre-mRNA直接作用的结果,因为在circRNA剪接位点存在A-I富集现象。但仍需要实验进一步验证。此外,Quaking(QKI)也是调控circRNA产生的另一个RBP[25]。
4 circRNA的功能
尽管人们已经认识到了环状RNA的丰富性,但环状RNA的作用以及生物功能仍需要不断地探索。目前,所认识到环状RNA的功能主要有以下几个方面。
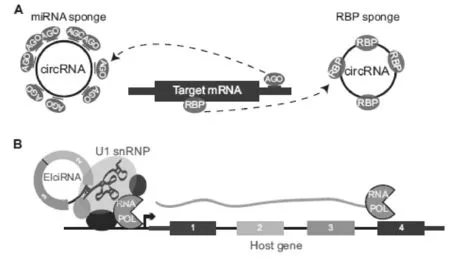
图2 circRNA功能分类[3]
(A)circRNA具有许多miRNA/RBP结合位点,可以发挥吸附海绵的作用,竞争性结合miRNA/RBP, 改变基因表达;(B)EIciRNA(exon-intron circRNAs)通过与U1 snRNP结合而作用于转录复合物,诱导基因表达。
(1)海绵作用(图2A)
MiRNA是一类长度在21 nt左右的RNA,它们可以通过碱基互补配对直接与mRNA靶标相结合,从而起到抑制mRNA翻译的作用。由于环状RNA拥有miRNA的结合位点,因此环状RNA可以通过吸附特定的miRNA,与靶基因竞争性结合miRNA,从而释放miRNA对靶基因的抑制作用[26]。目前,研究比较比较充分的有两个环状RNA,ciRS-7/CDR1as和Sry circRNA。ciRS-7/CDR1as在哺乳动物的脑中表达非常丰富,拥有超过70个miR-7的结合位点,通过吸附miR-7使其活性大大降低。Sry circRNA是在小鼠睾丸中发现的一个高表达环状RNA,拥有16个miR-138的结合位点,通过体外荧光素酶基因报告实验证实,Sry circRNA可以抑制miR-138的活性。但环状RNA是否普遍具有miRNA海绵作用还有待进一步验证。
(2)调控转录(图2B)
环状RNA除了能够吸附miRNA外,还可以与RNA结合蛋白(RBP)相结合形成 RNA蛋白复合物(RPCs),对RNA结合蛋白和小RNA起调节作用或者通过部分碱基互补配对直接作用于靶基因[27-28]。2013年9月,科研人员发现许多细胞核内circRNAs没有或很少有miRNA结合位点,以circRNA ci-ankrd52和ci-sirt7为例,在敲低处理后,发现两者的前体mRNA量均减少,表明细胞核内的circRNAs可能参与基因的转录调控[29]。后续报道也得到了相似的结果[21-22]。
尽管已知功能的circRNA数目在不断增长,但仍有数以千计功能未知的circRNA。大多数circRNA可能具有单一功能,亦或是多个circRNA共同发挥某种功能。但也有可能是大部分circRNA仅仅是pre-mRNA剪接产生的噪音,不具有任何功能。circRNA的表达具有保守性和可调控性,但或许只是利用mRNA剪接的调控因子(具有保守的结合模式)。因为circRNA的表达与它的主基因的表达是耦合的,所以利用一般方法很难探究其功能。进一步加深对circRNA合成过程的认识有助于利用基因组编辑技术特异性敲除circRNA。这将打开探究circRNA功能之门。此外,circRNA过表达载体也将应用于circRNA敲除的补救实验。考虑到circRNA的合成、转运与降解,它们或许可以为一些基本的细胞生物学问题提供一些新思路。
