刺五加提取物联合运动改善健康SD大鼠骨骼肌功能性抗交感的实验研究
2018-09-21宋广侠吴江涛马延超
宋广侠,吴江涛,孙 一,马延超
运动能够显著上调骨骼肌交感神经活性,其升高幅度与运动方式、运动强度以及参与运动的骨骼肌(即工作肌)数量有关。交感激活引起非工作肌血管收缩,而工作肌则释放多种抗交感物质如一氧化氮(nitric oxide,NO)、前列腺素(prostaglandins,PGs)以及三磷酸腺苷(adenosine triphosphate,ATP)等,能够减轻或抵消运动时的交感缩血管反应[1]。学者们将工作肌释放的局部抗交感物质抑制运动中交感缩血管反应的现象称为“功能性抗交感(functional sympatholysis)”[2]。功能性抗交感是运动时优化骨骼肌血流量的主要机制,其生理意义在于合理分布肌肉血供以适应灌注和代谢需求[2]。然而多种以交感神经系统过度兴奋和/或血管功能紊乱为特点的病理生理状态下(如久坐[3]、衰老[4]、高血压[5]、心衰[6]等)功能性抗交感受损,肌肉血流量和氧运输之间的动态平衡被破坏,进而影响肌肉功能。可以推测,若功能性抗交感改善,则运动时骨骼肌血流灌注增加。我们前期的研究证实,有氧运动能够改善健康SD大鼠[7]以及中年高血压患者[8]功能性抗交感,其机制可能与NO介导的舒血管作用有关。NO由L-精氨酸和O2在一氧化氮合酶(nitric oxide synthase,NOS)的催化下合成,后者存在3种亚型,即内皮型NOS(endothelial nitric oxide synthase,eNOS)、神经元型NOS(neuronal nitric oxide synthase,nNOS)和诱导型NOS(inducible nitric oxide synthase,iNOS)。药理学实验[9]显示,健康雄性SD大鼠灌注选择性以及非选择性NOS阻断剂后腰部交感神经干电刺激诱导的小腿三头肌交感缩血管反应明显增强,提示NOS在调节骨骼肌血流量中起重要作用。THOMAS等[10]指出,II型(快肌)肌纤维中NO介导的交感缩血管抑制作用较I型(慢肌)更为明显,提示功能性抗交感可能与肌纤维募集有关。然而运动通过何种NOS亚型改善功能性抗交感以及是否具有肌纤维类型依赖性尚不得而知。
刺五加是祖国传统中药材,属五加科植物,主要化学成分为五加苷(A、B、B1、C、D、E、F、G)、黄酮类化合物以及多糖等,除具有免疫调节、抗衰老、抗肿瘤及抗辐射损伤等作用外,还可治疗缺血性心脏病、关节炎、支气管炎、糖尿病、神经衰弱、胃溃疡等病症[11]。课题组前期研究[12]以及既往多项报道[13-14]均证实,刺五加尚能够通过抗氧化、改善微循环、调节糖脂代谢等机制延缓运动性疲劳,提高有氧、无氧工作能力。我们前期的研究[12]还发现,刺五加提取物联合运动能够促进健康大鼠外周多个组织NOS活性以及NO含量增加。由于NO是功能性抗交感的重要介质,而单纯补充刺五加或运动均能够上调NOS活性并提高NO含量,由此推测规律运动同时补充刺五加对于改善功能性抗交感可能具有协同效应。因此本研究旨在观察8周刺五加提取物联合运动对健康SD大鼠骨骼肌静息时和收缩时交感缩血管反应以及功能性抗交感的影响并探讨NOS/NO系统在其间的可能作用机制。
1 研究对象与方法
1.1 实验对象
60只雄性Sprague-Dawley(SD)大鼠,8周龄,购自军事医学科学院实验动物中心。于12/12 h光暗交替、环境可控(温度:22~24°C,湿度:50~70%,1个标准大气压)的动物房内分笼饲养(5只/笼),自由进食水。
1.2 药物制备与动物分组
按照课题组已建立的方法并参考刺五加注射液(沈阳药科大学提供,批号:980830)制备流程配制刺五加提取物[12]。高效液相色谱分析显示,1 g提取物中含150 mg刺五加苷、120 mg刺五加多糖、12.5 mg刺五加总黄酮。将提取物以1:50(g:mL)的比例溶于生理盐水中,4℃冰箱保存。
实验动物适应性跑台训练1周(10 min/天,速度为10 m/min,坡度为0°)后将其随机分为安静对照组(sedentary control,S)、刺五加组(Acanthopanax Senticosus,A)、运动组(exercise-trained,E)以及运动+刺五加组(exercise-trained plus Acanthopanax Senticosus,EA),每组n=15。(1)S组大鼠安静饲养;(2)A组给与刺五加提取物灌胃,每天1次,剂量为10 mL/kg;(3)E组进行高强度间歇跑台运动,速度为40 m/min,坡度为0°,运动3 min后休息1 min为1组,共完成5组,总训练量为600 m,5次/周。课题组前期的研究[7]证实,该训练方案能够增加心脏重量、心指数并改善功能性抗交感;(4)EA组在训练前1 h给予10 mL/kg刺五加提取物灌胃,训练方案同E组;S组和E组于同一时间给予同等体积蒸馏水灌胃。各组干预时间均为8周。
1.3 外科手术
末次训练后48 h,参照N.G.JENDZJOWSKY等[15]以及课题组前期建立的方案[7]进行外科手术。每只动物均依次进行“麻醉→气管插管→左侧肱动脉插管→右侧股动脉插管→暴露右侧坐骨神经→暴露右侧腰部将按神经干”共6个手术。详述如下:(1)异氟醚麻醉大鼠,右侧颈静脉插管,使用注射泵持续静脉灌注α-氯醛糖(8~16 mg/(kg·h))和乌拉坦(50~100 mg/(kg·h))持续麻醉,利用恒温加热垫维持直肠温度于36~37℃之间。(2)随后进行气管切开、气管插管并进行机械通气。(3)左侧肱动脉插管并连接压力换能器(MLT0380/D,美国)以连续监测动脉血压,同时获取平均动脉压(mean arterial pressure,MAP)和心率(heart rate,HR)数据。(4)流量探测器(Transonic Systems,美国)置于右侧股动脉,连接流量计(T402,美国)以检测股动脉血流量(femoral artery blood flow,FBF)。股动脉电导(femoral vascular conductance,FVC)mL/(min·mmHg)=FBF/MAP。(5)沿右侧股骨浅层剪开皮肤和浅筋膜,暴露并钝性分离右侧坐骨神经,连接C型电极。分离小腿三头肌,剥离皮肤和结缔组织,跟腱连接压力换能器(FT-10,美国)。通过电刺激(绝缘电刺激器,DS3 Digitimer,英国)坐骨神经诱导小腿三头肌收缩。(6)打开腹腔,钝性分离大血管后暴露右侧腰部交感神经干,将双极银丝刺激电极(Bioflex wireAS633,美国)连接于L3~L4之间的腰部交感神经干上。电极用硅酮橡胶覆盖以确保电绝缘,通过绝缘电刺激器(DS3 Digitimer,英国)获得恒定电流刺激。通过电刺激交感神经干诱发血管(股动脉)收缩。
1.4 电刺激实验与动物取材
参照JENDZJOWSKY等[15]以及课题组前期建立的实验方法[7],外科手术后恢复60 min以稳定血液动力学,随后在静息状态下以及肌肉收缩过程中检测交感神经电刺激诱导的心血管反应(MAP、HR、FBF、FVC)。(1)静息状态下的交感缩血管反应。交感神经电刺激参数为:1 ms脉冲、1.5 V电压,频率分别为2和5 Hz,持续时间为1 min。(2)肌肉收缩时的交感缩血管反应。以5倍运动阈(即肌肉收缩所需的最小电流)电刺激坐骨神经(40 Hz、100 ms脉冲,30 trains/min)诱导肌肉收缩,待血液动力学稳定(肌肉收缩后6 min)后再进行交感神经电刺激(电刺激参数同静息状态下)。不同频率(2 vs.5 Hz)电刺激之间间歇2 min,静息状态与肌肉收缩实验之间间隔5 min,以保证血液动力学恢复。
所有实验结束后,通过麻醉过度处死动物,取心脏并称重,计算心指数(=心脏重量/体重),分离比目鱼肌(soleus muscle,Sol,I型肌纤维(慢肌)为主)和腓肠肌(gastrocnemius muscle,Gas,II型肌纤维(快肌)为主),0~4℃冰生理盐水冲洗,滤纸吸干,用锡纸包裹并投入液氮中,随后转入-80℃低温冰箱冻存待测。实验流程图见图1。

图1 实验流程图Figure 1 Flow Chart of the Experiment
1.5 骨骼肌NO含量和NOS活性测定
分别取Gas和Sol约100 mg,解冻后用眼科剪迅速剪碎组织块(冰水浴中进行),超声匀浆器匀浆,低温离心取上清液,考马斯亮蓝检测蛋白浓度,采用硝酸还原酶法(试剂盒由南京建成生物工程研究所提供)测定NO含量。蒸馏水调零,550 nm、0.5 cm光径,测定各管吸光度值。NO含量(μmmol/g pro)=[(测定管吸光值-空白管吸光值)÷(标准管吸光值-空白管吸光值)]×标准品浓度(20 μmol/L)÷蛋白含量(mg pro/L)。
按照南京建成生物工程研究所提供的NOS分型试剂盒测定组织匀浆中iNOS、eNOS和nNOS活性。样品处理同上。以每mg蛋白每min生成1 nmol NO为一个酶活力单位,即NOS活性U/(min·mg pro)=[(测定管吸光值-空白管吸光值)÷呈色物消光系数]×(反应液总体积÷取样量)×[1÷(比色光径×反应时间)]÷蛋白含量/(mg pro·L)。
1.6 数据采集
使用数据采集软件(LabChart,美国)对血液动力学参数(HR、MAP、FBF和FVC)进行采集、记录和分析。交感刺激前(静息状态下),HR、MAP和FBF取30 s基线数据均值作为基础值,FVC数据自动生成,交感刺激过程中MAP和FBF采集频率为100 Hz。基础血液动力学(HR、MAP、FBF和FVC)用原始值表示;FBF和FVC对于交感刺激的反应用绝对变化量(Δ=交感刺激后数值-交感刺激前基础值)表示;交感刺激诱导的缩血管反应(即交感血管反应)用FVC的变化率表示,即%FVC=(FVC电刺激-FVC基础值)/FVC基础值×100%;功能性抗交感用静息状态下FVC对交感神经电刺激反应的变化率与肌肉收缩时的差值表示,即△%FVC=%FVC静息-%FVC肌肉收缩。
1.7 统计学分析
所有数据用“均数±标准差”表示。体重、心脏重量、心指数、基础血液动力学参数和功能性抗交感使用双因素方差分析(运动×药物),交感刺激诱导的血液动力学参数、交感缩血管反应(运动×药物×肌肉收缩状态)以及骨骼肌NO含量和NOS各亚型活性使用三因素方差分析(运动×药物×肌纤维类型),若交互作用和主效应具有统计学意义,则使用S-N-K检验进行多重比较。利用SPSS 20.0软件包进行统计学处理和分析,P<0.05为差异具有统计学意义。
2 结果
2.1 样本量分析
实验过程中,共7只大鼠由于不耐受运动而发生拒跑、损伤(主要是足底擦伤)、感染甚至死亡(其中E组4只、EA组3只),10只外科手术失败(其中S组和A组各3只、E组1只、EA组2只),其余动物在整个实验期间均较活泼,未出现精神异常、掉毛、体毛凌乱、无光泽、大便形态改变等不良反应。最终样本量n=43,其中S组(n=12)、A组(n=12)、E组(n=10)、EA组(n=9)。
2.2 体重、心脏重量和心指数的变化
各组体重、心脏重量和心指数的变化见表1所示。各指标运动主效应均有统计学意义(P<0.05),药物主效应和交互作用则无统计学差异(P>0.05);多重比较显示,E组和EA组体重低于S组(P<0.05),心脏重量和心指数则高于S组(P<0.05)。

表1 各组体重、心脏重量和心指数的变化Table 1 Body Weight,Heart Weight and Cardiac Index of Each Group
2.3 基础血液动力学参数的变化
各组基础(未经交感刺激、肌肉未收缩状态下)血液动力学参数(HR、MAP、FBF和FVC)的变化见表2所示。运动主效应、药物主效应以及交互作用均无统计学意义(P>0.05)。

表2 基础血液动力学参数的变化Table 2 Changes of Baseline Hemodynamic Parameter
2.4 肌肉不同状态下交感刺激诱导的血流量的变化
肌肉不同状态下交感刺激诱导的血液动力学变化(△FBF和△FVC)见表3所示。运动主效应、药物主效应、肌肉状态主效应以及交互作用对△FBF和△FVC的影响均有统计学意义(P<0.05)。多重比较显示,肌肉静息状态时,A组△FBF和△FVC低于S组(P<0.05);肌肉收缩时,E组△FBF和△FVC低于S组(P<0.05);EA组△FBF和△FVC在肌肉静息以及收缩时均低于其他3组(P<0.05)。
2.5 交感缩血管反应的变化
肌肉静息状态以及收缩时FVC对交感刺激的反应(%FVC,交感缩血管反应)见图2所示。运动主效应、药物主效应、肌肉状态主效应以及交互作用对%FVC的影响均有统计学意义(P<0.05);多重比较显示,静息状态下,A组%FVC低于S组(P<0.05),肌肉收缩时,E组%FVC低于S组(P<0.05),肌肉不同状态下EA组%FVC均低于其他3组(P<0.05)。
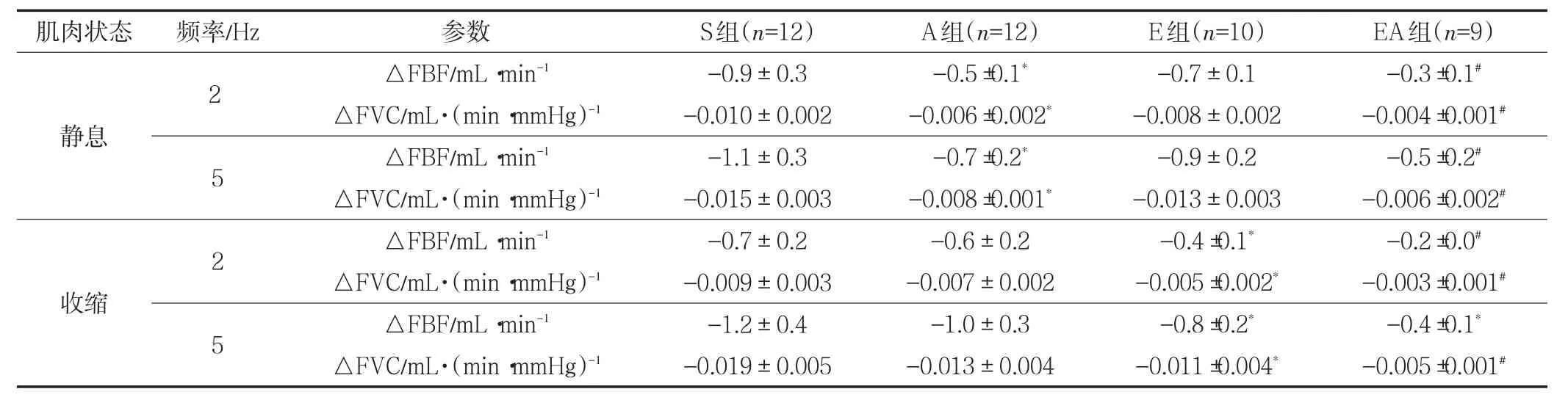
表3 肌肉不同状态(静息、收缩)下交感刺激(2、5Hz)诱导的血流量变化Table 3 Blood Flow Induced by Sympathetic Electrostimulation(2 and 5 Hz)During Different Muscle State(at Rest and During Muscle Contraction)
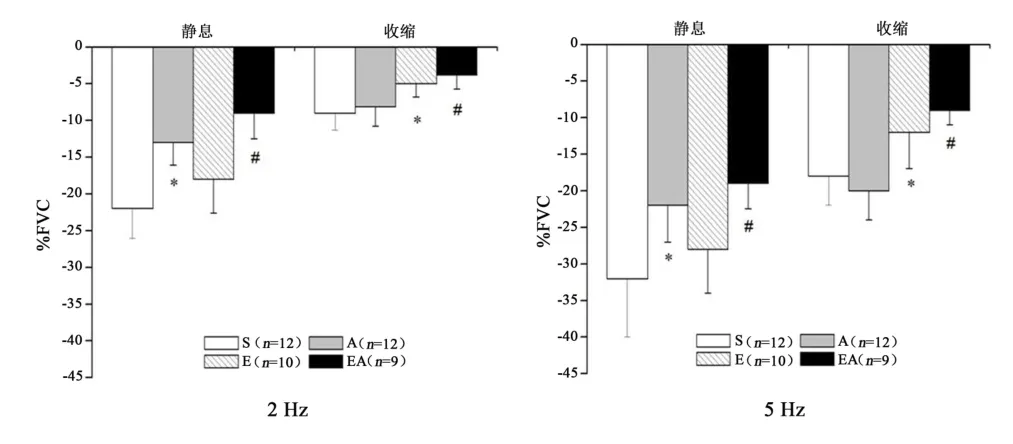
图2 交感缩血管反应(%FVC)的变化Figure 2 Sympathetic Vasoconstriction Response(%FVC)
2.6 功能性抗交感的变化
功能性抗交感(△%FVC)的变化见图3。2 Hz交感电刺激时,运动主效应对△%FVC的影响有统计学意义(P<0.05),药物主效应以及交互作用则无显著性差异(P>0.05);多重比较显示,E组△%FVC高于S组(P<0.05),A组与S组无显著性差异(P>0.05),EA组高于A组和S组(P<0.05)。5 Hz交感电刺激时,运动主效应、药物主效应以及交互作用对△%FVC的影响均有统计学意义(P<0.05);多重比较显示,A组和E组△%FVC均高于S组(P<0.05),EA组高于其他3组(P<0.05)。
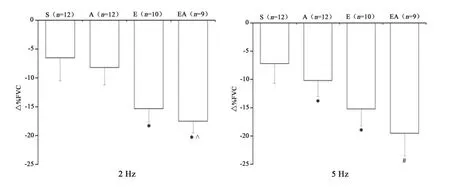
图3 功能性抗交感(△%FVC)的变化Figure 3 Functional Sympatholysis(△%FVC)
2.7 骨骼肌NO含量和NOS活性的变化
骨骼肌NO含量见图4所示。运动主效应、药物主效应以及交互作用对骨骼肌NO含量的影响均有统计学意义(P<0.05),肌纤维类型主效应无显著性差异(P>0.05);多重比较显示,A组和E组NO含量高于S组(P<0.05),EA组高于其他3组(P<0.05)。
骨骼肌iNOS活性见图5所示。肌纤维类型主效应、运动主效应、药物主效应以及交互作用各主效应以及交互作用对iNOS活性的影响均无统计学意义(P>0.05)。

图4骨骼肌NO含量Figure 4 NO Content in Skeletal Muscle

图5 骨骼肌iNOS活性Figure 5 iNOS Activity in Skeletal Muscle
骨骼肌eNOS活性见图6所示。药物主效应对eNOS活性的影响具有统计学意义(P<0.05),运动主效应、肌纤维类型主效应以及交互作用则均无显著性差异(P>0.05);多重比较显示,A组eNOS活性高于S组(P<0.05),EA组高于E组和S组(P<0.05)。
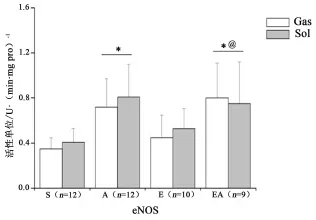
图6 骨骼肌eNOS活性Figure 6 eNOS Activity in Skeletal Muscle
骨骼肌nNOS活性见图7所示。运动主效应和肌纤维类型主效应对nNOS活性的影响具有统计学意义(P<0.05),药物主效应和交互作用无显著性差异(P>0.05);多重比较显示,各组Gas中nNOS活性高于Sol(P<0.05),E组Gas中nNOS活性高于S组(P<0.05),EA组高于A组和S组(P<0.05)。

图7 骨骼肌nNOS活性Figure 7 nNOS Activity in Skeletal Muscle
3 讨论
本研究旨在探讨刺五加提取物、运动以及两者联合应用对健康SD大鼠骨骼肌交感缩血管反应和功能性抗交感的影响及可能机制,结果发现,(1)单纯补充刺五加提取物增加骨骼肌(Gas和Sol)eNOS活性并改善骨骼肌静息状态下的交感缩血管反应以及功能性抗交感;(2)单纯运动可减轻骨骼肌收缩时的交感缩血管反应并增强功能性抗交感效应,其机制可能与Gas(快肌)nNOS活性上调有关;(3)刺五加提取物联合运动可同时上调eNOS(快肌和慢肌)和nNOS(快肌)活性,对骨骼肌静息和收缩时的交感缩血管反应以及功能性抗交感的影响具有协同效应。
3.1 运动、刺五加提取物对骨骼肌交感缩血管反应和功能性抗交感的影响
肌肉收缩时交感缩血管反应和功能性抗交感同时发生具有重要生理意义,能够促使心输出量重新分配,保证代谢活跃的工作肌得到充足的血流灌注和氧供应。关于运动训练对功能性抗交感的影响,不同研究结果并不一致。课题组前期的研究[7]显示,8周有氧运动改善骨骼肌功能性抗交感,且这一效应呈现运动强度依赖性。本研究采用高强度间歇运动(high intensity interval training,HIT)方式并进一步证实,运动能够减轻骨骼肌收缩时的交感缩血管反应并增强功能性抗交感,同时骨骼肌在交感刺激时的血流量增加。以自发性高血压大鼠为模型的研究同样显示,自主跑轮运动能够改善功能性抗交感。然而亦有研究得到阴性结果,即6周间歇性握力训练并未改变上肢功能性抗交感[16],5周单腿伸膝运动后,运动肢与对侧非运动肢功能性抗交感并无显著性差异[3]。病例对照研究显示,提高有氧运动能力能够延缓由于增龄引起的抗交感功能受损[4],然而久坐人群下肢功能性抗交感与具有规律运动习惯者并无显著性差异[16-17]。研究结果不一致可能与研究对象、训练负荷(强度、量、持续时间等)、干预时间、测试部位等因素有关。研究发现,脉管系统对于短期运动训练(≤6周)仅产生功能性适应,而结构适应则需要长期干预[18];另外运动对功能性抗交感的良性效应与运动强度成正比[7]。本研究采用的运动方案强度较高且干预时间为8周(>6周),因此对交感神经支配的血管调控能够产生显著影响。此外,E组静息状态下的交感缩血管反应并无变化,与D.W.WRAY等[17]的横断面研究一致,即自行车运动员(长期下肢运动)和无训练者的受试者安静时下肢交感缩血管反应无显著性差异,提示长期规律运动对安静时交感缩血管反应并无影响。
关于刺五加提取物对骨骼肌代谢以及运动能力的积极效应已有多项报道[12-14],然而其对于骨骼肌交感缩血管反应和功能性抗交感的作用鲜有涉及。本研究发现,骨骼肌静息状态下A组%FVC低于S组,但在肌肉收缩时则无显著性差异,提示刺五加提取物能够减轻骨骼肌安静时的交感缩血管反应。虽然A组基础血液动力学并无显著性改变,但静息状态下进行交感电刺激时的△FBF和△FVC低于S组,说明刺五加提取物能够增加交感刺激时的血流量灌注。此外,A组在2 Hz交感电刺激时的%△FVC无显著性变化,而5 Hz时升高,提示单纯补充刺五加提取物能够改善高频交感刺激时的功能性抗交感。更为重要的是,EA组骨骼肌不同状态下的%FVC均低于其他3组,且2和5 Hz交感电刺激时的%△FVC均显著性增加,说明规律运动同时补充刺五加提取物能够对静息时以及肌肉收缩时的交感缩血管反应均产生抑制作用,且对于不同频率交感刺激时的功能性抗交感具有协同效应,进而改善运动时工作肌的血流灌注。
3.2 NOS/NO系统的可能作用机制
功能性抗交感的具体机理尚不清楚,已证实来源于骨骼肌和/或血管内皮的某些血管活性物质具有抗交感效应,其中NO及其介导的血管舒张作用至关重要[1]。研究显示[7,15,19],NO 能够抑制骨骼肌安静时以及收缩时的交感缩血管反应。本研究同样发现,A组和E组骨骼肌NO含量均显著性升高,提示刺五加或运动均可通过上调NO改善功能性抗交感,然而介导这一过程的NOS亚型尚不得而知。iNOS在血管组织表达[20],可被IL-1,TNF-α等细胞因子激活[21],在免疫应答中起作用。动物实验[22]和人体研究[23]均证实,选择性iNOS抑制剂并不能改变骨骼肌血管电导,提示iNOS未参与对血管张力的调节。在本研究中,iNOS在各组间无显著性差异,提示运动或刺五加并不能改变iNOS表达,这与任文君等[24]的研究一致,即6周有氧运动能够上调大鼠骨骼肌NO含量,但对iNOS活性并无显著性影响。研究表明,高强度长时间运动[25]以及力竭运动[26]可诱导炎症因子大量产生并上调iNOS含量,造成NO过度升高,进而导致机体氧化损伤。本研究采用HIT运动模式,虽然每次运动时强度较高,但由于运动时间较短且存在间歇期(完全休息),因此整体上属于中等强度。已证实[27-28],急性HIT后可产生与持续有氧运动相似的代谢适应且HIT后炎症因子升高幅度低于持续运动,而长期HIT则能够下调炎症因子表达。据此推测,本研究中运动和/或补充刺五加未上调炎症因子水平,因此iNOS无显著性变化。
eNOS和nNOS在骨骼肌和血管内皮组成性表达[29],受细胞内Ca2+浓度的调节。灌注非选择性NOS阻断剂并不能进一步增强nNOS阴性小鼠肌肉收缩时的交感缩血管反应[30],提示NO依赖性交感缩血管抑制作用可能完全经由源自nNOS的NO介导;eNOS阴性C57BL/6小鼠运动时NO产生量与对照组(即eNOS正常组)并无显著性差异[31],证实eNOS并未参与肌肉收缩诱导产生NO的生理过程;nNOS阴性小鼠[30]以及nNOS缺乏患者[32]功能性抗交感作用受损,进一步提示肌肉收缩时由nNOS催化的新生NO是抑制交感缩血管反应的主要来源。然而上述基因缺失模型或患者长期缺乏NO可能对骨骼肌发育以及血管信号转导通路造成影响[33-35],研究结论可信度值得商榷。F.A.RABELO等[36]的在体实验中,肠系膜血管床内皮破坏后对于交感刺激诱导的增压反射增强,随后给予非选择性NOS阻断剂增压反射进一步提高,提示源于eNOS和nNOS的NO均具有交感抑制作用。根据N.G.JENDZJOWSKY等[9]的测算,骨骼肌安静状态下nNOS在NO介导的抗交感中的贡献仅约30%,而收缩时这一比例则提高至80%,提示安静时血管紧张度主要由eNOSNO调节[31],而肌肉收缩时的交感缩血管抑制效应则主要经由nNOS源性NO介导,因此nNOS对于功能性抗交感具有重要生理意义。在本研究中,各组Gas和Sol中eNOS无显著性差异,nNOS在Gas高于Sol,说明eNOS分布不存在肌纤维类型特异性,nNOS则主要在快肌纤维表达。然而NO含量并无肌纤维依赖性,这是由于NO分子量较小,可通过扩散的方式穿过细胞膜,以旁分泌和自分泌方式完成其生理功能。
在本研究中,A组eNOS活性升高,推测补充刺五加通过磷脂酰肌醇-3-激酶(PI3K)-丝氨酸/苏氨酸蛋白激酶(Akt)信号途径上调eNOS蛋白1 177位丝氨酸(eNOSSer1177)磷酸化水平(Ser1177磷酸化是eNOS活化的必要条件),这与S.Y.PARK等[37]针对自发性高血压大鼠的研究结果一致,即刺五加提取物能够上调主动脉eNOSSer1177磷酸化蛋白表达量。E组eNOS活性无显著性变化,提示8周HIT并未对eNOS/NO系统产生显著性影响,可能与运动时间较短有关。M.B.HARRIS等[38]发现,10周跑台运动后比目鱼肌eNOS并无显著性改变,与本研究结果一致。由于eNOS/NO系统主要负责骨骼肌安静时血流量的调节,因此E组静息时的交感缩血管反应并无显著性变化,而A组则显著性下降。
E组Gas中nNOS活性升高,Sol则无显著性变化,提示8周HIT能够诱导快肌nNOS上调。与本研究结果类似,大鼠4周高强度游泳训练[39]、4~10周跑台运动[40,41],青年男性10周剧烈蹬车运动[42]均可上调骨骼肌nNOS活性。然而亦有研究得到阴性结果,即大鼠10周中等强度跑台运动[38],健康男性6周耐力训练[43]未改变nNOS活性和表达量。由于nNOS主要在II型肌纤维(快肌)表达[44],因此运动负荷以及肌纤维类型不同可能是研究结果间存在差异的主要原因。运动时,当强度较低时主要动员I型肌纤维,随运动强度增加II型肌纤维逐渐募集[45]。由于本研究采用HIT运动模式,大量快肌(Gas)动员。研究还证实[46],快肌中NO介导的抗交感作用较慢肌更为明显。因此可以推测,“运动强度较高→大量快肌纤维募集→胞内Ca2+浓度升高→nNOS激活→NO含量增加→血管舒张反应”是HIT改善功能性抗交感的主要机制。A组Gas和Sol中nNOS活性均无显著性差异,但5 Hz交感电刺激时的功能性抗交感改善,可能是由于刺五加诱导eNOS活性显著上调之故。虽然eNOS在功能性抗交感中的贡献虽小(~20%),但仍起一定作用。本研究中EA组快肌和慢肌eNOS以及快肌nNOS活性均显著性升高,因此静息时的交感缩血管反应和功能性抗交感均得到改善,提示运动与刺五加对于骨骼肌不同收缩状态下血流量的调节具有协同效应。
4 结 论
(1)单纯补充刺五加提取物能够抑制骨骼肌静息状态下的交感缩血管反应并改善功能性抗交感,其机制与可能与骨骼肌(快肌和慢肌)eNOS活性增加有关。
(2)单纯运动可增强功能性抗交感,其机制可能与快肌纤维nNOS活性上调有关。
(3)刺五加提取物联合运动可同时上调eNOS(快肌和慢肌)和nNOS(快肌)活性进而增加NO含量,对改善骨骼肌静息、收缩时的交感缩血管反应以及功能性抗交感具有协同效应。
5 研究意义与展望
本研究具有一定的实践意义。第一,单纯补充刺五加提取物改善健康大鼠静息状态下交感缩血管反应有助于预防以交感神经过度兴奋为特征的疾病(如高血压)。例如经常锻炼者(运动预适应)高血压发病率相对较低,其机制可能与长期训练改善安静时自主神经功能有关(交感活性降低,迷走活性增加)[47]。第二,运动员进行规律训练同时若合理补充刺五加提取物可增加运动时的血流灌注并有望进一步提升训练效果和运动能力,然而刺五加是否可作为提高运动员运动表现以及改善功能性抗交感的营养补剂尚需进一步验证。第三,某些病理生理状态(如久坐[3]、衰老[4]、高血压[5]、心衰[6]等)下同样存在交感活性增加、抗交感效应受损,运动时骨骼肌血管阻力升高、血流灌注不良,运动中心血管不良事件的发生率增加,通过各种手段(如运动和/或补充刺五加)上调骨骼肌NOS(特别是nNOS)表达量和/或活性进而改善功能性抗交感在一定程度上能够恢复运动中异常的血液动力学反应,降低心血管不良事件发生。
今后的研究应致力于以下3个方面。首先,NOS/NO系统的抗交感作用在人体研究中并不一致,甚至相互矛盾[32,48-51],因此应以不同健康状态人群的为研究对象,确定NOS/NO系统在骨骼肌血流调节中的作用。其次,骨骼肌脉管系统尚存在交感舒血管纤维,其神经末梢释放乙酰胆碱,与血管平滑肌M胆碱能受体结合而产生舒血管效应,对于运动时血流量重新分配起一定作用[52],然而“功能性抗交感”和M受体在肌肉收缩时血流量重新分配中的作用和地位鲜有关注,今后的研究应关注工作肌血流灌注调节的多种机制以及运动训练等干预措施的影响效果。最后,刺五加提取物包含多种成分,然而起抗交感作用的具体物质尚未明确,因此应进一步分析刺五加提取物抑制交感缩血管反应的有效成分以及与运动联合作用的效果。
