氯美噻唑对乙醇诱导大鼠肝损伤的抑制作用研究
2018-09-18王剑彬吴彩月王丽斯吴恺明
王剑彬,吴彩月,王丽斯,吴恺明
(1.广州医科大学附属乐从医院 消化科,广东 佛山 528315;2.广东省佛山市顺德区乐从社区卫生服务中心,广东 佛山 528315;3.广州医科大学附属乐从医院 检验科,广东佛山 528315;4.中山大学附属第一医院 胃肠外科中心,广东 广州 510080)
氯美噻唑(Clormethiazole, CMZ)为噻唑类衍生物,具有镇静、催眠、抗惊厥作用[1]。肝损伤的主要病理形式包括酒精性肝炎、肝纤维化、肝硬化等,病因是长期大量饮酒诱导肝细胞色素P450 2E1(cytochrome P450 2E1, CYP2E1)的表达,增加自由基对肝脏的损伤[2-3]。研究表明,CMZ在翻译后抑制CYP2E1基因的转录,从而影响CYP2E1的活性[4-6]。本文通过复制慢性酒精性肝损伤大鼠模型,以期阐明CMZ在酒精所致肝细胞损伤中发挥的重要作用,为临床防治酒精性肝损伤提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 无特定病原体级雄性SD大鼠32只,体重(220±20)g,购自北京维通利华生物技术有限公司,合格证号SCXK-京-2016-0012。
1.1.2 药物试剂 CMZ纯度99.8%(上海梯希爱化成工业发展有限公司),氯唑沙宗(Chlorzoxazone, CHZ)纯度99%(上海梯希爱化成工业发展有限公司),43%乙醇(河南省化工试剂有限公司),Vector ABC试剂盒和丙二醛(Malondialdehyde, MDA)试剂盒购自南京建成生物工程有限公司,CYP2E1、CYP4A、CYP3A抗体购自美国Santa Cruz公司。
1.1.3 实验仪器 CX23型光学显微镜(日本奥林巴斯公司),AU680型全自动生化分析仪(美国贝克曼库尔特公司),UV1901双光束紫外分光光度计(上海精学科学仪器有限公司),SONICS超声波细胞破碎仪(美国BRANSON公司),安捷伦1260高效液相色谱仪(美国Agilent公司),ULTRACUTR型超薄切片机(德国莱卡公司),JA2003型电子分析天平(上海天平仪器厂)。
1.2 方法
1.2.1 大鼠慢性酒精性肝损伤模型的复制 按2个影响因素的析因设计分组:A干预因素:①不干预,②干预(给予CMZ);B模型复制因素:①无损模型(给予葡萄糖),②损害模型(给予乙醇)(见表1)。32只雄性SD大鼠适应性饲养1周后,按体重均衡随机分为4组,每组8只。

表1 2个因素的析因设计
A2B1:葡萄糖+CMZ组,用生理盐水将CMZ配制成所需浓度,大鼠灌胃CMZ 80 mg/(kg·d),2 h后灌胃 43% 葡萄糖 [0.1 ml/(kg·d)],60 d。
A1B1:葡萄糖对照组(阴性对照组),大鼠灌胃葡萄糖+CMZ组等体积生理盐水,2 h后灌胃43%葡萄糖液 [0.1 ml/(kg·d)],60 d。
A2B2:乙醇+CMZ组,用生理盐水将CMZ配制成所需浓度,大鼠灌胃CMZ 80 mg/(kg·d),2 h后灌胃 43% 乙醇 [0.1 ml/(kg·d)],60 d。
A1B2:乙醇模型组(阳性对照组),大鼠灌胃乙醇+CMZ组等体积生理盐水,2 h后灌胃43%乙醇[0.1 ml/(kg·d)],60 d。
第60天,大鼠禁食但不禁水,12 h后在眼眶处采血,收集大鼠血浆,称体重。各组大鼠腹腔注射CHZ 150μmol/kg,分别于给药后1、2和3 h在眼眶处采集大鼠血样,随即断头处死。血液4 500 r/min离心10 min,储存于-20℃冰箱。取肝脏全叶并称重,其中一叶采用10%多聚甲醛固定,剩余部分冻存于-80℃冰箱。每组8只大鼠,实际每组模型复制成功6或7只,故最终实验按每组6只大鼠计算。
1.2.2 大鼠肝指数的计算及血浆乙醇浓度和血清谷丙转氨酶(alanine transaminase, ALT)活性的检测 计算各组大鼠的肝脏指数(肝重/体重);采用全自动生化分析仪通过酶动力学方法测定ALT的活性;采用放射性能量衰变实验测定血浆乙醇浓度[7]。
1.2.3 大鼠肝组织病理学观察和分级 取用10%多聚甲醛固定的肝脏组织,常规石蜡包埋,4μm组织切片,苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,光学显微镜下观察各组大鼠肝脏形态学变化;肝脏形态学病理分级参照MATHEWS等[8]的方法。
1.2.4 肝组织CYP2E1免疫组织化学法染色 CYP2E1免疫组织化学染色采用SP法[9],DAB显色。一抗CYP2E1(1∶600稀释),使用Vector ABC试剂盒和生物素标记的二抗显现CYP2E1的阳性区域。
1.2.5 肝组织匀浆MDA含量的测定 在752型分光光度计上用分光光度法测定MDA含量,其浓度以pmol/mg匀浆蛋白表示。通过检测脂肪组织的MDA反映脂质过氧化程度,使用硫代巴比妥酸检测MDA[10]。
1.2.6 大鼠肝脏蛋白酶体活性的测定 制备肝匀浆,检测糜蛋白酶活性(LLVY-AMC水解程度)、类胰蛋白酶活性(LSTR-AMC水解程度)和谷氨酰肽水解酶活性(LLE-NA水解程度)[11]。在pH 7.5的0.1 mol Tris-HCl中加入20~200μg相同蛋白和40μmol缩氨酸,30℃恒温摇床反应1 h。LLVY-AMC和LSTRAMC的激发和发射检测波长分别为390和440 nm,β-甲萘胺的激发和发射检测波长分别为335和410 nm。
1.2.7 Western blot检测 将各组冻存的大鼠肝脏按照曹艳等[12]的方法制备成肝微粒体。使用大鼠多克隆抗体,采用Western blot检测大鼠CYP2E1、CYP3A、CYP4A蛋白相对表达量[13]。采用4%浓缩胶和8.7%分离胶行聚丙烯酰胺凝胶电泳。将肝微粒体溶解在聚丙烯酰胺凝胶缓冲液中(3% SDS,0.2 mol Tris-Hcl,pH 6.8,26%丙三醇,2 mol β-巯基乙醇)100℃加热2 min。按25μl/孔上样,微粒体蛋白电泳分离后电转移至PVDF膜,脱脂奶粉封闭1 h。一抗(1∶5 000稀释)室温孵育1 h;HRP标记的山羊抗兔二抗(1∶2 000稀释)室温孵育1 h。充分洗膜后加入ECL化学发光液,采用Image Quant LAS 4000型蛋白成像系统(德国GE Healthcare公司)进行曝光处理。实验结果以密度为单位来计算(UA/mg)。
1.2.8 大鼠体内CYP2E1活性的检测 通过高效液相色谱检测血浆样品中6-羟基氯唑沙宗和CHZ的含量(μg/ml),采用6-羟基氯唑沙宗/氯唑沙宗比值评估各组大鼠体内CHZ的代谢程度[14]。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析或析因设计的方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 CMZ对酒精性肝损伤大鼠体重、肝脏指数及肝功指标的影响
实验期间(60 d),乙醇模型组和葡萄糖对照组大鼠以相同的速率成长(P>0.05)。乙醇模型组平均增长体重3 g/d,葡萄糖对照组为2.2 g/d,乙醇+CMZ组为1.5 g/d,葡萄糖+CMZ组为2.1 g/d。乙醇与葡萄糖干预效果比较,差异有统计学意义(P<0.05),乙醇模型组的肝重和相对肝重(相对肝重=肝重/体重×100%)高于葡萄糖对照组,但葡萄糖+CMZ组的肝重和相对肝重较乙醇+CMZ组降低。见表2。
表2 CMZ对酒精性肝损伤大鼠体重、肝脏指数的影响(n =6,±s)

表2 CMZ对酒精性肝损伤大鼠体重、肝脏指数的影响(n =6,±s)
组别 体重/g 肝重/g 相对肝重/%葡萄糖对照组 347±24 11.9±1.8 3.4±0.4乙醇模型组 372±38 18.8±2.9 5.0±0.3葡萄糖+CMZ组 340±31 13.3±1.4 3.9±0.3乙醇+CMZ组 301±61 16.6±5.0 5.4±0.9 FA值 5.465 0.093 4.087 PA值 0.030 0.764 0.057 FB值 0.172 16.017 50.086 PB值 0.683 0.001 0.000 FA×B值 3.762 1.905 0.051 PA×B值 0.067 0.183 0.824
2.2 CMZ对酒精性肝损伤大鼠肝功指标和血浆乙醇含量的影响
乙醇模型组血浆中乙醇浓度与乙醇+CMZ组比较,差异无统计学意义(P>0.05)。乙醇模型组与葡萄糖对照组的ALT水平比较,差异无统计学意义(P>0.05)。但乙醇模型组与乙醇+CMZ组的ALT水平比较,差异有统计学意义(P<0.05);葡萄糖对照组与葡萄糖+CMZ组的ALT水平比较,差异有统计学意义(P<0.05),表明CMZ的影响效果显著。见表3。
表3 CMZ对酒精性肝损伤大鼠肝功指标和血浆乙醇含量的影响 (n =6,±s)
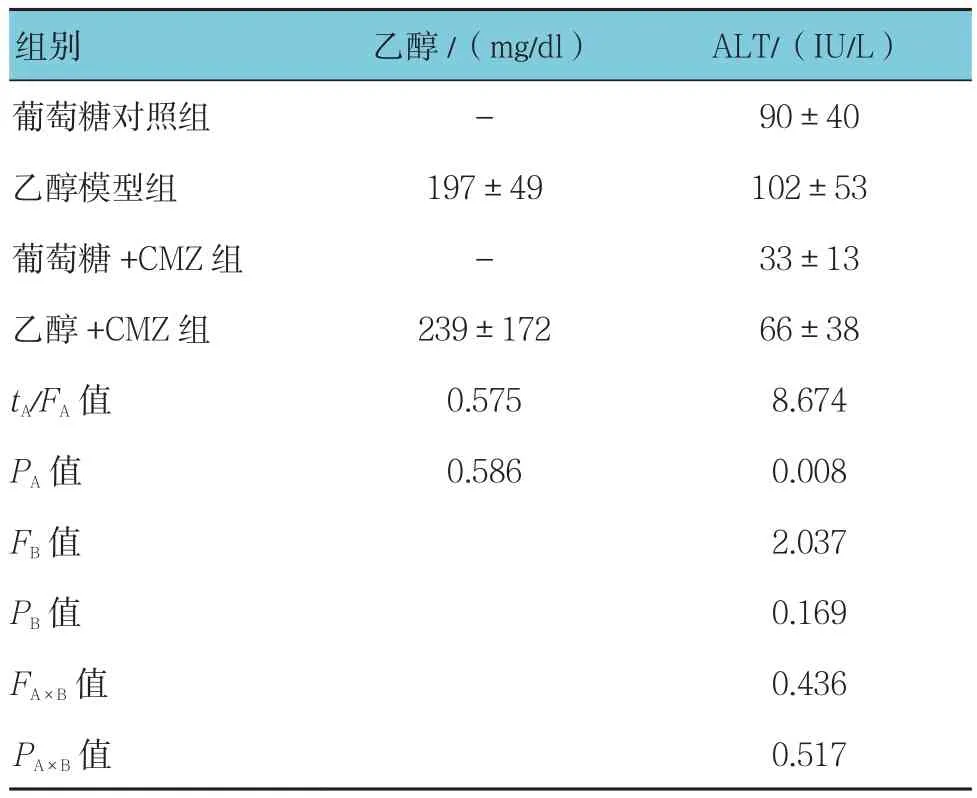
表3 CMZ对酒精性肝损伤大鼠肝功指标和血浆乙醇含量的影响 (n =6,±s)
组别 乙醇/(mg/dl) ALT/(IU/L)葡萄糖对照组 - 90±40乙醇模型组 197±49 102±53葡萄糖+CMZ组 - 33±13乙醇+CMZ组 239±172 66±38 tA/FA值 0.575 8.674 PA值 0.586 0.008 FB值 2.037 PB值 0.169 FA×B值 0.436 PA×B 值 0.517
2.3 CMZ对酒精性肝损伤大鼠肝脏组织病理学变化的影响
乙醇模型组大鼠的病理分级高于乙醇+CMZ组,乙醇模型组大鼠的肝脏病理分级参数(脂肪变性、坏死、炎症、纤维化)较乙醇+CMZ组差(P<0.05)。乙醇模型组大鼠的肝脏纤维化病灶较明显,这种纤维化主要存在于肝小叶中心或者细胞外周。乙醇模型组大鼠的肝脏与乙醇+CMZ组相比,有明显的脂肪性病变、坏死及炎症。见表4。
葡萄糖对照组可见肝小叶轮廓清晰,小叶中央静脉向四周呈放射状排列,肝细胞排列尚整齐,细胞分界清,核圆,位于细胞中央,胞质丰富,呈嗜碱性(见图1A)。乙醇模型组可见肝小叶结构破坏,肝板排列紊乱,呈点、片状坏死,肝细胞肿胀明显,胞质中可见大小不等、数量不一的圆形脂肪空泡,散在肝细胞嗜酸性变,小叶中央静脉周围和汇管区有炎症细胞浸润,有的肝细胞质中有红色颗粒状Mallory小体(见图1B)。乙醇+CMZ组大鼠肝细胞浊肿明显减轻,有散在炎症细胞浸润,肝细胞内偶有小脂滴(见图1C)。葡萄糖+CMZ组也偶见脂肪空泡,肝细胞肿胀明显,胞体肿大成球形,小叶中央静脉周围和汇管区有炎症细胞浸润(见图1D)。
表4 4组大鼠肝脏病理分级 (n =6,分,±s)
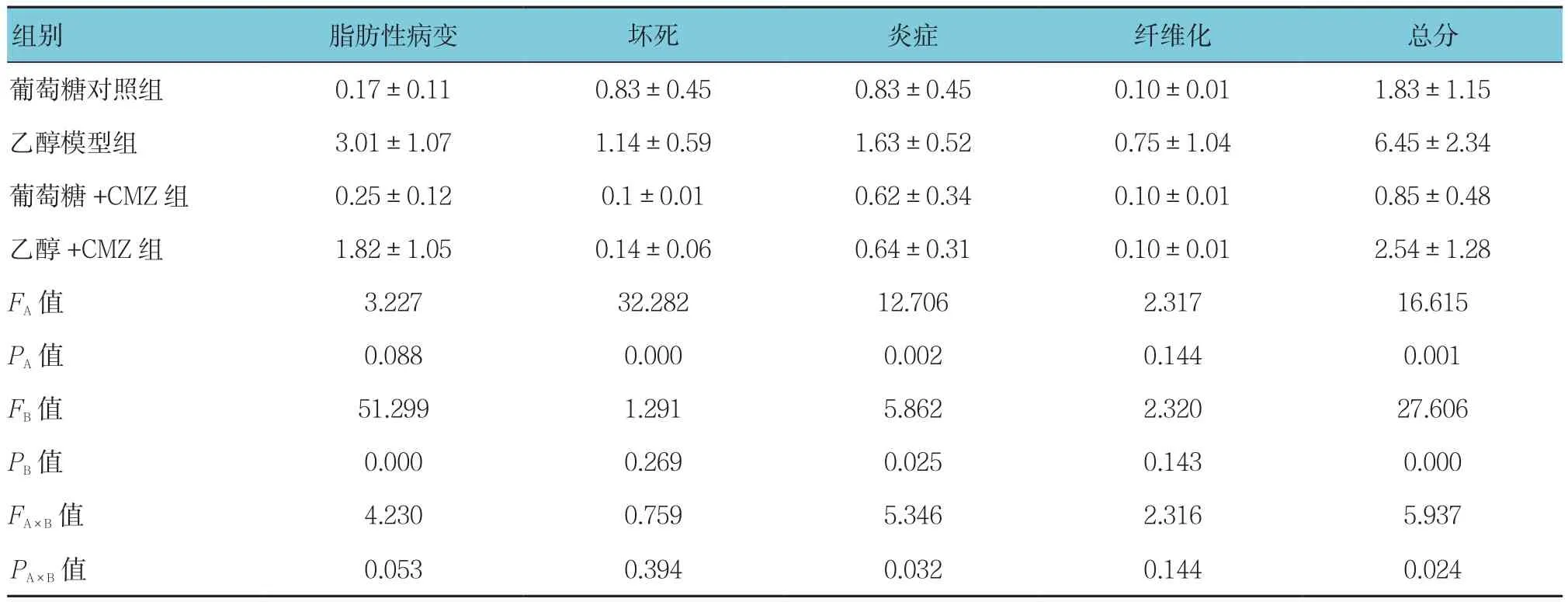
表4 4组大鼠肝脏病理分级 (n =6,分,±s)
组别 脂肪性病变 坏死 炎症 纤维化 总分葡萄糖对照组 0.17±0.11 0.83±0.45 0.83±0.45 0.10±0.01 1.83±1.15乙醇模型组 3.01±1.07 1.14±0.59 1.63±0.52 0.75±1.04 6.45±2.34葡萄糖+CMZ组 0.25±0.12 0.1±0.01 0.62±0.34 0.10±0.01 0.85±0.48乙醇 +CMZ 组 1.82±1.05 0.14±0.06 0.64±0.31 0.10±0.01 2.54±1.28 FA值 3.227 32.282 12.706 2.317 16.615 PA值 0.088 0.000 0.002 0.144 0.001 FB值 51.299 1.291 5.862 2.320 27.606 PB值 0.000 0.269 0.025 0.143 0.000 FA×B值 4.230 0.759 5.346 2.316 5.937 PA×B 值 0.053 0.394 0.032 0.144 0.024

图1 CMZ对酒精性肝损伤大鼠肝组织病理变化的影响 (HE×10)
2.4 CMZ对酒精性肝损伤大鼠肝组织CYP酶和MDA含量的影响
乙醇模型组CYP2E1蛋白表达量高于葡萄糖对照组和葡萄糖+CMZ组(P<0.05),表明乙醇诱导大鼠体内CYP2E1蛋白的表达(见图2)。但乙醇模型组与乙醇+CMZ组的CYP4A和CYP3A相对表达量比较,差异无统计学意义(P>0.05);乙醇模型组与葡萄糖对照组、乙醇+CMZ组、葡萄糖+CMZ组的MDA含量比较,差异有统计学意义(P<0.05),乙醇模型组的MDA含量高于其他各组。见表5。

图2 4组大鼠CYP2E1蛋白的表达
表5 CMZ对酒精性肝损伤大鼠肝组织CYP酶和丙二醛含量的影响 (n =6,±s)
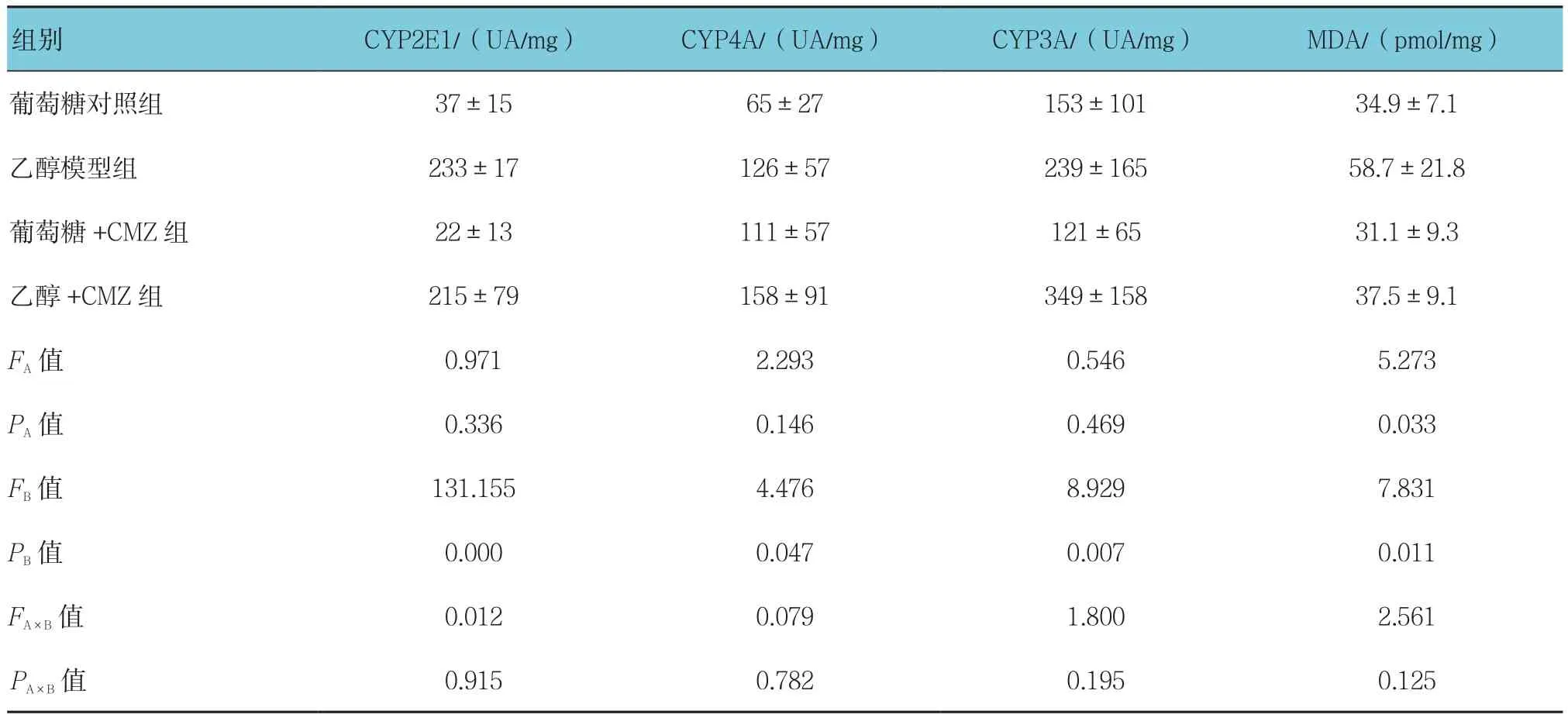
表5 CMZ对酒精性肝损伤大鼠肝组织CYP酶和丙二醛含量的影响 (n =6,±s)
组别 CYP2E1/(UA/mg) CYP4A/(UA/mg) CYP3A/(UA/mg) MDA/(pmol/mg)葡萄糖对照组 37±15 65±27 153±101 34.9±7.1乙醇模型组 233±17 126±57 239±165 58.7±21.8葡萄糖+CMZ组 22±13 111±57 121±65 31.1±9.3乙醇 +CMZ 组 215±79 158±91 349±158 37.5±9.1 FA值 0.971 2.293 0.546 5.273 PA值 0.336 0.146 0.469 0.033 FB值 131.155 4.476 8.929 7.831 PB值 0.000 0.047 0.007 0.011 FA×B值 0.012 0.079 1.800 2.561 PA×B 值 0.915 0.782 0.195 0.125
2.5 CMZ对酒精性肝损伤大鼠肝组织CYP2E1蛋白表达的影响
鼠肝小叶部位免疫组织化学法染色显示,乙醇模型组染色区域与乙醇+CMZ组基本一致(见图3A)。葡萄糖对照组染色面积较小,仅见于中心部位的肝脏细胞。葡萄糖+CMZ组与乙醇+CMZ组相比,肝小叶CYP2E1阳性区域明显缩小(见图3B)。

图3 两组大鼠肝组织中CYP2E1的表达
2.6 CMZ对酒精性肝损伤大鼠肝组织蛋白酶体活性的影响。
2.6.1 糜蛋白酶活性 4组大鼠糜蛋白酶活性比较,经单因素方差分析,差异有统计学意义(F=17.436,P=0.000)。两两比较经LSD-t检验,乙醇模型组的糜蛋白酶活性低于葡萄糖对照组和葡萄糖+CMZ组(P<0.05);乙醇+CMZ组的糜蛋白酶活性与乙醇模型组比较,差异无统计学意义(P>0.05)。见表6和图4。
2.6.2 类胰蛋白酶活性 4组大鼠类胰蛋白酶活性水平比较,经单因素方差分析,差异有统计学意义(F=11.457,P=0.000)。两两比较经LSD-t检验,乙醇模型组的类胰蛋白酶活性较葡萄糖对照组降低(P<0.05)。见表6和图5。
2.6.3 谷氨酰肽水解酶活性 4组大鼠谷氨酰肽水解酶活性水平比较,经单因素方差分析,差异无统计学意义(F=0.995,P=0.416)。见表6和图6。
表6 4组大鼠肝组织蛋白酶体和CYP2E1活性比较 (n =6,±s)

表6 4组大鼠肝组织蛋白酶体和CYP2E1活性比较 (n =6,±s)
6-羟基氯唑沙宗/氯唑沙宗比值葡萄糖对照组 38.5±10.1 45.6±15.8 6.7±4.5 0.11±0.02乙醇模型组 14.6±3.4 12.5±4.9 14.3±12.6 0.18±0.03葡萄糖+CMZ组 43.2±3.0 23.0±5.2 7.5±6.4 0.05±0.02乙醇+CMA组 24.7±3.0 21.8±6.1 9.8±8.5 0.03±0.03 F值 17.436 11.457 0.995 15.736 P值 0.000 0.000 0.416 0.000组别 糜蛋白酶活性/(nmol/mg)类胰蛋白酶活性/(nmol/mg)谷氨酰酞水解酶活性/(nmol/mg)
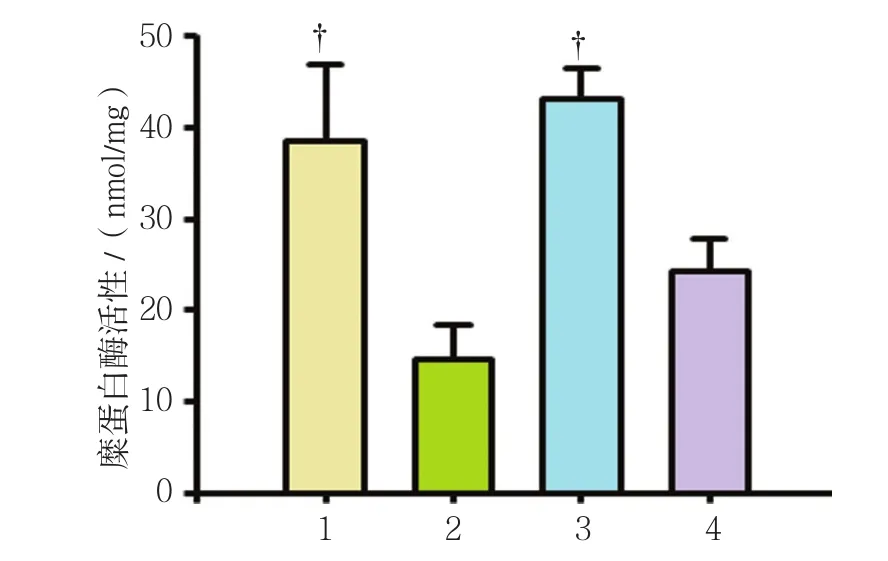
图4 4组大鼠糜蛋白酶活性比较

图5 4组大鼠类胰蛋白酶活性比较
2.7 CMZ对酒精性肝损伤大鼠体内CYP2E1活性的影响。
4组大鼠CYP2E1活性水平(6-羟基氯唑沙宗/氯唑沙宗比值)比较,经方差分析,差异有统计学意义(F=15.736,P=0.000)。 两 两 比 较 经 LSD-t检验,乙醇模型组CYP2E1活性高于葡萄糖对照组(P<0.05);葡萄糖+ CMZ组、乙醇+ CMZ组CYP2E1活性低于葡萄糖对照组(P<0.05);葡萄糖+CMZ组、乙醇+CMZ组CYP2E1活性低于乙醇模型组(P<0.05),表明CMZ不仅抑制体内乙醇诱导的CYP2E1,而且抑制自身固有的CYP2E1活性。见表6和图7。

图6 4组大鼠谷氨酰肽水解酶活性比较

图7 4组大鼠6-羟基氯唑沙宗/氯唑沙宗比值比较
3 讨论
本研究证明,CMZ能够明显改善乙醇诱导的肝脏损伤。虽然CMZ未影响乙醇对CYP2E1的诱导作用,但是最后的实验中,通过CHZ的羟基化体外代谢发现,CMZ同时抑制乙醇诱导的和自身固有的CYP2E1活性。因此,CMZ对改善乙醇诱导的肝损伤的机制可能与体内酶活性的抑制作用有关。本研究发现,大鼠体内CMZ能够减少CYP2E1的合成,与其他研究结果一致[15]。有研究表明,CYP2E1的抗体滴度与肝脏的病理程度、CYP2E1蛋白表达水平有相关性[16]。另外一个不能排除的可能性是在实验末测得的CYP2E1蛋白水平不能反映整个实验期间CHZ对CYP2E1均有抑制作用。
尽管乙醇诱导CYP2E1的表达,但是CMZ降低大鼠体内CYP2E1活性的原因可能是通过结合CYP2E1分子内其他位点而不是酶催化反应的位点,从而非竞争性抑制CYP2E1,酶被诱导的机制是自身稳定化的原因[17]。乙醇的结合会抑制蛋白磷酸-泛素化通路。CMZ同时抑制CYP2E1基因转录,但本实验未对该机制进行深入研究。乙醇模型组与乙醇+CMZ组的CYP2E1蛋白表达水平无差异,表明CMZ抑制CYP2E1基因转录的机制可能并不是那么重要。乙醇模型组与乙醇+CMZ组大鼠肝脏病理分级的差异可能是因为CMZ在体内对CYP2E1抑制,其同时解释了乙醇+CMZ组大鼠CYP2E1活性下降的原因。乙醇诱导的放射性加合物(CYP2E1-羟乙基放射性加合物)依赖于CYP2E1的形成。在乙醇模型组大鼠肝脏中CMZ抑制CYP2E1,而阻止MDA含量的升高。
本实验在研究大鼠代谢乙醇的同时也研究了体内CHZ代谢的情况,表明CMZ通过非竞争性抑制降低体内CYP2E1的活性,在乙醇+CMZ组中也检测到CMZ抑制大鼠体内CYP2E1的活性。然而在人体酒精戒断期间,乙醇作为非竞争性的抑制剂已被消除掉,CMZ对CYP2E1的活性抑制作用更突出[18]。
CMZ对乙醇诱导的微粒体蛋白酶的活性有抑制作用,但具体机制尚未明确。CMZ抑制体内CYP2E1酶的活性,减轻乙醇诱导的肝脏病理损伤。那么CMZ对乙醇诱导的微粒体蛋白活性的抑制作用是否与CMZ减缓肝损伤有联系,还需要进一步研究探讨。肝脏脂肪性病变和肝细胞蛋白的积累,使乙醇诱导的大鼠肝重增加,在乙醇+CMZ组大鼠中CMZ的摄入使肝重降低。然而在乙醇模型组中,CMZ不仅降低肝细胞的脂肪性病变程度,而且降低蛋白酶活性。乙醇+CMZ组大鼠的肝重与乙醇模型组无差异,其原因可能是肝脏蛋白的增加和脂肪细胞丢失的不平衡[19]。本实验中,大鼠的净体重无明显增加或者减轻。肝细胞质中蛋白的积累可能是由于微粒体蛋白活性丢失,造成细胞肿胀而诱发肝损伤,最终导致肝正常血流发生变化。
综上所述,CMZ能够减轻乙醇诱导的肝脏病理性病变。更重要的是CMZ能完全阻止乙醇诱导的肝硬化。CMZ改善乙醇诱导的肝脏病理分级的机制可能是抑制CYP2E1的活性。将CMZ加入乙醇模型组后,乙醇诱导的MDA水平无显著增加,因此说明CMZ有效阻止肝组织的过氧化反应。本实验结果表明,CMZ通过抑制CYP2E1的活性,而有效保护肝脏免受自由基的损伤。CMZ降低乙醇对蛋白酶活性的不良影响,表明CYP2E1产生的自由基可损伤蛋白酶。CMZ同时能抑制CYP2E1的合成。由于肝损伤患者CYP2E1活性较高,因此CMZ作为治疗肝损伤的药物具有很好的应用前景。
