大花红景天抗辐射活性成分的初步筛选
2018-09-18曲功霖王春燕齐雪松佟鹏
曲功霖,王春燕,齐雪松,佟鹏
(中国疾病预防控制中心辐射防护与核安全医学所 辐射防护与核应急中国疾病预防控制中心重点实验室,北京 100088)
红景天为景天科红景天属多年生草本或亚灌木植物,具有治疗心血管疾病、抗辐射、抗应激反应、抗衰老、增加机体免疫力等功效[1],中国药典规定红景天药用来源为景天科植物大花红景天Rhodiolacrenulata(Hook. f. et Thoms)H. Ohba的干燥根和根茎[2]。本研究主要考察大花红景天对小鼠体重及外周血象的影响,以探讨大花红景天对电离辐射所致造血功能下降的治疗作用,并初步筛选出大花红景天的抗辐射活性成分。
1 材料与方法
1.1 主要仪器、材料及试剂
POCH-100iv Diff型血球仪(日本SYSMEX公司),725型紫外分光光度计(上海第三分析仪器厂),DZF-6030A型真空干燥箱(上海一恒科学仪器有限公司),TP-214型分析天平(北京丹佛仪器有限公司),Milli-Q A10型纯水仪(美国Millipore公司),D101型大孔吸附树脂(北京慧德易科技有限责任公司),乙醇为分析纯(北京化工厂)。
1.2 试药
山柰素对照品(110861~200808)(中国食品药品检定研究院)。红景天生药购自昆明中药材市场,经云南中医学院张洁副教授鉴定,来源为景天科植物大花红景天Rhodiola crenulata(Hook.f.et Thoms)H.Ohba。将生药粉碎后置于回流加热装置中,第1次加入约10倍量70%乙醇,浸泡30 min,大火煮沸后,文火(保持微沸状态)煎2 h。采用60目筛网滤过,药材中再加入约10倍量70%乙醇,大火煮沸后,文火煎2 h。合并2次提取液,水浴浓缩后60℃真空干燥为粉末,作为大花红景天乙醇提取物,提取率为52%。
同法另置大花红景天乙醇提取液,浓缩至生药与浓缩药液体积比约为1∶1,以离心半径17.8 cm,10 000 r/min离心10 min,参照文献[3]的提取方法,取上清液过D-101大孔吸附树脂柱,以95%乙醇洗脱,收集洗脱液,浓缩后60℃真空干燥为粉末,作为大花红景天乙醇提取物大孔树脂吸附部分,即大花红景天总黄酮,提取率为24%。以山柰素为对照品,采用紫外分光光度法检测提取物中总黄酮含量为43.6%。
所有未吸附部分水浴浓缩后60℃真空干燥为粉末,为乙醇提取物大孔树脂未吸附部分,即大花红景天乙醇提取其余成分,提取率为28%。
1.3 照射条件
采用北京师范大学化学学院钴源60Coγ射线照射,小鼠单次全身照射的吸收剂量为3.5 Gy,剂量率为1.0 Gy/min,源靶距1.15 m。
1.4 实验动物分组及给药方案
BALB/c小鼠60只,SPF级,雌雄各半,6~8周龄,体重(20±2)g,购自北京斯贝福生物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0002。在中国疾病预防控制中心职业卫生所动物实验室饲养,实验动物设施使用许可证号:SYXK(京)2014-0043,饲养条件为光照12 h,饲养温度23~26℃,湿度40%。小鼠适应性喂养2 d后按体重编号,按随机数字表法进行分组,设正常组、对照组、乙醇提取物组、总黄酮组、乙醇提取其余成分组,每组12只。按临床人用剂量推算大花红景天生药小鼠给药剂量为0.9 g/kg,因此按提取率计算给药剂量:乙醇提取物组为0.468 g/kg,总黄酮组为0.216 g/kg,乙醇提取其余成分组为0.252 g/kg。模型复制后立即灌胃给药,20 ml/kg,1次/d,连续给药7 d。正常组和对照组给予等体积的纯水。
1.5 小鼠体重观察
取照射前1 d,以及照射后1、4、7、10、13和16 d,共7个时间点,对各组小鼠称重,观察体重变化。
1.6 小鼠外周血象观察
小鼠接受全身一次性3.5 Gyγ射线照射,在照射前1 d,以及照射后1、4、7、10、13和16 d,共7个时间点,每只小鼠尾静脉取血20μl,使用SYSMEX POCH-100iv Diff型血球仪检测外周血象。
1.7 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较用重复测量设计的方差分析,组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠体重比较
照射前,各组小鼠毛色及活动正常。受照射后,正常组小鼠保持正常,对照组和给药组小鼠出现不同程度的皮毛光泽度下降,精神萎靡,饮食及饮水量下降。
正常组、对照组、大花红景天各成分组在照射前1 d,以及照射后1、4、7、10、13和16d的体重比较,采用重复测量设计的方差分析,结果:①不同时间点小鼠体重有差别(F=52.725,P=0.000);②各组小鼠体重无差别(F=0.878,P=0.483),正常组、乙醇提取物组、总黄酮组、乙醇提取其余成分组小鼠体重与对照组比较,差异无统计学意义(P>0.05);③各组小鼠体重变化趋势有差别(F=2.324,P=0.006)。见表1和图1。
表1 各组小鼠不同时间点体重比较 (n =12,g,±s)

表1 各组小鼠不同时间点体重比较 (n =12,g,±s)
组别 照射前1 d 照射后1 d 照射后4 d 照射后7 d 照射后10 d 照射后13 d 照射后16 d正常组 20.24±0.98 20.48±1.15 19.83±1.08 19.93±1.29 20.16±1.57 20.38±1.63 20.90±1.69对照组 20.60±0.81 20.22±0.91 18.42±1.03 19.38±0.92 20.17±0.94 20.35±0.96 20.94±1.06乙醇提取物组 19.89±0.90 19.72±0.95 18.47±1.08 19.06±1.60 19.57±1.69 20.17±1.56 20.30±1.33总黄酮组 20.45±1.17 20.75±1.01 19.80±1.13 19.73±1.69 20.05±1.61 20.73±1.39 20.82±1.61乙醇提取其余成分组 20.14±0.82 20.28±0.93 19.06±1.11 19.45±0.84 19.77±0.85 20.65±0.95 20.53±0.91

图1 各组小鼠不同时间点体重变化趋势
2.2 各组小鼠外周血象比较
2.2.1 白细胞数 正常组、对照组、大花红景天各成分组在照射前1 d,以及照射后1、4、7、10、13和16 d测量的白细胞数比较,采用重复测量设计的方差分析,结果:①不同时间点小鼠白细胞数有差别(F=68.131,P=0.000)。②各组小鼠白细胞数有差别(F=215.402,P=0.000),正常组、乙醇提取物组、总黄酮组、乙醇提取其余成分组小鼠白细胞数高于对照组(P<0.05);乙醇提取物组、乙醇提取其余成分组小鼠白细胞数与总黄酮组比较,差异无统计学意义(P>0.05)。③各组小鼠白细胞数变化趋势有差别(F=7.013,P=0.000)。见表2和图2。
表2 各组小鼠不同时间点外周血白细胞数比较 (n =12,×109/L,±s)
表2 各组小鼠不同时间点外周血白细胞数比较 (n =12,×109/L,±s)
组别 照射前1 d 照射后1 d 照射后4 d 照射后7 d 照射后10 d 照射后13 d 照射后16 d正常组 9.80±2.62 10.37±2.72 11.51±1.85 10.67±3.27 10.50±2.07 10.40±1.69 10.53±1.18对照组 9.00±0.98 2.09±1.13 1.48±0.56 3.08±1.60 2.62±0.93 2.55±0.47 3.82±1.25乙醇提取物组 8.80±2.45 2.49±0.83 1.98±1.03 3.03±1.21 4.88±1.51 3.10±1.14 4.42±1.05总黄酮组 9.38±3.47 2.59±0.60 1.83±0.62 3.33±1.76 5.02±1.37 3.93±1.25 4.43±1.33乙醇提取其余成分组 9.56±3.57 3.38±1.35 1.93±1.29 4.01±2.53 3.89±1.01 3.61±1.33 4.04±0.86

图2 各组小鼠不同时间点白细胞数变化趋势
2.2.2 红细胞数 正常组、对照组、大花红景天各成分组在照射前1 d,以及照射后1、4、7、10、13和16 d测量的红细胞数比较,采用重复测量设计的方差分析,结果:①不同时间点小鼠红细胞数有差别(F=13.401,P=0.000)。②各组小鼠红细胞数有差别(F=7.907,P=0.000),正常组、乙醇提取物组、总黄酮组、乙醇提取其余成分组小鼠红细胞数高于对照组(P<0.05);总黄酮组红细胞数高于乙醇提取物组、乙醇提取其余成分组(P<0.05)。③各组小鼠红细胞数变化趋势有差别(F=2.543,P=0.001)。见表3和图3。2.2.3 血红蛋白 正常组、对照组、大花红景天各成分组在照射前1 d,以及照射后1、4、7、10、13和16 d测量的血红蛋白含量比较,采用重复测量设计的方差分析,结果:①不同时间点小鼠血红蛋白含量有差别(F=18.265,P=0.000)。②各组小鼠血红蛋白含量有差别(F=10.299,P=0.000),正常组、乙醇提取物组、总黄酮组、乙醇提取其余成分组小鼠血红蛋白含量高于对照组(P<0.05);总黄酮组血红蛋白含量高于乙醇提取物组、乙醇提取其余成分组(P<0.05)。③各组小鼠血红蛋白含量变化趋势有差别(F=2.957,P=0.000)。见表4和图4。
表3 各组小鼠不同时间点外周血红细胞数比较 (n =12,×1012/L,±s)
表3 各组小鼠不同时间点外周血红细胞数比较 (n =12,×1012/L,±s)
组别 照射前1 d 照射后1 d 照射后4 d 照射后7 d 照射后10 d 照射后13 d 照射后16 d正常组 5.11±1.36 4.99±2.30 5.63±1.47 4.84±1.12 4.66±1.75 5.11±1.82 4.45±1.38对照组 4.40±0.91 4.41±2.17 3.69±1.53 2.95±1.60 2.65±1.32 2.73±0.77 4.15±1.38乙醇提取物组 4.86±1.03 4.38±1.03 5.74±1.89 3.03±1.26 3.19±0.96 3.55±1.14 5.31±2.06总黄酮组 5.17±0.32 5.66±1.20 7.40±2.16 4.90±1.32 4.02±1.12 5.21±1.61 4.97±1.41乙醇提取其余成分组 5.33±0.46 5.28±1.82 4.17±1.33 4.10±1.95 3.60±1.20 3.96±1.35 5.42±2.21

图3 各组小鼠不同时间点红细胞数变化趋势
表4 各组小鼠不同时间点外周血血红蛋白含量比较 (n =12,g/dl,±s)
表4 各组小鼠不同时间点外周血血红蛋白含量比较 (n =12,g/dl,±s)
组别 照射前1 d 照射后1 d 照射后4 d 照射后7 d 照射后10 d 照射后13 d 照射后16 d正常组 7.38±2.43 7.28±2.25 7.79±1.39 7.10±1.52 6.49±0.77 7.34±1.75 7.07±1.80对照组 7.46±0.79 7.04±1.54 4. 77±1.44 4.71±1.81 3.37±0.53 4.50±1.01 6.36±1.98乙醇提取物组 7.58±1.58 6.58±1.55 7.26±1.71 4.90±1.53 4.96±1.49 5.21±1.60 7.06±1.89总黄酮组 7.66±0.80 8.80±1.37 7.92±1.26 7.70±1.49 6.43±1.42 7.91±1.73 7.08±1.75乙醇提取其余成分组 7.73±0.98 7.57±2.53 5.84±1.97 5.66±1.37 5.58±1.73 5.44±1.80 7.48±2.65
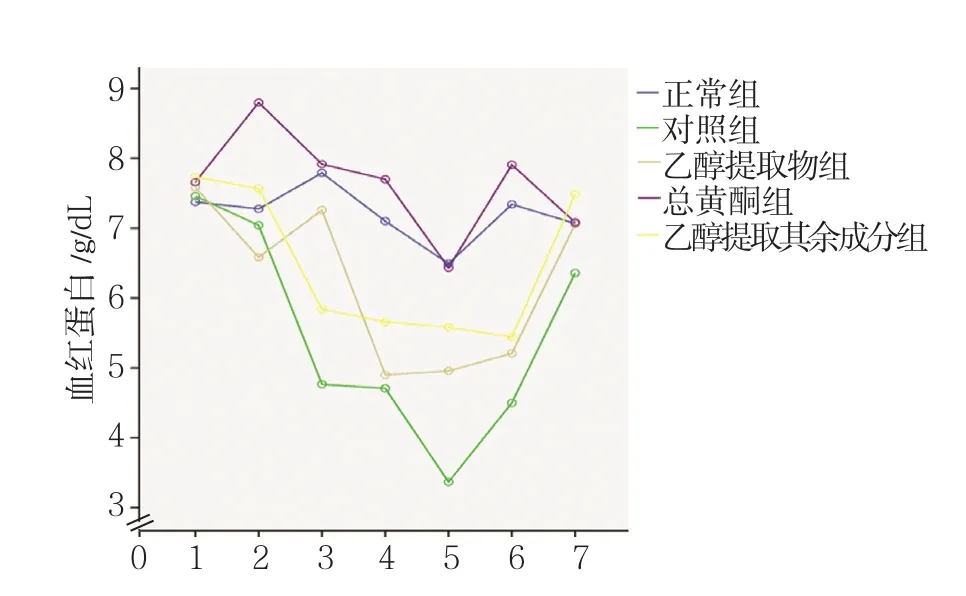
图4 各组小鼠不同时间点血红蛋白含量变化趋势
2.2.4 血小板数 正常组、对照组、大花红景天各成分组在照射前1 d,以及照射后1、4、7、10、13和16 d测量的血小板数比较,采用重复测量设计的方差分析,结果:①不同时间点小鼠血小板数有差别(F=54.470,P=0.000)。②各组小鼠血小板数有差别(F=9.906,P=0.000),正常组、乙醇提取物组、总黄酮组、乙醇提取其余成分组小鼠血小板数高于对照组(P<0.05);总黄酮组血小板数与乙醇提取物组、乙醇提取其余成分组比较,差异无统计学意义(P>0.05)。③各组小鼠血小板数变化趋势有差别(F=3.571,P=0.009)。见表5和图5。
表5 各组小鼠不同时间点外周血血小板数比较 (n =12,×109/L,±s)

表5 各组小鼠不同时间点外周血血小板数比较 (n =12,×109/L,±s)
组别 照射前1 d 照射后1 d 照射后4 d 照射后7 d 照射后10 d 照射后13 d 照射后16 d正常组 641.83±201.71 725.58±259.21 777.00±150.29 653.75±209.14 584.67±105.15 708.75±227.57 724.83±253.91对照组 621.92±173.69 471.92±117.63 545.50±177.65 273.67±129.33 249.58±115.29 402.92±133.95 723.92±241.80乙醇提取物组 686.42±186.13 568.67±162.50 759.17±215.70 278.75±110.42 334.67±62.54 510.08±142.26 810.75±151.37总黄酮组 702.58±139.14 681.25±164.89 789.83±260.23 386.83±106.04 340.50±90.84 624.92±91.82 688.33±138.83乙醇提取其余成分组 758.75±185.96 683.67±253.49 545.58±189.78 323.75±108.09 312.33±86.89 491.83±88.30 837.58±253.44

图5 各组小鼠不同时间点血小板数变化趋势
3 讨论
辐射损伤是一种病理、生理过程十分复杂的疾患,对人体的危害具有多系统、多靶点的特点,1种或几种化合物对辐射损伤的防治很难达到全面、高效和稳定的效果。我国的传统中药含有多种成分,具有免疫调节、抗氧化和清除自由基等多种药理活性,应用在抗辐射作用方面可能起到综合治疗的作用。因此,许多具有活血、补血、抗氧化和增强免疫功能的中药具有抗辐射作用潜力,可以作为辐射损伤防治候选药物,具有广阔的应用前景。本课题组对多种中药进行了抗辐射药效的评价,其中大花红景天对小鼠具有较好的辐射防护作用。为深入探讨大花红景天的辐射防护作用,采用化学分离方法针对大花红景天的不同成分进行抗辐射活性评价是十分必要的。已有对红景天的化学成分研究结果表明,大花红景天的化学成分主要包括醇苷类[4]、黄酮类[4-5]、多糖类[6]、挥发油类[7]等成分,其中对以红景天苷为主的醇苷类成分研究较多,对黄酮等其他成分研究较少。而既往对红景天属植物的化学及药理作用研究发现,总黄酮具有抗氧化[8-9]、抗病毒[10]、抗肿瘤[11]等多种药理活性。并且有观点认为,红景天抗氧化作用的主要药理活性成分是山柰素等黄酮类成分,而非红景天苷[8]。因此本课题组推测,大花红景天中的总黄酮可能具有良好的抗辐射活性。本实验重点考察大花红景天的黄酮类成分对电离辐射损伤小鼠体重及外周血象的影响。
同时本课题组对大花红景天的提取工艺研究表明,70%乙醇提取物的总黄酮含量远高于水提物,因此本实验采用乙醇提取大花红景天,然后经大孔树脂吸附的方法制备总黄酮。测定结果表明,大花红景天总黄酮以山柰素计,含量为43.6%。
为全面评价大花红景天中不同成分的抗辐射活性,本研究还比较了乙醇提取物、乙醇提取其余成分的抗辐射作用。为确保各组实验结果的可比性,本研究以人临床使用剂量推算小鼠给药生药剂量,各组小鼠均以此剂量作为给药生药剂量,然后通过各成分的提取率计算给药剂量。
机体造血系统是对辐射高度敏感的组织,电离辐射可以导致骨髓抑制、造血组织功能障碍、造血微环境损伤等[12-14],同时造血免疫功能在辐射后也明显受抑制[13,15],所以造血系统的恢复是评价药物抗辐射活性的重要因素[16]。本实验研究结果显示,小鼠经3.5 Gy照射后,外周血象中白细胞数、红细胞数、血红蛋白含量和血小板数均下降;与对照组比较,乙醇提取物、总黄酮和乙醇提取其余成分对受照射小鼠外周血白细胞、红细胞、血红蛋白、血小板均表现出促升高的作用;而与乙醇提取物、乙醇提取其余成分比较,总黄酮对红细胞数和血红蛋白含量的促升高作用明显增强。上述实验结果提示,大花红景天各成分具有明显抑制γ射线辐射所致的小鼠外周血象降低的作用,其中总黄酮可能是主要的抗辐射活性成分。
大花红景天总黄酮对外周血象各项指标的影响表现出不同的特点;与对照组比较,抑制白细胞数、血红蛋白含量和血小板数下降的作用最为显著;而对红细胞数降低的干预在受照射初期并不明显。对于该现象的原因,有研究认为,红细胞存活时间比其他血细胞长,生存寿命120 d,并且对放射不敏感,所以照射早期红细胞并不出现明显的数量、形态、血红蛋白和血球容积等变化,而且在放射病早期,由于晚幼红细胞继续成熟,可能有网织红细胞和红细胞的一时增多[16-17]。
照射剂量的选择也是本实验的关键问题,剂量过小达不到模型复制的要求,剂量过大,小鼠辐射损伤严重甚至死亡,药物治疗难以逆转。经过预实验,本研究选择3.5 Gy照射剂量复制模型小鼠,结果表明,模型小鼠可用于有效评价大花红景天各提取成分的干预作用。
综上所述,大花红景天总黄酮有很好地抑制小鼠电离辐射损伤导致的外周血象下降的作用,实验结果为大花红景天的抗辐射损伤物质基础研究提供了重要的参考依据。本课题组正在对大花红景天总黄酮中的化学成分进行分离,并采用更多的活性指标进行抗辐射活性筛选,以期为开发高效低毒、成分明确、质控稳定的新型辐射损伤防治中药制剂产品提供科学依据。
