氟啶胺对斑马鱼胚胎线粒体氧化磷酸化和多巴胺系统基因表达的干扰效应
2018-09-17郑珊珊王晓红赵元慧
郑珊珊,王晓红,赵元慧
东北师范大学环境学院,长春 130117
氟啶胺是一种广谱性氨基吡啶类农用杀菌剂,它是一种典型的线粒体氧化磷酸化解偶联试剂[1-2]。该杀菌剂对水生生物和水生环境具有非常高的毒性[3],因此氟啶胺产品的说明中明确提出该杀菌剂不能够通过空中喷洒或灌溉系统施加,以防威胁到水生生态系统的安全。但是仍有少量报导指出氟啶胺被排放到水环境中[4-5]。目前,关于氟啶胺在水环境中实测浓度的相关报导非常少,但是有研究者根据氟啶胺的最大使用速率计算,该杀菌剂在地表水中的慢性长期浓度约为3.15 μg·L-1,而急性短期浓度最高可达18 μg·L-1[3]。此外,有研究者根据郁金香栽培中氟啶胺的实际应用量模拟了一个室内淡水微生态系统,结果表明微生态系统水环境中约有氟啶胺残留量0.27~6.7 μg·L-1[5]。氟啶胺对鱼类具有非常高的毒性,且在鱼类体内能够高度富集[3],因此氟啶胺在水环境中的残留仍然是备受关注的环境问题。
目前,很多证据表明,动物患帕金森病的原因之一是接触农药。该病的特征是动物体内多巴胺神经元死亡,且产生运动行为障碍[6]。帕金森病的发病机理与多巴胺神经细胞内的氧化胁迫和线粒体功能障碍有关[7-8]。氟啶胺在哺乳动物细胞中是一种有效的线粒体解偶联试剂,其原理主要是通过氟啶胺分子上氨基的质子化和去质子化[1]。氟啶胺对细胞中的能量产生具有特异性抑制作用,该杀菌剂能够抑制细胞内的氧化磷酸化过程[9]。有研究者提出,氟啶胺能够通过作用于线粒体呼吸传递链中的复合酶I引起活性氧物种(ROS)的过量产生,从而导致多巴胺神经细胞的死亡[10]。细胞器线粒体是细胞中产生能量的主要场所,而能量产生不足很可能导致生物体发生神经褪变性疾病和运动功能障碍[11]。因此,研究氟啶胺对线粒体和多巴胺系统的毒性效应对于探究氟啶胺的毒性作用机制具有关键性作用。
斑马鱼是用于研究人类疾病和筛选化学品的有效脊椎动物模型[11-12]。由于氟啶胺是典型的线粒体解偶联试剂,因此我们测定了氟啶胺对胚胎线粒体氧气消耗速率的影响。与此同时,生物体内线粒体功能异常往往使多巴胺系统发生改变,因此我们测定了氟啶胺对胚胎中与多巴胺信号传导有关基因的转录水平。本文的目标是研究氟啶胺对斑马鱼胚胎线粒体呼吸速率和多巴胺神经信号传导的不利影响。
1 材料与方法(Methods and materials)
1.1 实验材料
成年野生型斑马鱼(Danio rerio)来源于美国佛罗里达大学动物保护中心。杀菌剂氟啶胺(79622-59-6)、二甲基亚砜、寡霉素、羰基-氰-对-三氟甲氧基苯肼(FCCP)和叠氮化钠均为分析纯化学试剂,购自美国西格玛奥德里奇化学制品有限公司;海马生物能量测定仪XFe24购自美国海马生物科技有限公司;TRIzol试剂购自美国生命技术有限公司;2100生物分析仪购自美国安捷伦科技有限公司;RNA纯化试剂盒购自德国快而精有限公司;量子荧光定量仪Qubit®2.0购自美国赛默科技有限公司;T100TM热循环仪购自美国生命科学有限公司;CFX实时定量PCR检测系统购自美国伯乐公司。
1.2 动物暴露实验
根据Westerfield[13]中斑马鱼饲养方法,成年野生型斑马鱼的生活水温维持在26 ℃,保持每日光照14 h;根据Kimmel[8]所述方法进行斑马鱼胚胎的收集。暴露实验前,将氟啶胺溶于DMSO中配制成储备液,并稀释至各测试溶液(0.01% DMSO)。本文中,使用产卵后6 h的斑马鱼胚胎进行实验,分别暴露于含0~1.0 μmol·L-1氟啶胺溶液中,各溶液中加入10只胚胎,设定3个平行,经96 h暴露后,观察各溶液中胚胎的存活和畸形情况,计算氟啶胺对斑马鱼胚胎的96 h半数致死浓度,半数致死浓度是指受试生物半数死亡时的毒物剂量,本文通过应用Logistic模型拟合氟啶胺对斑马鱼胚胎的剂量效应关系来确定LC50值。
获得氟啶胺对斑马鱼胚胎的LC50值后,将产卵后6 h的斑马鱼胚胎分别在对照组溶液(0.01% DMSO)和实验组溶液(LC50= 0.5 μmol·L-1氟啶胺)中暴露24 h,各浓度添加50只胚胎,平均分为5组,最终各组取10只胚胎进行线粒体呼吸耗氧速率的测定(N = 10)。
将产卵6 h的斑马鱼胚胎分别在对照组溶液(0.01% DMSO)和实验组溶液(LC50=0.5 μmol·L-1氟啶胺)中暴露96 h,各浓度添加120只胚胎,平均分为6组,收集各组存活胚胎为一个样品,将这些样品储存于-80 ℃冰箱中,以待后续基因转录水平的测定(N = 6)。
1.3 线粒体呼吸作用
斑马鱼胚胎经过24 h暴露后用于评价其线粒体呼吸速率。应用海马生物能量测定仪检测斑马鱼胚胎的线粒体氧气消耗速率。首先,在对照组和实验组中各挑选10只斑马鱼胚胎转移至24孔板各微室内,其余4个微室用于背景值测定。在实验中将以下试剂依次注入各微室内,改变线粒体呼吸状态:寡霉素、羰基-氰-对-三氟甲氧基苯肼(FCCP)和叠氮化钠的测试结果如图1所示[14]。起初,仪器对斑马鱼胚胎的基础呼吸速率检测10次;然后,向微室内注入寡霉素抑制ATP合成,此时斑马鱼氧气消耗速率的减少量可表示ATP产量,基础呼吸速率和ATP产量的差值为质子漏,该过程中仪器对斑马鱼的耗氧速率检测18次;其次,向微室内注入FCCP使胚胎达到最高呼吸速率,其高出基础呼吸速率的部分称为储备能量,该过程中仪器对斑马鱼的耗氧速率检测8次;最后,向微室内注入叠氮化钠抑制线粒体呼吸,剩余氧气消耗速率指非线粒体呼吸部分,该过程中仪器对斑马鱼的耗氧速率检测24次。
1.4 RNA提取和RT-QPCR检测
对照组和实验组的斑马鱼胚胎经96 h暴露后用于基因转录情况的检测。首先向各样品中加入TRIzol试剂对生物体内的RNA进行提取,然后使用2100生物分析仪检测RNA的完整性,其次使用RNA纯化试剂盒对RNA进行提纯,再次使用量子荧光定量仪检测RNA的浓度,最后各样品使用相同质量的RNA反转录形成DNA。
应用CFX实时定量PCR检测系统对各样品中的DNA进行荧光染色并定量扩增。热循环参数参照Wang等[14]中方法。我们检测了3个管家基因的转录水平,它们分别为核糖体亚基18 (rps18),肌动蛋白(β-actin)和核糖体蛋白L13α (rpl13α),用于使目标基因的转录水平标准化,CFX管理软件给出这些管家基因的综合M值为0.98 (CV = 0.34)。表1为本文所检测基因的引物列表,其中包括锌铜超氧化物歧化酶(sod1),锰超氧化物歧化酶(sod2),过氧化氢酶(cat),酪氨酸羟化酶(th),多巴胺运载体(dat)以及多巴胺受体(drd1, drd2a, drd2b, drd3, drd4a, drd4b, drd4c, drd7)。
1.5 统计分析
本文应用第六版GraphPad Prism对线粒体呼吸氧气消耗速率和多巴胺系统相关基因转录水平的数据进行统计分析,我们将数据表示为平均值±标准误差。我们应用t检验中曼-惠特尼检验方法检测对照组样品与实验组样品的线粒体呼吸氧气消耗速率、抗氧化系统相关基因转录水平和多巴胺系统相关基因转录水平是否具有显著性差异,P值设为0.05。这种方法假设2个样本分别来自除了总体均值以外完全相同的2个总体,目的是检验这2个总体的均值是否有显著的差别。曼-惠特尼检验方法可以看作是对两均值之差参数检验方式的T检验。这种方法适用于数据总体分布类型未知,或数据总体分布类型已知,但并非正态分布的数据类型,生物数据往往具有这种特点,因此本文选择该方法进行统计分析。
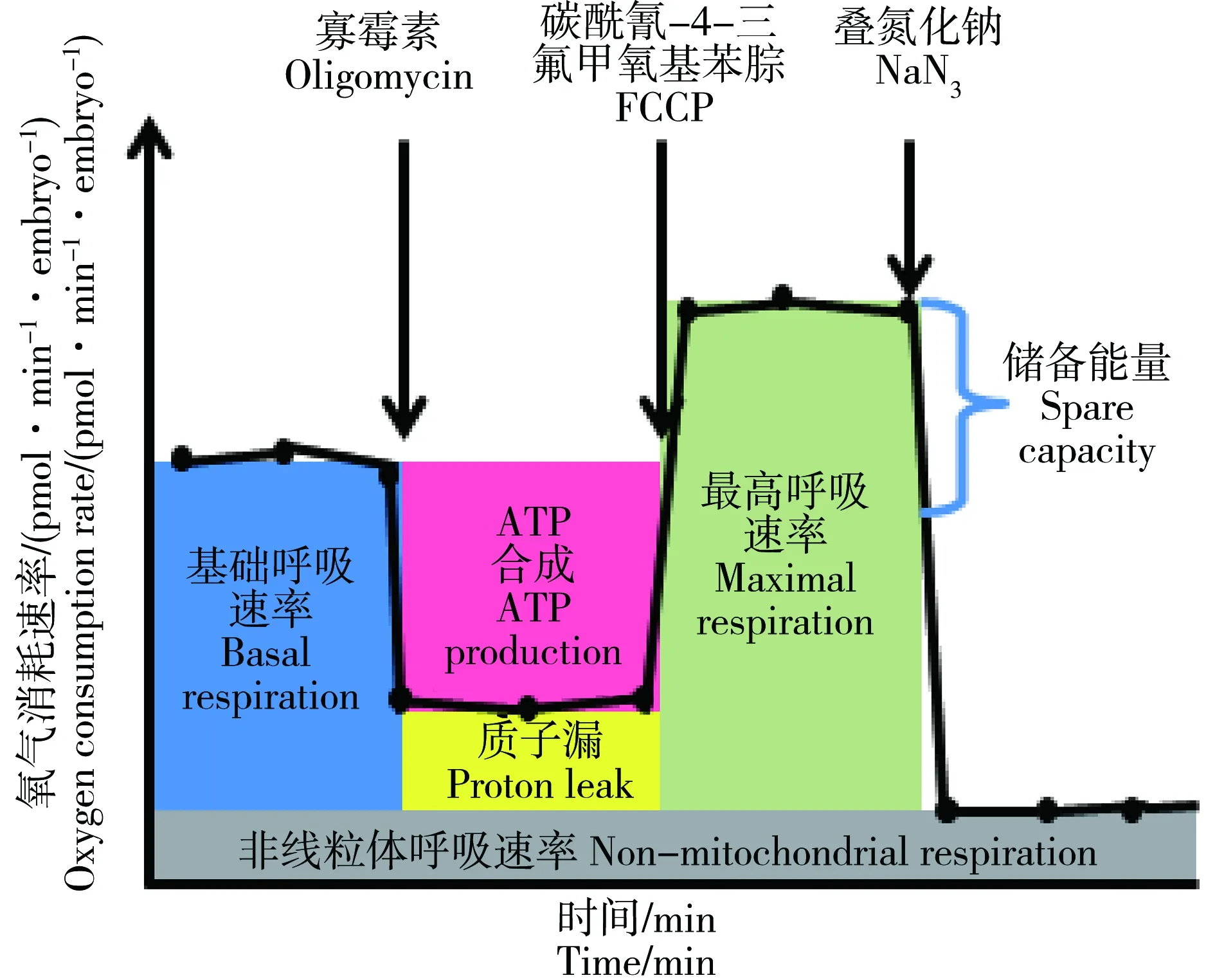
图1 海马生物能量测定仪线粒体呼吸氧气消耗速率测试总描述图Fig. 1 Seahorse diagram depicting profile of oxygen consumption rate throughout the assay
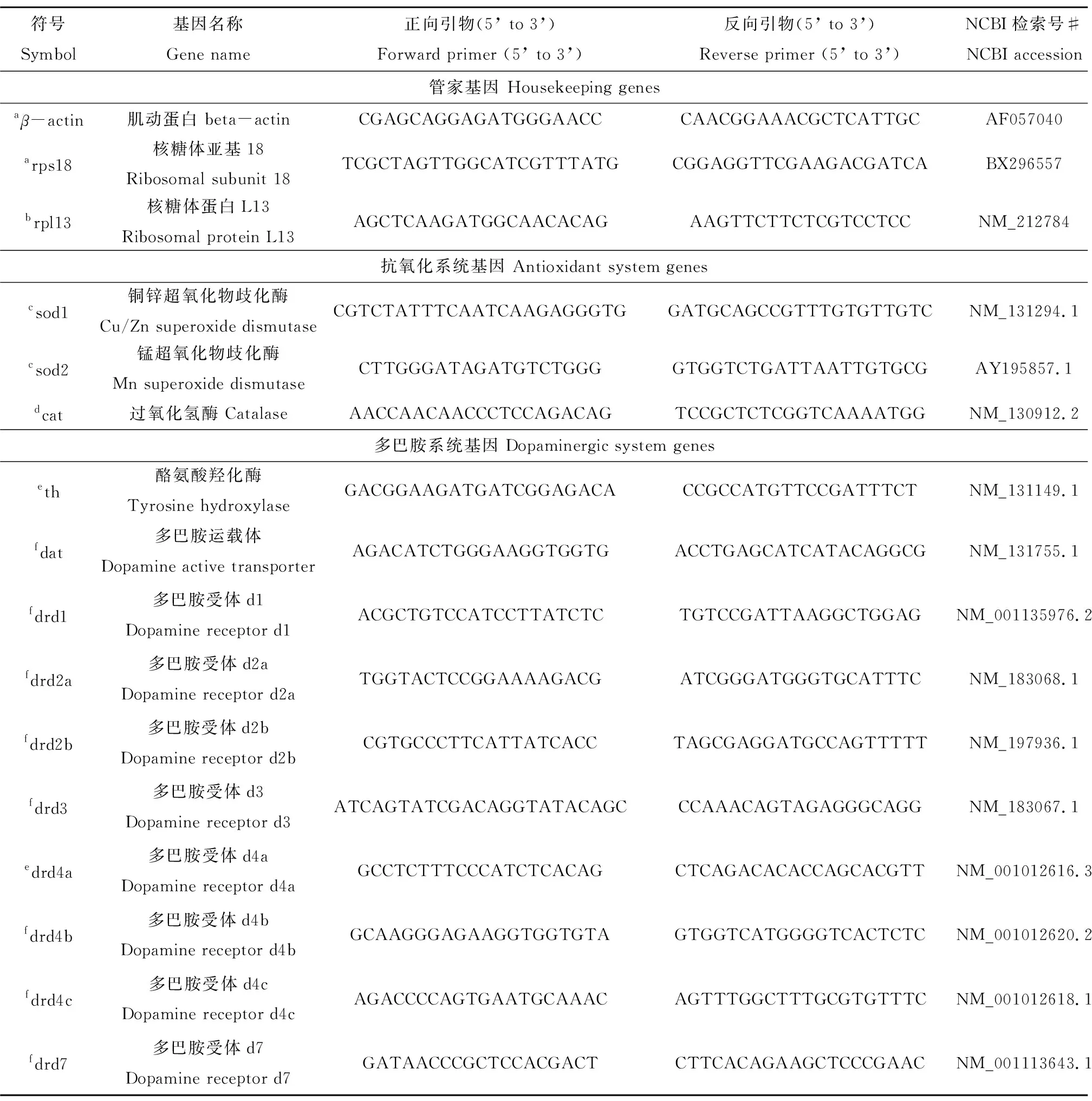
符号Symbol基因名称Gene name正向引物(5’ to 3’)Forward primer (5’ to 3’)反向引物(5’ to 3’)Reverse primer (5’ to 3’)NCBI检索号#NCBI accession管家基因 Housekeeping genesaβ-actin肌动蛋白 beta-actinCGAGCAGGAGATGGGAACCCAACGGAAACGCTCATTGCAF057040arps18核糖体亚基18Ribosomal subunit 18TCGCTAGTTGGCATCGTTTATGCGGAGGTTCGAAGACGATCABX296557brpl13核糖体蛋白L13Ribosomal protein L13AGCTCAAGATGGCAACACAGAAGTTCTTCTCGTCCTCCNM_212784抗氧化系统基因 Antioxidant system genescsod1铜锌超氧化物歧化酶Cu/Zn superoxide dismutaseCGTCTATTTCAATCAAGAGGGTGGATGCAGCCGTTTGTGTTGTCNM_131294.1csod2锰超氧化物歧化酶Mn superoxide dismutase CTTGGGATAGATGTCTGGGGTGGTCTGATTAATTGTGCGAY195857.1dcat过氧化氢酶 CatalaseAACCAACAACCCTCCAGACAGTCCGCTCTCGGTCAAAATGGNM_130912.2多巴胺系统基因 Dopaminergic system geneseth酪氨酸羟化酶Tyrosine hydroxylaseGACGGAAGATGATCGGAGACACCGCCATGTTCCGATTTCTNM_131149.1fdat多巴胺运载体Dopamine active transporterAGACATCTGGGAAGGTGGTGACCTGAGCATCATACAGGCGNM_131755.1fdrd1多巴胺受体d1Dopamine receptor d1ACGCTGTCCATCCTTATCTCTGTCCGATTAAGGCTGGAGNM_001135976.2fdrd2a多巴胺受体d2aDopamine receptor d2aTGGTACTCCGGAAAAGACGATCGGGATGGGTGCATTTCNM_183068.1fdrd2b多巴胺受体d2bDopamine receptor d2bCGTGCCCTTCATTATCACCTAGCGAGGATGCCAGTTTTTNM_197936.1fdrd3多巴胺受体d3Dopamine receptor d3ATCAGTATCGACAGGTATACAGCCCAAACAGTAGAGGGCAGGNM_183067.1edrd4a多巴胺受体d4aDopamine receptor d4aGCCTCTTTCCCATCTCACAGCTCAGACACACCAGCACGTTNM_001012616.3fdrd4b多巴胺受体d4bDopamine receptor d4bGCAAGGGAGAAGGTGGTGTAGTGGTCATGGGGTCACTCTCNM_001012620.2fdrd4c多巴胺受体d4cDopamine receptor d4cAGACCCCAGTGAATGCAAACAGTTTGGCTTTGCGTGTTTCNM_001012618.1fdrd7多巴胺受体d7Dopamine receptor d7GATAACCCGCTCCACGACTCTTCACAGAAGCTCCCGAACNM_001113643.1
Note:aMcCurley A T, Callard G V. Characterization of housekeeping genes in zebrafish: Male-female differences and effects of tissue type, developmental stage and chemical treatment [J]. BMC Molecular Biology, 2008, 9: 102bZucchi S, Blüthgen N, Ieronimo A, et al. The UV-absorber benzophenone-4 alters transcripts of genes involved in hormonal pathways in zebrafish (Danio rerio) eleuthero-embryos and adult males [J]. Toxicology and Applied Pharmacology, 2011, 250: 137-146cLin C T, Tseng W C, Hsiao N W, et al. Characterization, molecular modelling and developmental expression of zebrafish manganese superoxide dismutase [J]. Fish and Shellfish Immunology, 2009, 27: 318-324dWang Q, Liu S, Hu D Y, et al. Identification of apoptosis and macrophage migration events in paraquat-induced oxidative stress using a zebrafish model [J]. Life Science, 2016, 157: 116-124eChen Y C, Priyadarshini M, Panula P. Complementary developmental expression of the two tyrosine hydroxylase transcripts in zebrafish [J]. Histochemistry and Cell Biology, 2009, 132: 375-381fSarty K I, Cowie A, Martyniuk C J. The legacy pesticide dieldrin acts as a teratogen and alters the expression of dopamine transporter and dopamine receptor 2a in zebrafish (Danio rerio) embryos [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2017, 194: 37-47
2 结果与讨论(Results and discussion)
2.1 氟啶胺对斑马鱼胚胎的96 h半数致死浓度
为了获取氟啶胺对斑马鱼胚胎的96 h半数致死浓度LC50值,使用产卵6 h的斑马鱼胚胎置于0.01% DMSO溶液中作为对照组,实验组氟啶胺暴露浓度范围为0.1~1 μmol·L-1。结果表明,经96 h暴露后斑马鱼胚胎的死亡率随着浓度的增加而增加,如图2所示。0.1~0.3 μmol·L-1氟啶胺对斑马鱼胚胎具有轻微毒性,0.8~1 μmol·L-1氟啶胺会造成斑马鱼胚胎几乎100%死亡。经计算表明氟啶胺对斑马鱼胚胎的96 h半数致死浓度LC50值为0.5 μmol·L-1,该浓度导致斑马鱼表现出严重的卵黄囊水肿、心包水肿以及中轴骨骼发育异常等形态学变化,如图3所示。
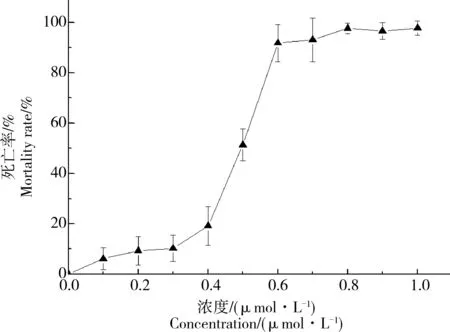
图2 斑马鱼胚胎经96 h暴露死亡率随氟啶胺浓度增加的变化曲线Fig. 2 The mortality of zebrafish embryos exposed to different doses of fluazinam after 96 h
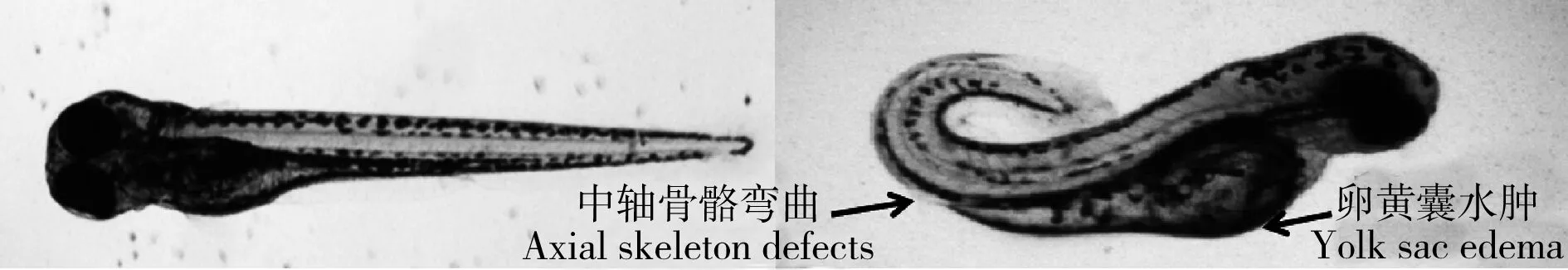
图3 LC50浓度氟啶胺导致斑马鱼胚胎形态发育异常Fig. 3 Fluazinam of LC50 level induced morphological abnormality in zebrafish embryos
尽管斑马鱼胚胎外侧的绒毛膜对胚胎具有一定保护作用,但氟啶胺对斑马鱼胚胎仍具有相当高的毒性,96 h半数致死浓度LC50为0.5 μmol·L-1。此外,该杀菌剂极易在鱼体内富集,有研究者发现,氟啶胺在蓝鳃太阳鱼体内生物富集因子BCF值的范围高达720~960[15]。氟啶胺的高疏水性决定该杀菌剂极易被生物体吸收,且其线粒体解偶联活性决定该杀菌剂易对线粒体呼吸产生反应性活性。有关报道表明,氟啶胺能够引起哺乳动物在形态上的发育缺陷,如大鼠或兔子的骨骼发育不良[16]。本文中,氟啶胺同样能够引起斑马鱼胚胎的形态发育异常,其中中轴骨骼发育异常和心脏水肿是最为常见的发育缺陷。由于导致生物体形态发育异常的原因较多且复杂,化学品在一个生物体系中往往具有多重复杂的作用机制。其中一个可能的原因是,线粒体功能异常导致鱼类生长发育和心血管功能异常,且有研究者发现,线粒体内ATP产量减少能够导致鱼类在发育过程中原肠胚的形成受到严重阻碍[17]。另外一个可能的原因是多巴胺神经传导异常在一定程度上能够导致斑马鱼形态发育异常[18]。
2.2 LC50浓度氟啶胺改变线粒体呼吸耗氧速率和抗氧化系统相关基因的转录水平
图4展示了斑马鱼胚胎经过24 h暴露后不同来源线粒体及非线粒体呼吸耗氧速率的总描述图。LC50浓度的氟啶胺能够显著地抑制胚胎的基础呼吸速率(P = 0.0317)和ATP合成(P = 0.0456)。在线粒体呼吸过程中,氢离子在复合酶的作用下由基质转移至膜间隙,大量氢离子再通过ATP合成酶从膜间隙转移到基质中消耗氧气并推动ATP形成,寡霉素能够抑制ATP合成酶,从而导致氢离子无法通过ATP合成酶进入基质中,此时耗氧速率的减少量能够表示ATP合成量。但少量氢离子通过直接跨膜进入基质中消耗氧气,该部分耗氧速率能够衡量质子漏量。FCCP是一种解偶联试剂,能够高度改变膜通透性,使大量氢离子直接跨膜进入基质中,此时ATP无法合成,但线粒体耗氧速率达到最高值,其高出基础呼吸速率的部分表示储备能量,最高呼吸速率和储备能量能够反映生物体对外界刺激做出响应的能力。最后,叠氮化钠能够完全抑制线粒体呼吸,剩余耗氧速率可表示非线粒体呼吸速率。本文中,氟啶胺对最高呼吸速率、储备能量、质子漏和非线粒体呼吸未发生显著性效应,如图4所示。
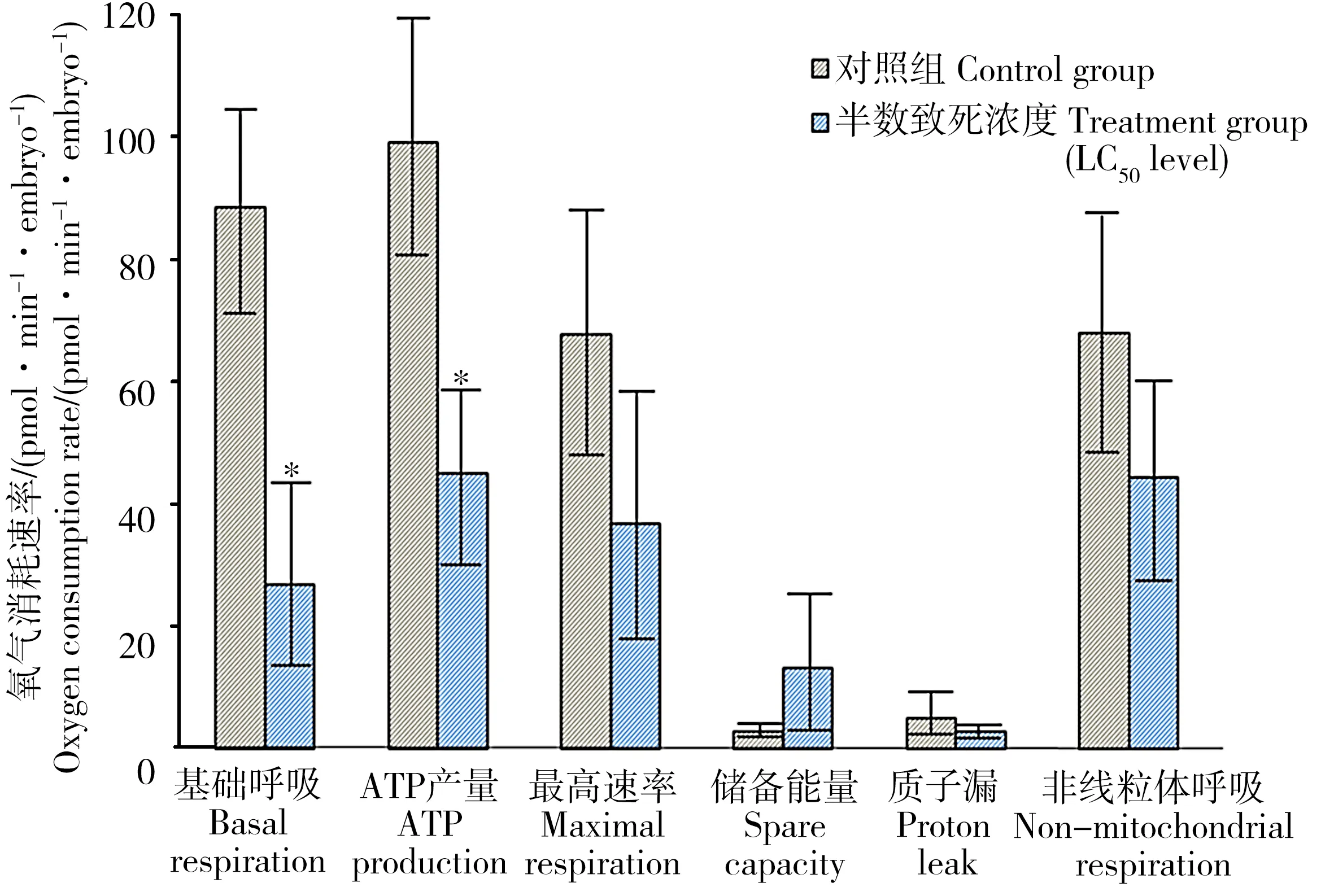
图4 线粒体各来源呼吸耗氧速率统计分析图注: *表示实验组与对照组具有显著性差异。Fig. 4 Oxygen consumption rate of different mitochondrial respiratory sourcesNote: * indicate a significance of difference between the treatment and the control at P < 0.05.
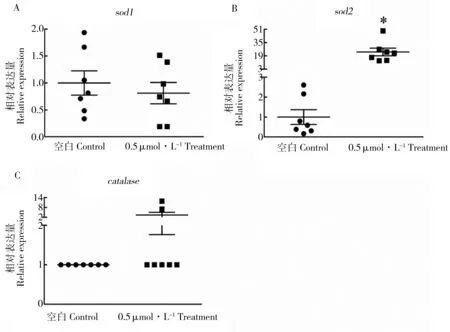
图5 抗氧化系统相关基因的转录水平注:*表示实验组与对照组具有显著性差异(P<0.05)。Fig. 5 The transcript levels of genes related to anti-oxidative systemNote: * indicate a significance of difference between the treatment and the control at P < 0.05.
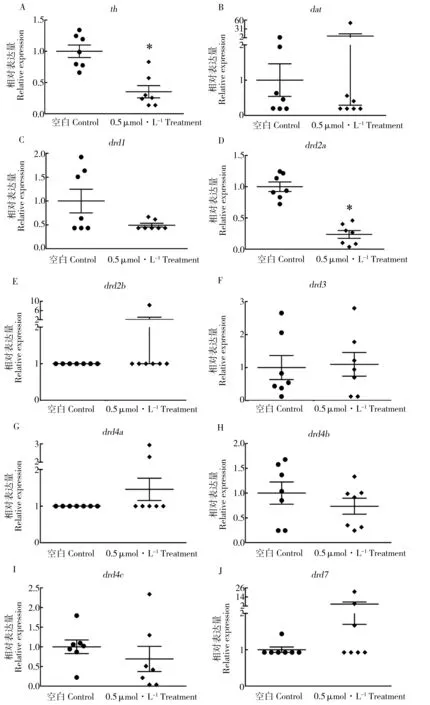
图6 多巴胺系统相关基因的转录水平注: *表示实验组与对照组具有显著性差异(P<0.05)。Fig. 6 The transcript levels of genes related to dopamine systemNote: * indicate a significance of difference between the treatment and the control at P < 0.05.
细胞的能量内稳态对鱼类的发育十分重要。有研究者发现,线粒体功能紊乱能够引起斑马鱼的发育异常[17]。本文中,斑马鱼的线粒体生物能量稳态严重受到了LC50浓度氟啶胺的干扰,这主要体现在胚胎的基础呼吸速率和ATP产生量显著降低。氟啶胺是哺乳动物细胞内一种典型的线粒体解偶联试剂,该杀菌剂能够引起线粒体质子漏和ATP减产[18]。本实验结果表明氟啶胺也能引起鱼类细胞线粒体内氧化和磷酸化的解偶联。有研究报道,氟啶胺能够通过作用于线粒体电子传递链上的复合酶I,从而导致人类神经母细胞瘤SH-SY5Y细胞内的氧化还原状态失衡[10]。因此,氟啶胺对斑马鱼胚胎的线粒体呼吸作用具有一定毒性效应。
线粒体是生物体内产生氧化自由基的主要场所,因此线粒体功能异常将会激发生物体内的抗氧化系统[14]。在本文中,我们检测了胚胎的抗氧化系统相关基因的转录水平。结果表明,LC50浓度氟啶胺对sod1和cat的转录水平未产生显著性影响,但是对sod2的转录水平产生显著性影响,LC50浓度氟啶胺能够显著地促进sod2的转录(P = 0.0006),如图5所示。Sod2是在线粒体内发挥抗氧化作用的一种抗氧化酶,而sod1是在线粒体外发挥抗氧化作用的一种抗氧化酶[19]。我们的转录数据说明LC50浓度氟啶胺引发了线粒体内氧化自由基的产生,从而引发了线粒体功能异常。
2.3 LC50浓度氟啶胺干扰多巴胺通路关键基因的转录水平
为了检测氟啶胺对斑马鱼胚胎多巴胺神经系统的干扰效应,我们检测了与多巴胺神经通路相关基因的转录水平。结果表明,LC50浓度氟啶胺对斑马鱼胚胎的多巴胺神经通路具有显著的干扰效应。酪氨酸羟化酶(TH)在多巴胺合成中具有重要作用,LC50浓度氟啶胺导致胚胎内th的转录水平显著降低(P = 0.0041)。多巴胺运载体(DAT)能够回收突触间隙中过量的多巴胺,并终止多巴胺信号传导,多巴胺运载体dat的转录水平未显著受到LC50浓度氟啶胺的调控。另外,多巴胺受体(DRD)也是多巴胺通路的重要组成部分,本文检测了胚胎体内8个多巴胺受体drd的转录水平,其中唯一一个多巴胺受体drd2a的转录水平发生显著性变化(P = 0.0006)。本文多巴胺通路相关基因转录水平的统计分析结果见图6。
细胞内ROS过量积累能够干扰生物体多巴胺信号传导,细胞内线粒体功能异常也与生物体多巴胺神经细胞死亡有一定关系[20]。有研究报导,氟啶胺能够导致人类神经母细胞瘤SH-SY5Y细胞死亡[10],但目前没有研究者报导氟啶胺对完整生物体多巴胺神经通路的干扰效应。为了检测多巴胺信号传导紊乱在氟啶胺引发神经毒性中的作用,我们检测了酪氨酸羟化酶、多巴胺运载体和多巴胺受体的基因转录水平。氟啶胺暴露导致斑马鱼多巴胺系统中的酪氨酸羟化酶基因th和多巴胺受体基因drd2a的转录水平降低。这说明生物体内多巴胺系统是氟啶胺引发神经疾病的有效靶位。暴露于其他农用化学品也能够增加动物体内多巴胺神经元褪变的风险,如联吡啶类除草剂、有机氯类杀虫剂以及二硫代氨基甲酸盐类杀菌等等[21]。
本文测定了典型杀菌剂氟啶胺对斑马鱼胚胎的96 h半数致死浓度LC50值,并研究了该浓度下氟啶胺对斑马鱼胚胎体内线粒体呼吸耗氧速率和多巴胺神经通路有关基因转录水平的干扰效应。结果表明,LC50浓度氟啶胺能够显著地抑制斑马鱼的基础呼吸速率和ATP合成速率,这是因为氟啶胺是一种解偶联试剂,它能够改变线粒体内膜对质子的通透性,从而干扰线粒体氧化呼吸作用。LC50浓度氟啶胺还能够激发线粒体内sod2的转录水平增加,这说明氟啶胺引发的线粒体内氧化自由基生成也会导致线粒体功能异常。另外,LC50浓度氟啶胺能够干扰斑马鱼胚胎的多巴胺信号传导,从而使多巴胺的合成和接收受到阻碍。氟啶胺对斑马鱼胚胎具有极高的毒性效应,该杀菌剂在水环境中的残留仍然是备受关注的环境问题。
